钙黏蛋白-13表达下调对膀胱癌细胞上皮间质转化的影响
林英立,李艳丽,戚景光,马建国,李文平,孙 光
(徐州市肿瘤医院:1.泌尿外科;2.科教科,江苏徐州 221005;3.河北医科大学第三医院泌尿外科,河北石家庄 050051;4.天津医科大学第二医院泌尿外科,天津 300211)
·基础研究·
钙黏蛋白-13表达下调对膀胱癌细胞上皮间质转化的影响
林英立1,李艳丽2,戚景光1,马建国3,李文平3,孙光4
(徐州市肿瘤医院:1.泌尿外科;2.科教科,江苏徐州221005;3.河北医科大学第三医院泌尿外科,河北石家庄 050051;4.天津医科大学第二医院泌尿外科,天津300211)
摘要:目的研究CDH13表达下调对膀胱癌5637细胞上皮间质转化的影响。方法应用RNA干扰技术抑制膀胱癌5637细胞中CDH13的表达后,倒置相差显微镜下观察细胞形态的变化,Western blot检测CDH13及上皮间质转化标志物E-钙黏蛋白、 N-钙黏蛋白和α-平滑肌动蛋白的表达。结果膀胱癌5637细胞中CDH13表达下调后细胞形态向间质细胞转变,呈现长梭形, 细胞间紧密连接松散,大多数细胞出现细长的丝状伪足;上皮细胞标志物E-钙黏蛋白表达减少(P<0.05),间质细胞标志物N-钙黏蛋白和α-平滑肌动蛋白表达增加(P<0.05),与对照组相比差异有统计学意义。结论膀胱癌细胞中CDH13表达下调促进肿瘤细胞向间质细胞转化。
关键词:膀胱癌;CDH13;上皮间质转化
膀胱癌是泌尿系统常见的恶性肿瘤之一,并且随着暴露于危险因素的增加和人口的老龄化,其发病率呈上升趋势[1-4]。膀胱癌生物学特征具有多样性,即使分期、分级完全相同的肿瘤其结果也不完全相同,容易复发和进展是膀胱癌的重要特征[1-4]。钙黏蛋白-13 (cadherin-13,CDH13)是钙黏蛋白家族的一员。有研究表明CDH13是一个抑癌基因,它在细胞粘附、信号传导及细胞生长调节等方面发挥着重要作用[5]。我们先前的研究表明CDH13在膀胱癌中表达减少,并与肿瘤的浸润、转移及不良预后密切相关;在体外实验中应用RNA干扰技术抑制膀胱癌细胞中CDH13的表达后细胞增殖加快,迁移和侵袭能力增强[6-9]。近年来研究表明,上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤的浸润、转移过程中发挥着重要作用[10-11]。本研究将在体外实验中应用RNA干扰技术抑制CDH13在膀胱癌5637细胞中的表达,观察CDH13表达下调后对膀胱癌细胞EMT的影响。
1材料与方法
1.1材料人膀胱癌5637细胞株购自中国科学院细胞库, RPMI1640培养基购于美国Gibeo公司,胎牛血清购于杭州四季青生物工程公司,兔抗人CDH13多克隆抗体、兔抗人E-cadherin (E-钙黏蛋白)多克隆抗体、兔抗人N-cadherin (N-钙黏蛋白) 多克隆抗体、兔抗人α-smooth muscle actin (α-平滑肌动蛋白,α-SMA) 多克隆抗体、CDH13 shRNA Plasmid、Control shRNA Plasmid、HRP标记的羊抗兔二抗购自美国Santa Cruz公司, Lipofectamine 2000购自美国Invitrogen公司。
1.2细胞培养及转染5637细胞常规培养于含10%灭火胎牛血清的RPMI1640培养基中,在37℃、5%CO2孵育箱中培养。本研究分为3组:A组为正常对照组(1×PBS),B组为阴性对照组(Control shRNA Plasmid),C组为实验组(CDH13 shRNA Plasmid)。取对数生长期的5637细胞用胰酶消化并计数,用RPMI1640培养基调整细胞浓度为2×105/mL,取500 μL接种于6孔板,置于37℃、5%CO2培养箱中培养,待细胞融合度达80%时进行转染,操作按照Lipofectamine 2000说明书进行,转染后细胞板置于37℃、5%CO2培养箱中培养。转染细胞传代培养,应用嘌呤霉素筛选稳定表达 shRNA 的细胞,Western blot检测CDH13基因的蛋白沉默效果[8- 9]。
1.3Western blot检测蛋白表达收集各组细胞,提取细胞总蛋白,经SDS-PAGE电泳分离后,将蛋白转移到硝酸纤维素膜上;5%脱脂奶粉封闭2 h,加入一抗4℃过夜,TBS洗膜后加入辣根过氧化物酶标记的二抗,用ECL发光剂检测;各组以β-Actin内参,将每个样本的灰度值与内参灰度值比较,得出的比值代表蛋白的含量。
1.4相差显微镜下观察细胞形态变化各组分别取对数生长期细胞,消化细胞后制成1×105/mL浓度的细胞悬液,接种至六孔板培养,倒置相差显微镜观察细胞形态变化并拍照。
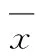
2结果
2.1RNA干扰抑制膀胱癌5637细胞CDH13蛋白的表达shRNA转染后实验组CDH13蛋白表达水平明显低于正常对照组和阴性对照组,差异有统计学意义(P<0.05, 图1)。
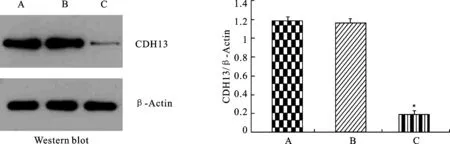
图1 Western blot法检测3组CDH13的表达及其柱状图
A:正常对照组;B:阴性对照组;C:实验组。*与内参灰度值比,P<0.05。
2.2相差显微镜观察CDH13表达下调后细胞形态改变正常对照组和阴性对照组细胞呈现明显的上皮样形态,细胞间连接紧密,未见明显间隙,几乎看不到伪足。实验组细胞呈现间充质样的长梭形, 细胞间紧密连接松散,大多数细胞出现细长的丝状伪足(图2)。

图2 膀胱癌5637细胞形态改变(HE, ×200)
2.3EMT相关标志物表达的改变实验组上皮细胞标志物E-钙黏蛋白表达明显减少,间质细胞标志物N-钙黏蛋白和α-平滑肌动蛋白表达明显增加,与正常对照和阴性对照组相比差异有统计学意义(P<0.05,图3)。

图33组EMT相关标志物的表达比较及其柱状图
A:正常对照组;B:阴性对照组;C:实验组。*与内参灰度值比,P<0.05。
3讨论
CDH13基因定位在人染色体16q24,在多种肿瘤中人染色体16q24经常发生突变、缺失以及启动子甲基化等,进而影响基因所编码蛋白的表达。研究表明CDH13在多种肿瘤中表达减少或缺失,并且与肿瘤的发生发展有着非常密切的关系。CDH13是钙黏蛋白家族的一个特殊成员,它不仅是一个粘附分子,同时也是多种生物因子的受体,可调节细胞的多种生物学功能;在多种肿瘤中,CDH13表达减少与肿瘤的恶性生物学行为有关[5]。大量研究表明,CDH13表达减少与其参与多种肿瘤的发生发展过程有关,在多种肿瘤中重新恢复CDH13表达能够抑制肿瘤细胞的增殖、浸润和转移,同时CDH13也可能参与肿瘤新生血管的形成以及细胞内和细胞间的信号传导过程,进而影响细胞的生物学行为[12]。
近年来,人们从结构和功能方面对CDH13做了大量的研究,研究发现CDH13参与调节机体内许多生物加工过程,包括钙介导的细胞粘附、细胞极性和形态形成、细胞的聚集和迁移、细胞的识别和信号传导机制以及肿瘤的发生、发展等[5, 12]。我们的研究也发现,在膀胱癌中CDH13因其基因启动子甲基化而表达减少,并与肿瘤的恶性生物学行为密切相关;在体外实验中应用去甲基化试剂重新恢复CDH13表达后可抑制细胞迁移和侵袭能力[6-9]。侵袭是肿瘤细胞的特性,研究发现CDH13表达减少将增加肿瘤细胞的侵袭能力,然而CDH13表达减少是通过何种机制促进肿瘤发展的,目前尚不完全清楚。研究表明,EMT在肿瘤的发生发展中起着重要作用,与多种上皮细胞来源肿瘤的侵袭及转移密切相关。本研究在体外实验中应用RNA干扰技术抑制CDH13表达后,探索CDH13表达下调后对膀胱癌细胞EMT的影响。
EMT是指上皮细胞从形态和功能上转变为间充质细胞,细胞由立方形转变为长梭形,细胞上皮标志物表达减少,而间充质标志物表达增加,细胞获得更强的迁移、侵袭和增殖能力[13-14]。EMT 以上皮细胞极性的丧失及其间质特性的获得为主要特征,在胚胎发育、伤口愈合、组织重建及肿瘤转移等过程中发挥着重要作用。E-钙黏蛋白几乎存在于所有上皮细胞的表面,是上皮组织分泌的典型钙黏蛋白,是细胞-细胞粘附分子的主要类型,在EMT研究中作为主要的上皮性标志物[15]。N-钙黏蛋白是由间质细胞分泌的典型钙黏蛋白,其在上皮组织中的异位表达可以影响上皮细胞的形态和行为,诱导其向间质细胞转化,是目前在EMT研究中主要的间质性标志物[16]。α-平滑肌动蛋白主要表达于平滑肌细胞和肌性上皮细胞中,在多种肿瘤中与EMT密切相关,也是一种主要的间质细胞标志物[17]。在本研究中,我们应用RNA干扰抑制CDH13在膀胱癌5637细胞中表达后,细胞由上皮样形态转变为间充质细胞的长梭形,细胞间连接松散,大多数细胞出现细长的丝状伪足;同时,细胞中E-钙黏蛋白表达减少,N-钙黏蛋白和α-平滑肌动蛋白表达增加。研究结果表明CDH13表达下调后膀胱癌细胞向间质细胞转化。
综述所述,膀胱癌细胞中CDH13表达下调后,膀胱癌5637细胞向间质细胞形态转变,上皮细胞性标志物表达减少,间质细胞性标志物表达增加,这表明CDH13表达下调促进了膀胱癌细胞向间质细胞转化。
参考文献:
[1] PIGNOT G, LE GOUX C, BIECHE I. Recent advances in bladder urothelial carcinogenesis [J]. Bull Cancer, 2015, 102(12): 1020-1035.
[2] HARSHMAN LC, PRESTON MA, BELLMUNT J, et al. Diagnosis of bladder carcinoma: a clinician's perspective [J]. Surg Pathol Clin, 2015, 8(4):677-685.
[3] SCARPATO KR, MORGANS AK, MOSES KA. Optimal management of muscle-invasive bladder cancer -a review [J]. Res Rep Urol, 2015, 7(1): 143-151.
[4] MIYATA Y, SAKAI H. Predictive markers for the recurrence of nonmuscle invasive bladder cancer treated with intravesical therapy [J]. Dis Markers, 2015, 2015(1): 857416.
[5] ZHONG YH, PENG H, CHENG HZ, et al. Quantitative assessment of the diagnostic role of CDH13 promoter methylation in lung cancer[J]. Asian Pac J Cancer Prev, 2015, 16(3): 1139-1143.
[6] 林英立, 管同郁, 向代香, 等. 膀胱癌组织中CDH13的表达及临床意义 [J]. 国际泌尿系统杂志, 2013, 33(5): 594-596.
[7] LIN YL, SUNG G, LIU X, et al. Clinical significance of T-cadherin tissue expression in patients with bladder transitional cell carcinoma [J]. Urol Int, 2011, 86(3): 340-345.
[8] 林英立, 管同郁, 戚景光, 等. siRNA抑制CDH13表达对膀胱癌5637细胞增殖和侵袭的影响[J]. 国际泌尿系统杂志, 2014, 34(2):147-150.
[9] LIN YL, HE ZK, LI ZG, et al. Downregulation of CDH13 expression promotes invasiveness of bladder transitional cell carcinoma [J]. Urol Int, 2013, 90(2):225-232.
[10] YE X, WEINBERG RA. Epithelial-mesenchymal plasticity: A central regulator of cancer progression[J]. Trends Cell Biol, 2015, 25(11):675-686.
[11] ZARAVINOS A. The regulatory role of microRNAs in eMT and cancer [J]. J Oncol, 2015, 2015(1):865816.
[12] LIN YL, XIE PG, MA JG. Aberrant methylation of CDH13 is a potential biomarker for predicting the recurrence and progression of non muscle invasive bladder cancer[J]. Med Sci Monit, 2014, 20(1):1572-1577.
[13] YE X, TAM WL, SHIBUE T, et al. Distinct EMT programs control normal mammary stem cells and tumour-initiating cells [J]. Nature, 2015, 525(7568):256-260.
[14] SHAO DD, XUE W, KRALL EB, et al. KRAS and YAP1 converge to regulate EMT and tumor survival [J]. Cell, 2014, 158(1):171-184.
[15] CHAW SY, AJEED AA, DALLEY AJ, et al. Epithelial to mesenchymal transition (EMT) biomarkers-E-cadherin, beta-catenin, APC and Vimentin-in oral squamous cell carcinogenesis and transformation [J]. Oral Oncol, 2012, 48(10):997-1006.
[16] CHEN L, MUNOZ ANTONIA T, CRESS WD. Trim28 contributes to EMT via regulation of E-cadherin and N-cadherin in lung cancer cell lines[J]. PLoS One, 2014, 9(7):e101040.
[17] SCANLON CS, VAN TUBERGEN EA, INGLEHART RC, et al. Biomarkers of epithelial-mesenchymal transition in squamous cell carcinoma [J]. J Dent Res, 2013, 92(2):114-121.
(编辑何宏灵)
收稿日期:2015-12-25修回日期:2016-01-22
基金项目:徐州市医学青年后备人才项目(No:2014007);徐州市科技计划项目(No:KC14SH015);江苏大学临床科技发展基金项目(No:JLY20140109);江苏省“六大人才高峰”资助项目(2014-WSW-066);江苏省卫计委青年科研课题项目No:(Q201514)。
作者简介:林英立(1980-),男(汉族),主治医师,医学博士.主要从事泌尿系肿瘤的临床及基础研究.E-mail: lylxz2012@126.com
中图分类号:R737.14
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.05.016
The effect of CDH13 down-regulation on the epithelial mesenchymal transition of bladder cancer cells
LIN Ying-li1, LI Yan-li2, QI Jing-guang1, MA Jian-guo3, LI Wen-ping3, SUN Guang4
(1.Department of Urology,Xuzhou Cancer Hospital, Xuzhou 221005; 2.Department of Science and Education, Xuzhou Cancer Hospital, Xuzhou 221005; 3.Department of Urology, the Third Hospital of Hebei Medical University, Shijiazhuang 050051;4.Department of Urology, the Second Hospital of Tianjin Medical University, Tianjin 300211, China)
ABSTRACT:ObjectiveTo investigate the effect of CDH13 down-regulation on the epithelial mesenchymal transition of bladder cancer cells. MethodsAfter CDH13 expression in 5637 cells was inhibited with RNA interference, the changes of cell morphology were observed using inverted phase contrast microscope. The expression of CDH13, E-cadherin, N-cadherin and α-smooth muscle actin were examined using Western blot. ResultsAfter the down-regulation of CDH13 expression in bladder cancer 5637 cells, the cells transited to fusiform mesenchymal-like cells, the tight intercellular connection became loose, and most cells showed slender filopodia. The expression of epithelial cell marker E-cadherin decreased (P<0.05), while the expression of N-cadherin and α-smooth muscle actin increased (P<0.05), and the differences were statistically significant compared with the control. ConclusionDown-regulation of CDH13 expression promotes the process of epithelial mesenchymal transition of bladder cancer cells.
KEY WORDS:bladder cancer; CDH13; epithelial mesenchymal transition

