虉草ISSR-PCR反应体系优化与引物筛选
张永亮,刘 鹏,骆秀梅,刘 杨
(内蒙古民族大学,内蒙古 通辽 028042)
虉草ISSR-PCR反应体系优化与引物筛选
张永亮,刘鹏,骆秀梅,刘杨
(内蒙古民族大学,内蒙古 通辽028042)
22个虉草基因组DNA为ISSR-PCR 扩增模板,采用单因素试验方法,对影响PCR 扩增体系中dNTP、引物浓度、Taq酶和模板DNA 用量4个因素及引物退火温度进行梯度试验,优化得到最佳的ISSR-PCR 反应体系,即20μL 反应体系中分别加入0.3 μLTaqDNA聚合酶(5 U/μL),2 μL 10×PCR Buffer(mg2+plus),1.5 μL dNTP (2.5 mmol/L),1.5 μL引物(10 pmol/μL),50 ng模板DNA,ddH2O 补足体积。以此体系对24条引物进行筛选,最终获得了多态性高,重复性好的引物12条。引物UBC808、809、811、815、818、820、826的适宜退火温度为55℃,引物835,841和842 的适宜退火温度为56℃,而引物810和834 的适且退火温度分别为52℃和54℃。12条引物共扩增总条带数192条,其中,多态性条带数173条,多态位点百分率89.81%。
虉草;ISSR-PCR反应体系;引物筛选
虉草(Phalarisarundinacea),属于禾本科(Gramineae)、虉草属植物,别名草芦、园草芦。主要分布于欧洲、北美和亚洲,在我国主要分布于东北、华北、华中、华东等地区。虉草耐盐碱、耐湿涝,又耐旱,生长快,营养繁殖能力强,产草量高、叶量丰富,蛋白质含量高,被广泛用于饲草、人工湿地植物、生物能源材料或造纸原料等[1-2]。国内有关虉草的耐盐性和生产性能已有较多报道[3-7],而有关虉草分子标记研究甚少[8]。因此,试验旨在通过研究ISSR-PCR反应中各项参数变化对试验结果的影响,并对反应体系进行优化,建立适用于虉草的ISSR反应体系,并进行ISSR引物筛选,为进一步研究虉草种群遗传多样性奠定基础。
ISSR是一种建立在PCR反应基础上的DNA分子标记技术, 由加拿大蒙特利尔大学的Zietkiewicz 等[9]于1994年创建。ISSR技术可重复性强,多态性更好,而且不需知道被检测物种任何基因组的信息,因此,ISSR标记被广泛应用于植物遗传多样性研究[10-12]。ISSR-PCR反应结果主要受到TaqDNA 聚合酶、引物、模板、Mg2+、dNTP等5种因素的影响[13-17]。试验以22个虉草基因组DNA 为模板,采用单因素试验设计方法,通过研究ISSR-PCR 反应中各项参数变化对试验结果的影响,优化ISSR-PCR 反应体系,筛选出适合虉草ISSR 研究的引物,旨在建立适合虉草的ISSR 反应体系,为虉草遗传多样性、种质资源筛选和分子标记辅助育种等方面的研究奠定基础。
1 材料和方法
1.1供试材料
供试22份虉草材料及其来源见表1。在实验室内用花盆培养,待幼苗生长至4~5片叶时摘取植株顶部以下第2片嫩叶用于基因组DNA的提取。
1.2虉草基因组DNA的提取及检测
试验采用新型快速植物基因组DNA 提取试剂盒(北京天根生化科技有限公司,离心柱型),提取虉草基因组DNA,方法按照说明书进行。
用1.0%琼脂糖凝胶电泳检测DNA质量,取5 μL模板DNA,混合1 μL 6×Loading Buffer,设标准分子量为DL2000 Marker,缓冲电压设为100 V稳定电压(5 v/cm2),1×TAE缓冲液电泳90 min分离,EB(溴化乙锭)染色。电泳结果采用凝胶成像系统检测并记录。根据电泳检测结果,将符合要求的DNA 溶液分装于1.5 mL的离心管中,在-20℃保存备用。

表1 22分不同产地的虉草
注:供试材料1~16号来源于国家草种质资源中期库
1.3虉草ISSR-PCR反应体系的建立及优化
根据有关禾本科牧草ISSR分子标记相关文献[18-22],从100条ISSR引物中挑选出24条引物(表2)。引物序列由上海生物工程技术服务有限公司合成,dNTP和TaqDNA聚合酶购于TaKaRa公司。
针对模板DNA浓度、dNTP浓度、引物浓度、TaqDNA聚合酶浓度(10×PCR Buffer,含2 μL mg2+)等影响因素,利用单因素水平梯度试验对ISSR-PCR反应体系中的各个因素的适宜浓度进行单因素梯度试验逐一优化。在确定最佳反应条件时,参照文献[13-17]中的ISSR扩增程序和反应体系进行,对反应体系各因素设置不同梯度水平(表3),2 μL 10×PCR Buffer(mg2+plus),以DL2000作为对照。当试验中对某一因素进行梯度设置时,其余因素均保持不变。在最佳反应体系确定的基础上,再进一步筛选每一个引物的最佳退火温度。
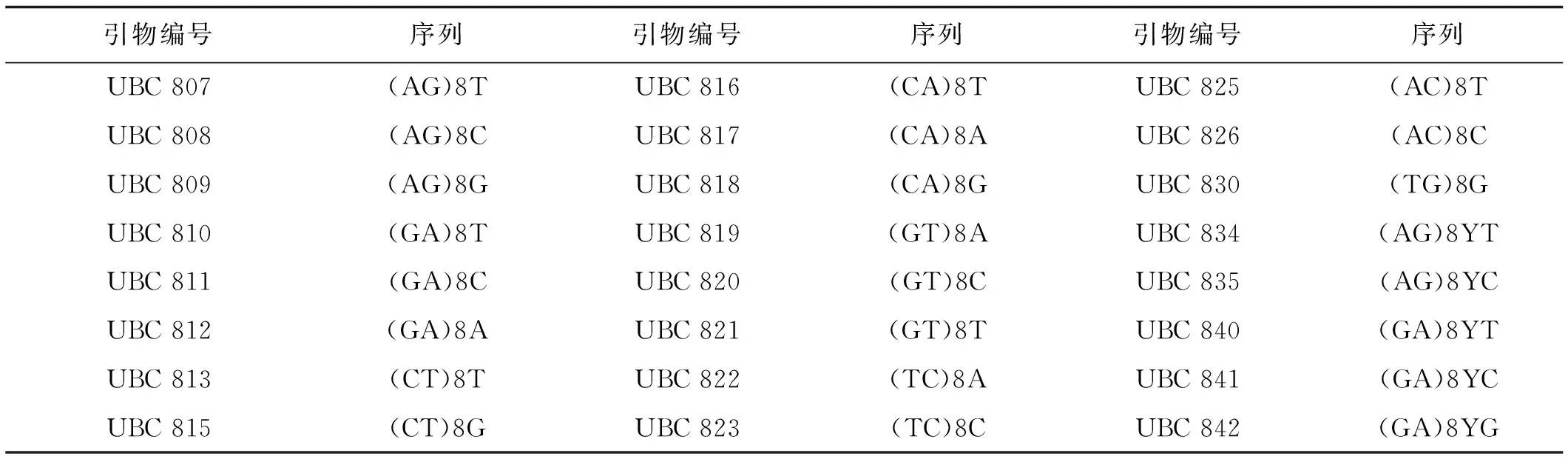
表2 ISSR标记的引物
注:* Y =(C,T)
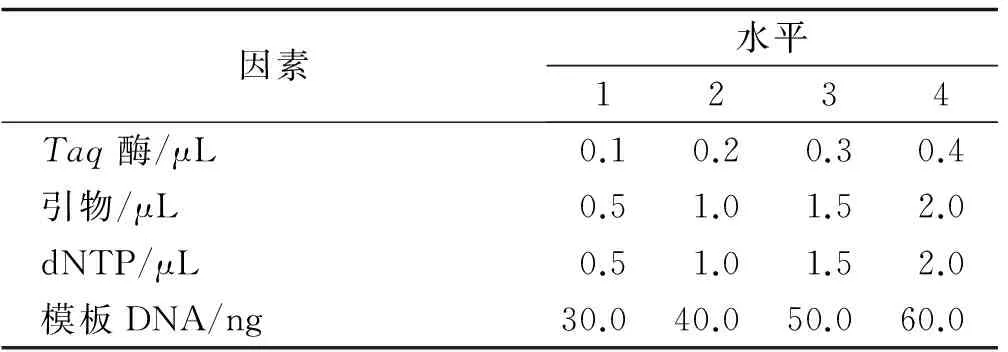
表3 ISSR-PCR反应的因素和水平
1.4引物的筛选
根据确定的ISSR-PCR反应体系及反应程序,选取2个虉草DNA模板对24条ISSR引物进行初步筛选。选取扩增稳定、条带多、信号强、背景清晰的引物用于后续的ISSR-PCR反应。
1.5PCR扩增及扩增产物的检测和分析
PCR扩增反应完成后,用预先制好的浓度为2.0%的琼脂糖凝胶进行电泳检测。缓冲电压设为90U,1×TAE缓冲液电泳分离,待溴酚蓝迁移至凝胶的2/3处,停止电泳,取出凝胶置于紫外凝胶自动成像仪拍照并保存。根据ISSR-PCR分子标记的原理及方法对扩增产物进行比较分析,确定最佳虉草ISSR-PCR反应体系及扩增程序。
2 结果与分析
2.1DNA检测
通过琼脂糖电泳检测DNA质量,图1中DNA电泳带没有拖尾现象且图像较为清楚,可知所提DNA纯度较高,RNA和蛋白质含量较少,符合ISSR-PCR分析要求。
2.2PCR 反应体系对虉草ISSR-PCR扩增的影响
2.2.1dNTP浓度对虉草ISSR-PCR扩增的影响dNTP是ISSR-PCR反应的原料底物,对扩增条带有很大的影响。浓度过高会出现非特异性扩增,浓度太低则扩增产物不完全,导致产率下降。试验表明,dNTP添加量为0.5 μL和1.0 μL时扩增条带较弱; 添加量为1.5 μL时扩增出的条带最清晰,并且多态性好(图2)。但当添加量为2.0 μL时,扩增条带的亮度较1.5 μL时的扩增条带暗,综合考虑,选择1.5 μL作为 ISSR-PCR 反应体系中 dNTP 的最佳添加量。
2.2.2模板DNA浓度对虉草ISSR-PCR扩增的影响试验结果表明DNA 浓度在30和40 ng时,扩增条带弱,50和60 ng时条带比较完整,其中50 ng时条带最为清晰(图3)。综合考虑,选择50 ng作为 ISSR-PCR 反应体系中模板DNA的最佳浓度。

图1 22份虉草基因组DNA电泳图Fig.1 The electrophoresis on Genomic DNA of 22 Phalaris arundinacea materials注:从左到右依次为DL2000Marker、品种代号1~22号
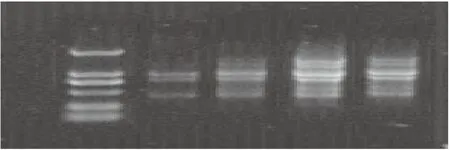
图2 不同dNTP浓度下ISSR-PCR扩增Fig.2 Effect of dNTPs concentration on ISSR-PCR amplification注:从左到右依次为DL2000 Marker、0.5、1.0、1.5、2.0 μL
2.2.3引物浓度对虉草ISSR-PCR扩增的影响在不同引物浓度下所扩增出的条带,当添加量为0.5 μL 时,扩增产物不完全,且条带清晰度不高。当添加量为1.0和1.5 μL时,反应稳定,条带清晰,从扩增效果图中可以看出添加量为1.5 μ条带更容易辨别(图4)。当添加量为2.0 μL时,产生非特异性扩增。综合分析,选择1.5 μL作为 ISSR-PCR 反应体系中引物的最佳添加量。
2.2.4Taq酶浓度对虉草ISSR-PCR扩增的影响当Taq酶用量为0.1 μL和0.2 μL时合成效率低;用量为0.3 μL和 0.4 μL时,扩增条带多态性好并且条带清晰易分辨(图5)。结合整个试验成本等因素综合考虑,选用0.3 μL 的Taq酶用量作为ISSR-PCR 反应体系中引物的最佳浓度。
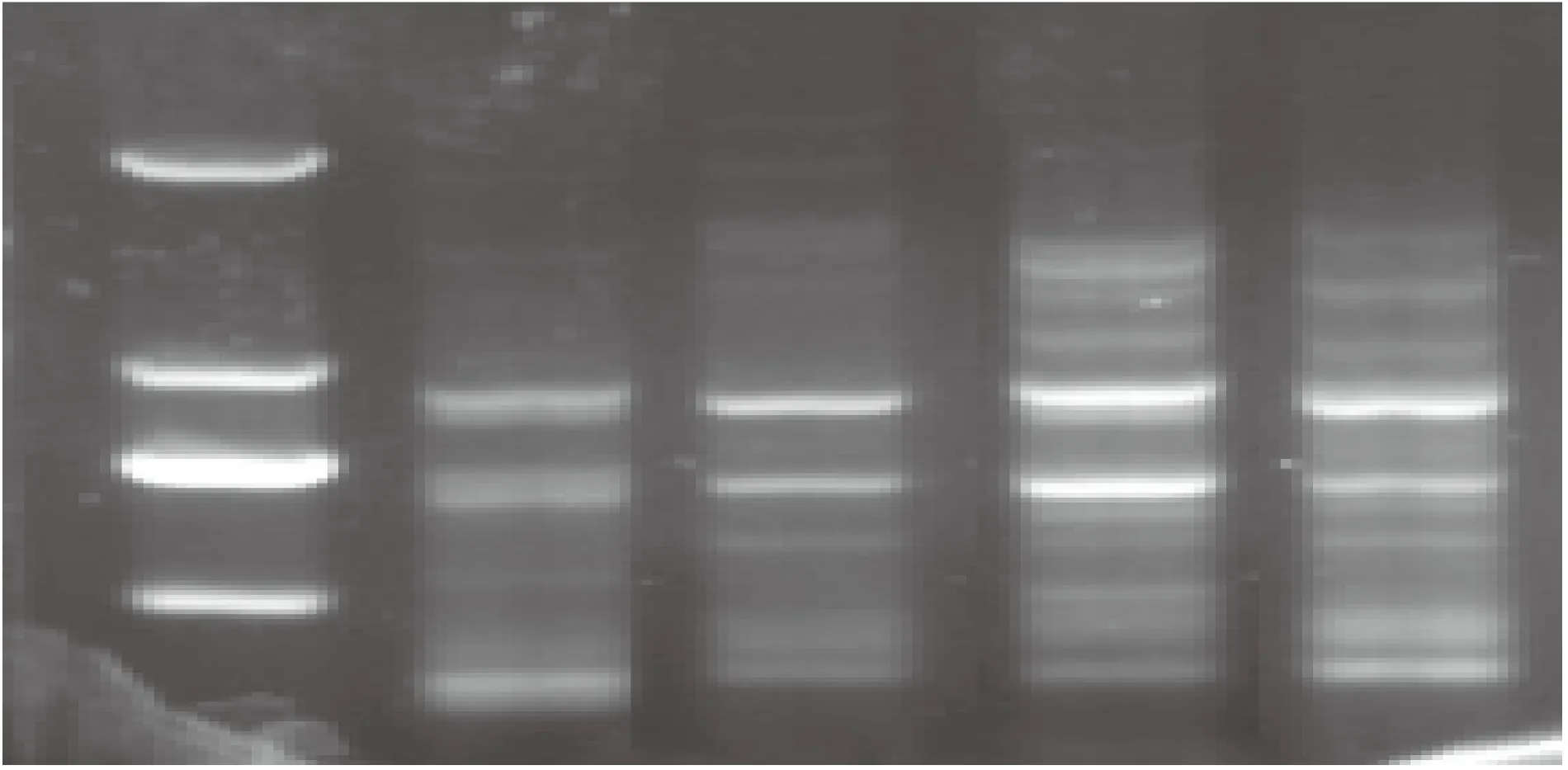
图3 不同DNA浓度下ISSR-PCR扩增Fig.3 Effect of template DNA concentration on ISSR-PCR amplification注:从左至右依次为DL2000 Marker、30、40、50、60 ng

图4 不同引物浓度下ISSR-PCR扩增Fig.4 Effect of primer concentration on ISSR-PCR amplification注:从左至右依次为DL2000 Marker、0.5、1.0、1.5、2.0 μL
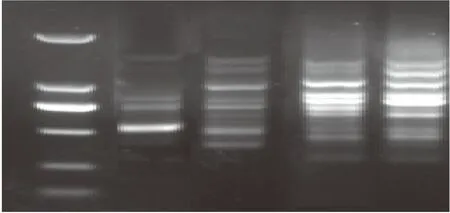
图5 不同Taq酶下的ISSR-PCR扩增Fig.5 Effect of Taq DNA polymerase concentration on ISSR-PCR amplification注:从左至右依次为DL2000 Marker、0.1、0.2、0.3、0.4 μL
2.3虉草ISSR-PCR最佳反应体系的确定
通过诸多因素的优化试验分析,筛选出了虉草的ISSR-PCR最佳反应体系和最适扩增程序。反应体系为20 μL,其中,TaqDNA聚合酶0.3 μL、10×PCR Buffer 2 μL、dNTP 1.5 μL、模板DNA50 ng、引物1.5 μL、ddH2O 13.7 μL。
2.4最适退火温度和ISSR-PCR扩增程序的确定
根据上海生物工程技术服务有限公司推荐的引物退火温度范围,对22份不同产地虉草ISSR-PCR 退火温度、时间与循环次数进行单因素试验表明,引物UBC808、809、811、815、818、820、826适宜退火温度为
55℃,引物835,841和842适宜退火温度为56℃,而引物810和834退火温度分别为52℃和54℃时才能得到稳定、清晰的特异性谱带。ISSR-PCR扩增的程序第1阶段,94℃预变性5 min;第2阶段,94℃变性45 s、退火60 s(退火温度参照所用引物的最适温度)、72℃延伸120 s,共进行35个循环;第三阶段,72℃延伸10 min。
2.5最佳反应体系的验证
运用单因素试验所获得的最佳反应体系和最适退火温度,通过多次验证得出的最适扩增程序,随机选用引物UBC810、818、826和842对22份不同产地的虉草材料进行 ISSR-PCR 扩增(图6~9 )。结果表明,4个供试引物的扩增条带都比较清晰,多态性较丰富,稳定性和重复性好。表明运用单因素试验所获得的最佳反应体系和最适退火温度可以作为虉草基因组DNA的ISSR-PCR反应的最佳优化体系。
2.6引物筛选
根据PCR产物电泳图,以扩增条带数及多态性条带数为筛选条件,从24条 ISSR引物中共筛选出12条较适宜虉草分子标记的引物(表 4)。这12条引物平均扩增总条带数16条,平均多态性条带数14.4条,平均多态百分率89.81%。
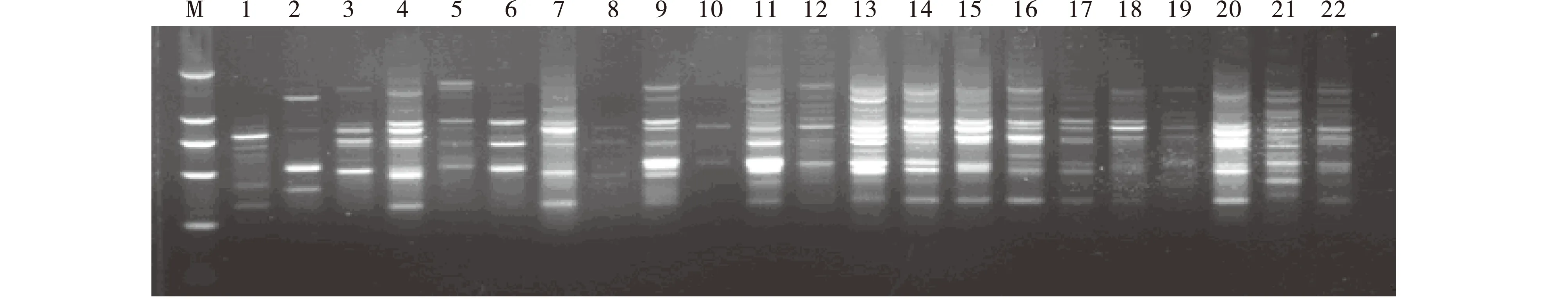
图6 引物UBC810对22个不同产地虉草材料的扩增Fig.6 UBC810 primer amplification for 22 Phalaris arundinacea materials
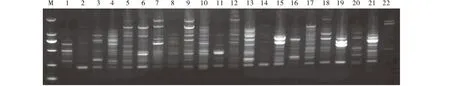
图7 引物UBC818对22个不同产地虉草材料的扩增Fig.7 UBC818 primer amplification for 22 Phalaris arundinacea materials
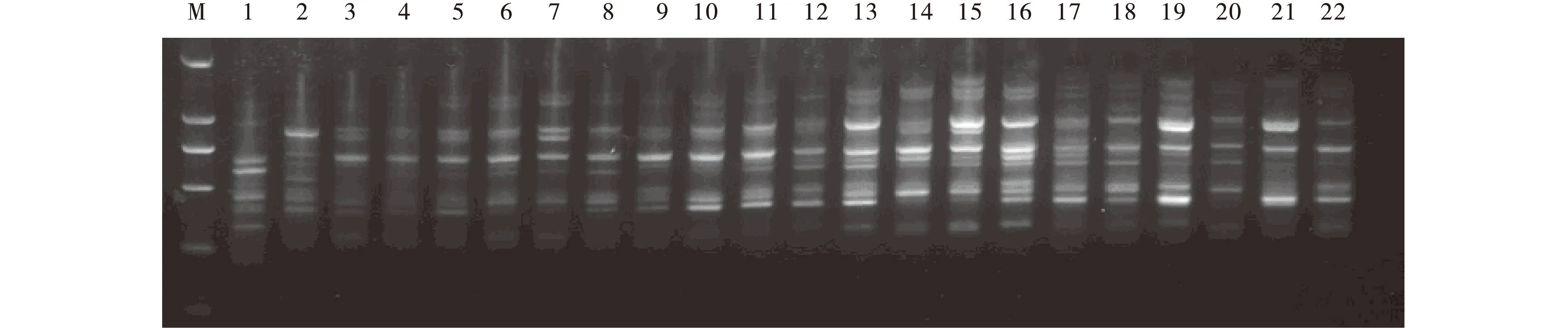
图8 引物UBC826对22个不同产地虉草材料的扩增结果Fig.8 UBC826 primer amplification for 22 Phalaris arundinacea materials
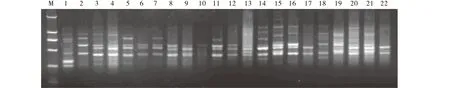
图9 引物UBC842对22个不同产地虉草材料的扩增结果Fig.9 UBC842 primer amplification for 22 Phalaris arundinacea materials
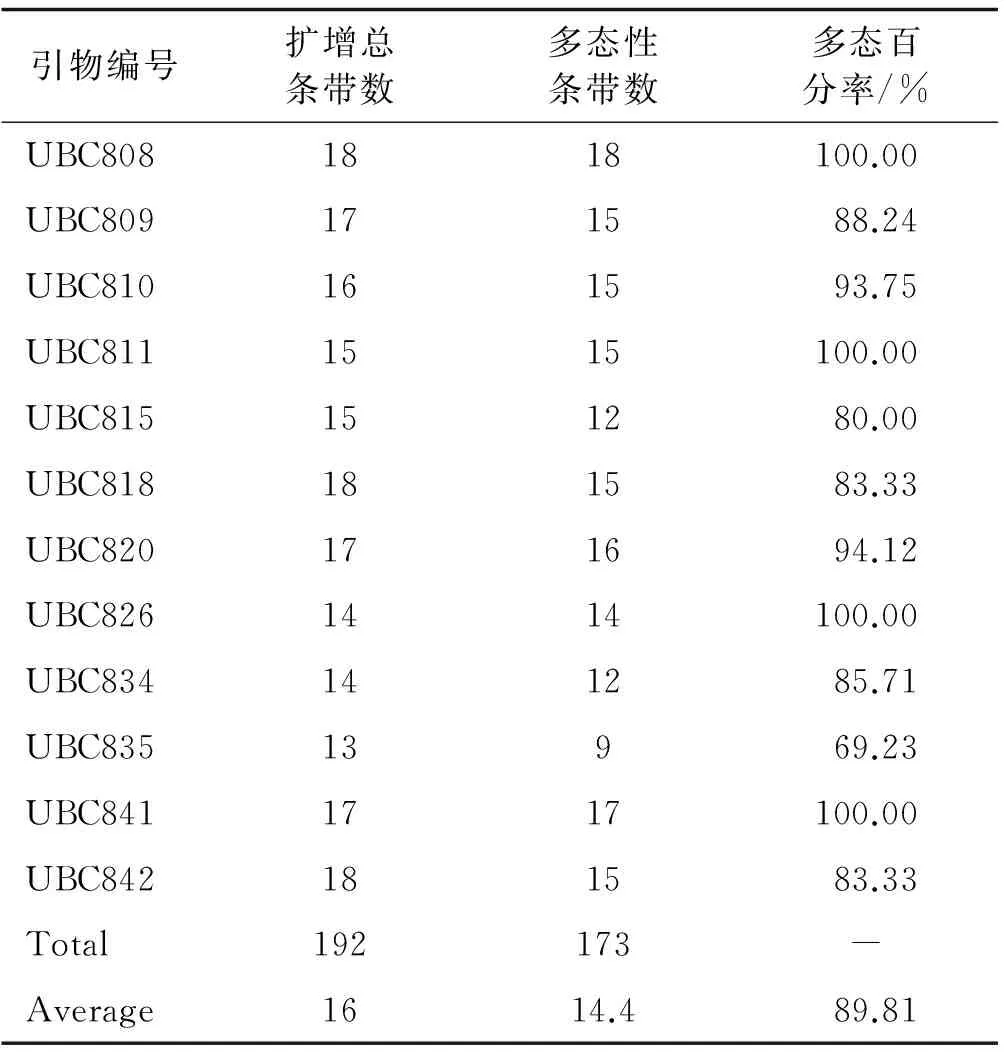
引物编号扩增总条带数多态性条带数多态百分率/%UBC8081818100.00UBC809171588.24UBC810161593.75UBC8111515100.00UBC815151280.00UBC818181583.33UBC820171694.12UBC8261414100.00UBC834141285.71UBC83513969.23UBC8411717100.00UBC842181583.33Total192173-Average1614.489.81
3 讨论与结论
ISSR-PCR 反应体系主要受Mg2 +、dNTP、模板DNA、引物和Taq酶5个因素浓度的影响[13-17]。dNTP 是 PCR 扩增的原料,对条带的扩增有很大影响。试验表明,dNTP浓度过低而过早消耗完会导致产物单链化,进而在电泳检测时出现杂带,产率下降,扩增产物不完全;其浓度过高会导致PCR产生错误掺入,出现非特异性扩增。试验表明,在20 μL的反应体系中,1.5 μL dNTP时扩增效果最好。
TaqDNA聚合酶的种类以及用量直接影响扩增反应成功与否。TaqDNA 聚合酶受酶活性、耐热性及反应体积等因素的限制,使用量大容易产生非特异性扩增产物的积累,杂带过多,还会造成经济上的浪费。酶含量过低,易造成产物条带模糊不清晰难以读带;扩增的带数随聚合酶浓度的增加可而增加。但酶量过高,反而引起PCR扩增效果的降低。结果表明,20 μL的反应体系中,TaqDNA 聚合酶为0.3 μL时扩增效果最好。
引物浓度影响ISSR-PCR扩增产物的质量和带型的产生。引物浓度过高会引起错配和非特异性产物扩增,增加引物二聚体的形成几率[13]。引物浓度过低则扩增出的条带不完全,不能进行有效扩增。结果表明,在20 μL的反应体系中,引物为1.5 μL时扩增效果最好。
适宜的模板量是确保获得特异性扩增的要素之一[14]。模板浓度过低,扩增条带将很弱甚至没有;浓度过高,会增加非专一扩增产物或造成弥散型产物,影响扩增重复性。试验优化模板DNA浓度为50 ng。
在ISSR扩增中,退火温度和循环次数对扩增结果好坏具有明显影响。退火温度过低,容易出现背景重,弥散的条带且扩增产物少;退火温度过高,则引物与模板结合差,容易造成非特异性扩增,产物的丰富度降低[16,23]。试验所选12条引物的退火温度在52~56℃,不同的引物有其适宜的退火温度,只有在适宜温度下才能达到良好的扩增效果。
对ISSR反应影响较大的4个因素进行了优化,建立了虉草基因组DNA的ISSR-PCR扩增最佳反应体系。在20 μL反应体系中,TaqDNA聚合酶0.3 μL,10×PCR Buffer(mg2+plus) 2 μL,dNTP 1.5 μL,引物1.5 μL,ddH2O 13.7 μL,模板DNA50 ng。虉草ISSR-PCR扩增的程序如下:第1阶段,94℃预变性5min;第2阶段,94℃变性45 s、退火60 s(退火温度采用所用引物的最适温度)、72℃延伸120 s,共进行35个循环;第3阶段,72℃延伸10 min。然后在4℃保存。12条引物共扩增总条带数192条,其中,多态性条带数173条,多态位点百分率89.81%。该反应体系的建立可为虉草遗传多样性分析奠定技术基础。
[1]M Hammad Nadeem Tahir,Michael D Casler,Kenneth J Moore,etal.Biomass yield and quality of reed canarygrass under five harvest management systems for bioenergy production[J].Bioenergy Research,2011,4:111-119.
[2]张永亮,骆秀梅.虉草的研究进展[J].草地学报,2008,16(6):659-666.
[3]丛丽丽.虉草耐盐性鉴定及P5CS基因克隆[D].成都:四川农业大学,2012.
[4]张永亮,聂微微,任秀珍,等.复盐胁迫下二种虉草K+、Na+吸收与运输的特点[J].中国草地学报,2010,32(3):28-33.
[5]张永亮,王学愿,刘杨,等.盐胁迫下氮磷钾肥对虉草离子吸收与分布的影响[J].草地学报,2014,22(6):1318-1323.
[6]张永亮,张浩.行距与氮肥对虉草分蘖和产量的影响[J].中国草地学报,2013,32(2):43-47.
[7]张永亮,骆秀梅,张浩,等.行距与氮肥对通草1 号虉草生长特性的影响[J].中国草地学报,2014, 36(1):44-48.
[8]贾蕴琪.虉草遗传连锁图谱构建与种质资源评价[D].北京:中国农业大学,2014.
[9]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics, 1994, 20:176-183.
[10]张雪,刘青松,师文贵,等.25份无芒雀麦种质资源遗传多样性的ISSR分析[J].中国草地学报,2014,36(3):104-107.
[11]余国辉,王赞,王俊娥,等.东方山羊豆种质资源遗传多样性ISSR分析[J].中国草地学报,2014, 36(3):22-27.
[12]郭郁频,任永霞,张颖超,等.早熟禾种质资源ISSR遗传多样性分析[J].中国草地学报,2014,36(3):28-34.
[13]王方,袁庆华.冰草ISSR-PCR反应体系的建立与优化[J].草地学报,2009,17(3):354-357.
[14]卢玉飞,蒋建雄,易自力.中国芒属植物ISSR-PCR扩增反应体系的优化[J].草地学报,2013,21(1):167-173.
[15]胡凤荣,王斐,王志强,等.风信子 ISSR-PCR 体系的优化及引物筛选[J].分子植物育种,2013,11(1):139-144.
[16]富新年,师尚礼,王赞,等.百脉根ISSR-PCR反应体系的建立与优化[J].草原与草坪,2012,32(3):49-57.
[17]杨水莲,刘卫东,马 涛,等.假俭草ISSR-PCR反应体系的建立与优化[J].草原与草坪,2009,(1):11-14.
[18]范彦,曾兵,张新全,等.中国野生鸭茅遗传多样性的ISSR研究[J] .草业学报,2006,15(5):103-108
[19]Emine A,Ahmet T.The application of ISSR-PCR to determine the genetic relationship and genetic diversity between narrow leaved bluegrass (Poaangustifolia) and rough bluegrass (Poatrivialis) accessions[J].Turk J Biol,2011,35:415-423.
[20]刘新亮.两种披碱草属牧草种质资源遗传多样性研究[D].北京:中国农业科学院,2011
[21]张晓燕.偃麦草染色体核型与遗传多样性分析[D].甘肃:甘肃农业大学,2011
[22]刘美.ISSR标记的早熟禾遗传多样性分析[D].兰州:甘肃农业大学,2009
[23]孟丽娟,赵桂琴.红三叶ISSR-PCR反应体系的建立与优化[J].草原与草坪,2015,35(2):21-26
Optimization of ISSR-PCR reaction system and primer selection forPhalarisarundinacea
ZHANG Yong-liang, LIU Peng,LUO Xiu-mei,LIU Yang
(InnerMongoliaUniversityforNationalities,Tongliao028042,China)
Genomic DNA extracted from 22Phalarisarundinaceamaterials was used as template for ISSR-PCR to study the impact of dNTPs concentration,template DNA,primer andTaqpolymerase in PCR system by using a single factor experiment method in order to establish the optimized ISSR-PCR reaction system.The results showed that the best reaction system was 2μL 10×PCR Buffer(mg2+plus),1.5μL dNTPs (2.5 mmol/L),1.5μL primer (10 pmol/μL),0.3 μLTaqpolymerase (5 U/μL),50 ng template,and ddH2O to 20μL at last.Base on this PCR system,24 primers were selected,in which,12 primers showed high polymorphism and repeatability.The suitable annealing temperature of primer 808,809,811,815,818,820,826 was 55℃,and it was 56℃ for primer 835,841 and 842,52℃ and 54℃ for primer 810 and 834 respectively.A total of 192 bands were amplified from 12 ISSR primers,in which,173 were polymorphic loci,the average percentage of polymorphic band was 90.62%.The reaction system would provide the basis for the diversity analysis ofPhalarisarundinaceawith ISSR markers.
Phalarisarundinacea;ISSR-PCR reaction system;primer selection
2015-12-16;
2016-01-03
内蒙古自然科学基金(2015MS0337);内蒙古民族大学市校合作项目(SXYB2012077)资助
张永亮(1959-),男,内蒙古包头人,教授,博士,主要从事牧草栽培与种质资源评价研究。
E-mail:zyl8802@163.com
S 543;Q 786
A
1009-5500(2016)03-0001-07

