茭白品种间基因组ISSR多态性分析
李 帅,崔海峰,张雅芬,张子杰,俞晓平,叶子弘
(中国计量大学 生命科学学院,浙江省生物计量与检验检疫技术重点实验室,浙江 杭州 310018)
茭白品种间基因组ISSR多态性分析
李帅,崔海峰,张雅芬,张子杰,俞晓平,叶子弘
(中国计量大学 生命科学学院,浙江省生物计量与检验检疫技术重点实验室,浙江 杭州 310018)
【摘要】对浙江、湖北、江苏等省3个野生茭白材料17个不同品种的茭白种质资源进行了收集,利用ISSR方法对茭白植株进行了基因组多态性分析.结果表明,野生茭白与栽培茭白品种间具有明显的多态性,不同来源的栽培茭白品种间也具有一定的多态性,多态性比例分布在12%~25%之间.利用DPS软件对茭白植株的多态性位点进行的系统聚类分析发现,野生茭白与栽培茭白间距离较远,茭白地域分布及栽培特性与种质资源多样性相关.
【关键词】茭白;种质资源;基因组多态性;ISSR分析
茭白,古称菰,为禾本科菰属(ZizaniaLinnaeus)多年生水生宿根草本植物,无性繁殖,喜沼泽多湿环境,原产于中国和东南亚,目前主要分布于我国南方作物区域,已有千年的栽培历史.茭白已成为我国特产的出口农产品,是国内除莲藕外的第二大水生蔬菜,其经济效益十分显著[1].茭白营养丰富,深受消费者喜爱.除了作为蔬菜外,现代医学认为茭白还具有一定的保健和药用功能[2].我国茭白种植主要集中在长江中下游省份,其中尤以长江中下游的江、浙、沪和太湖流域栽培最多.浙江省是全国茭白种植面积最大的省份,同时茭白也是浙江省种植面积最大的水生蔬菜,经济效益高,是浙江省效益农业的一个亮点[3].
我国茭白种质资源丰富.基于茭白年收获次数可将栽培茭白分为单季茭白和双季茭白两大类.单季茭是严格的短日性作物,只有在秋季日照转短后植株才会孕茭[4],因此单季茭在春季定植后,每年只在秋季采收一季茭白.而双季茭对日照长短的反应不灵敏,植株成长达到一定叶龄后,在长、短日照条件下都能孕茭,一般在定植当年秋季采收一季茭白,到第二年初夏又可采收一季茭白.目前,双季茭白是我国茭白的主栽类型,双季茭的品种很多,种植面积较广的有龙茭2号、浙茭系列、苏州小蜡台、无锡中介茭等[5].
目前,关于茭白种质资源的研究,主要集中在田间新品种育种、系统分类位置、营养价值、品种分类和繁殖等方面[6].茭白种质资源的多态性分析主要集中在生物学特性方面,遗传多样性研究报道较少,如利用ADHIA基因序列变异研究了国内茭白品种的遗传多样性以及茭白的种群结构,但在茭白多样性的遗传和地理距离之间并没有发现相关性[7].俞晓平等采用RAPD技术构建浙江省12个茭白品种的指纹图谱,发现9个浙江本地品种间的遗传距离较近,并推测地域差异对遗传距离的影响较大[8,9].在作物的驯化过程中,由于遗传瓶颈和人工选择,许多作物的遗传多样性较其野生祖先都有不同程度的减少,如栽培水稻只有其野生祖先遗传多样性的20%~30%[10].本试验收集了3个省20个茭白种质资源,利用ISSR方法分析品种栽培特性及地域分布对茭白种质资源基因组多态性的影响,以期为茭白种质资源的保护及开发利用提供理论依据.
1材料和方法
1.1实验材料
从江苏、浙江和湖北等省采集了20个茭白种质资源,具体信息见表1.
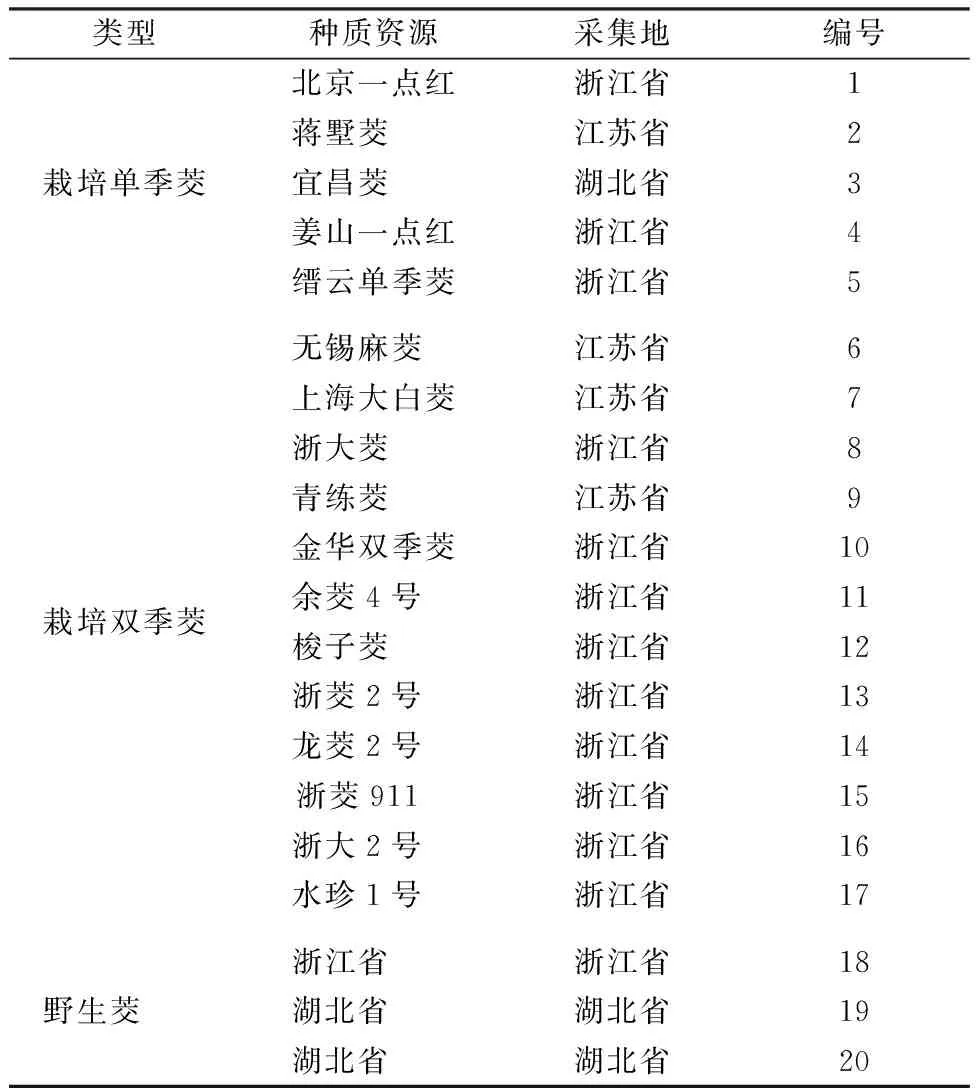
表1 茭白的采集
1.2实验方法
1.2.1ISSR引物筛选
通过文献资料及试验获得适用于植物多态性分析的ISSR引物序列,以茭白叶片DNA为模板,筛选多态性条带较多的ISSR引物,共筛选获得12个可用于茭白植株基因组DNA多态性分析的ISSR引物,序列见表2.

表2 茭白ISSR引物
1.2.2茭白基因组PCR扩增
使用CTAB法分别提取20个茭白种质资源的植株叶片基因组DNA,紫外分光光度法检测DNA的质量,检测合格的茭白基因组DNA—20℃保存备用.以提取的茭白DNA为模板,进行ISSR引物的PCR扩增.PCR反应程序如下:95 ℃预变性5 min;94℃变性1 min,56 ℃/58 ℃复性1 min,72℃延伸90 s,32个循环;72 ℃延伸10 min,最后保温10 ℃.PCR产物用1.0%~1.5%琼脂糖凝胶进行电泳分析,恒压90 V,40~50 min后拍照观察.
1.2.3聚类分析
根据扩增的DNA带型,设定某一位置上有扩增带的为1,无扩增带的为0,统计20个茭白种质资源在所有ISSR引物扩增中的DNA带型数据,使用DPS分析软件计算出欧氏距离,并根据欧氏距离进行聚类分析.
2结果
2.1生物学特征分析
采自3个不同省份的20个茭白种质资源具有2种不同的生长表型,其中17个为正常茭白品种(图1A),均能形成正常膨大的肉质茎(图1B,C),包括5个单季茭白,12个双季茭白;3个为野生茭白,茎部无法膨大,可以开花抽穗(图1D),但结实率较低.采集的茭白种质资源基本特性没有发生变化.
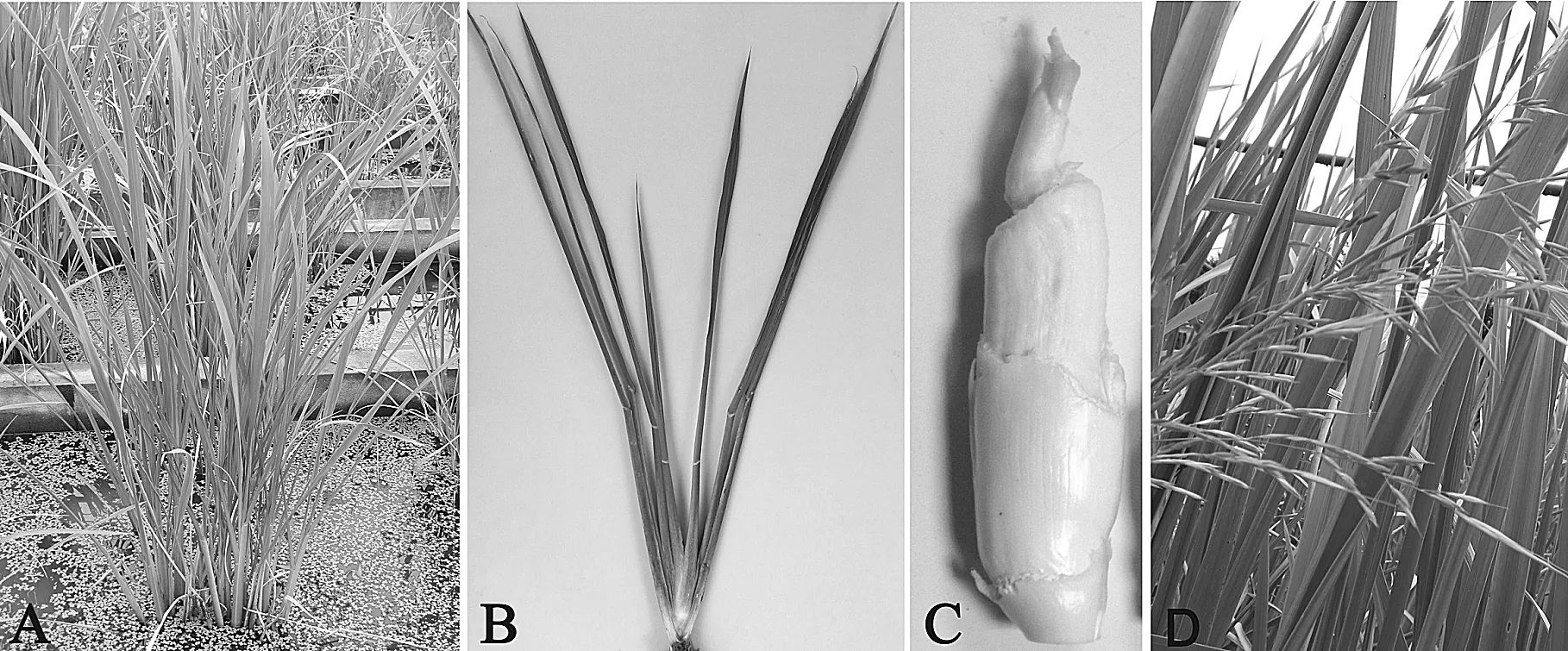
注:A-茭白墩,B-正常茭白单株,C-正常茭白膨大茎部,D-野茭花序图1 茭白植株及茎部膨大表型Figure 1 Plantlets and galls of cultivated Z. latifolia
2.2叶片基因组ISSR分析
已有研究报道表明茭白叶片中没有菰黑粉菌存在[11],因此为了避免内生真菌——菰黑粉菌对ISSR分析的干扰,以茭白植株叶片为材料,采用CTAB法提取获得20个茭白材料叶片的基因组DNA.
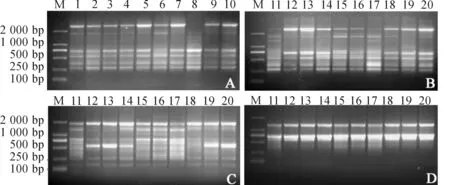
注:A和B-(AG)8YT;C-(AC)8YG;D-(AC)8YA;其中,1-20分别按照(表1)中茭白品种顺序;M-DL2000.图2 茭白ISSR分析Figure 2 ISSR analysis of varieties of Z. latifolia
采用筛选的12对ISSR引物,对17个栽培茭白品种和3个野生茭白种质进行了PCR扩增(图2),共获得79条扩增条带,其中36条在不同茭白种质间存在多态性,ISSR引物扩增的多态性比例为45.6%.对不同种质间ISSR扩增条带的多态性比较分析发现,不同茭白种质间多态性条带数量存在差异(13~20条),多态性比例为12.7%~25.3%.缙云单季茭的多态性条带最多(20条),金华双季茭多态性条带最少(11条);野生茭白中浙大野茭的多态性条带较多(18条),监利与钟祥野茭的多态性条带数量较少(14条).不同茭白种质间多态性条带分布也存在差异(表3).

表3 茭白植株ISSR条带统计分析
注:茭白品种编号同表1.
2.3聚类分析
基于茭白叶片基因组DNA的ISSR扩增条带统计分析,采用DPS分析软件进行聚类分析,构建系统进化树(图3).结果发现,不同茭白种质资源间的遗传距离不同.野茭与栽培茭白能够明显区分开来,其中钟祥野茭单独聚为一类,浙大野茭与监利野茭聚为一类,并与其它栽培茭白共同聚为1大类.部分来自浙江的茭白种质资源(双季茭白龙茭2号,浙茭911,浙大2号、水珍1号)聚为一类;浙江省分布较为普遍的双季茭白梭子茭在遗传距离1.43处与浙茭2号、浙大茭及金华双季茭遗传距离较近;5个单季茭白在遗传距离为1.26处与4个双季茭白聚为一大类,其中来源于浙南的2个单季茭白(江山一点红与缙云单季茭)单独聚为一类.
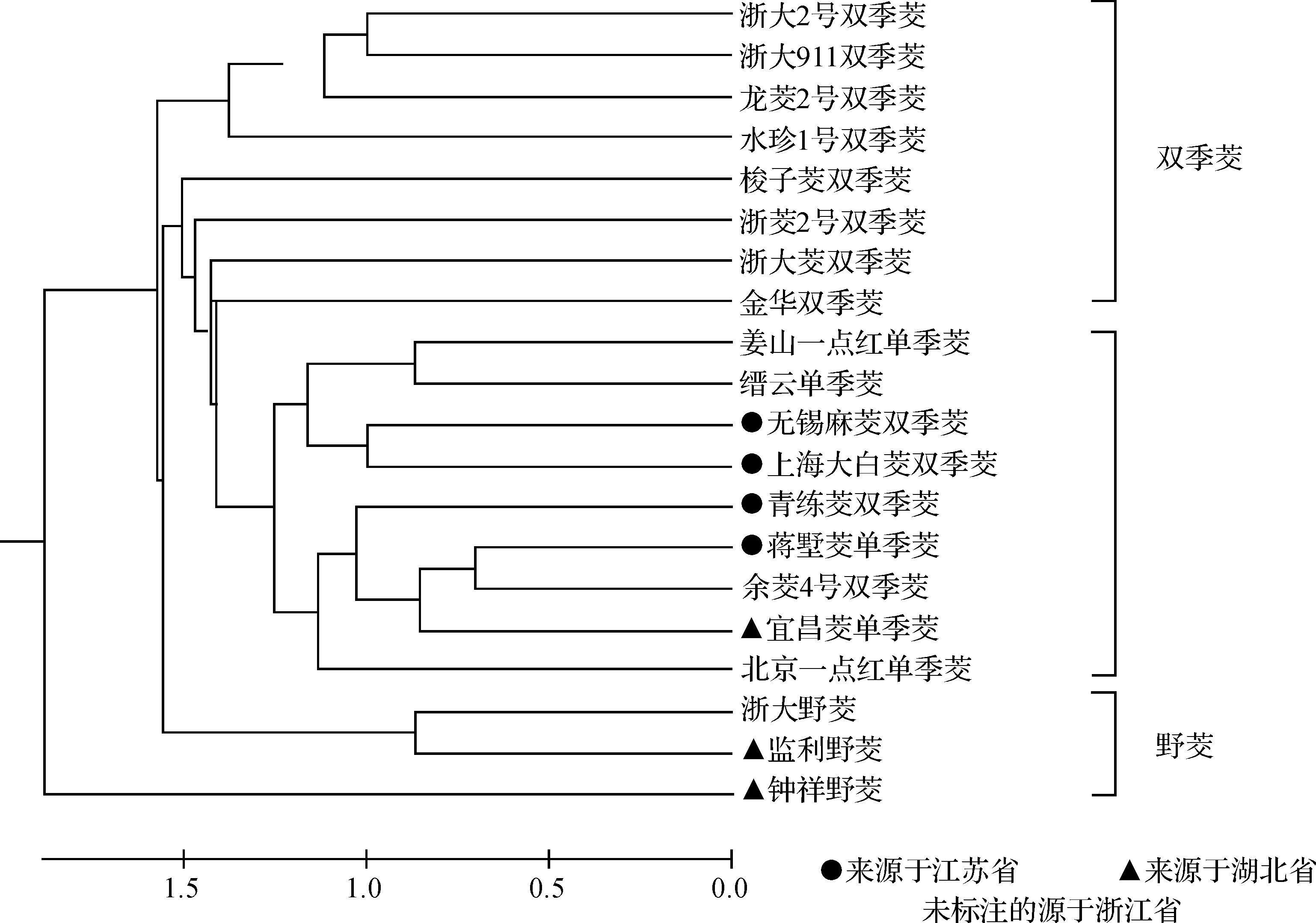
图3 不同茭白品种的系统进化树Figure 3 Phylogenetic tree of Z. latifolia
3讨论
茭白是浙江省的重要水生蔬菜,在全国的种植面积仅次于莲藕.与大多数农作物一样,茭白也是一种驯化栽培作物,大约在公元五世纪时,人们已发现有些菰的植株因感染上黑粉菌而不抽穗,且植株毫无病象,茎部不断膨大,形成了可食用的纺锤形肉质茎,此后经过人工驯化选育,菰逐渐由产粮植物异化为一种蔬菜植物——茭白[12].人们所食用的茭白实质上是茭白植株被其内生真菌——菰黑粉菌侵染后膨大而成的肥嫩肉质茎,属病态器官.因此,茭白孕茭是由茭白植株与寄生在其体内的菰黑粉菌共同作用的结果[13].茭白田间栽培方式为无性繁殖,茭白墩系的分株及芽变可能是品种间遗传多样性的主要影响因素.但由于田间选育及种质资源传播等因素影响,不同茭白品种间的亲缘关系不够明晰,影响了茭白种质资源的鉴定利用[14].本文采用ISSR的方法对茭白种质资源进行了基因组多态性分析,发现地域分布及栽培习性对茭白品种间遗传多样性具有明显影响,为茭白种质资源的鉴定评价及资源保护利用提供了理论依据.
植物基因组多态性分析是种质资源保护和利用的一个重要部分,栽培茭白作为一种无性繁殖的水生蔬菜,其基因组多态性的比较分析对茭白种质资源的鉴定具有重要的作用.茭白田间栽培生产时,菰黑粉菌与茭白植株共生.茭白越冬期间,地上部分枯死,但留在地下短缩茎上的分蘖芽和地下匍匐茎上的分株芽可以休眠过冬,此时,菰黑粉菌可以在茭白的地下茎中以孢子的形态存在,次年温度回升后开始萌发,茭白形成植株.当侵染后的茭白仍然被菰黑粉菌产生的孢子充满时,则茭白不能开花,从而导致茭白变成一包无法食用的“黑灰”[15].不同品种的茭白是通过从田间选取优质的个体进行无性繁殖生产的.前期基于ADHIA基因的序列变异开展了茭白种质资源多态性分析,发现65个栽培茭白品种中仅表现出一个相同的单一的基因型.在本实验中,采用ISSR技术分析了20种不同品种的茭白基因组多态性并建立了茭白的系统进化树,与单基因的序列变异相比,ISSR分子标记在不同品种的茭白中表现出了可靠性、重复性好并具有高度多态性的指纹,它能扩增茭白中的多个多态性位点.20种茭白种质资源的基因组多态性的比较分析表明:栽培茭白与野生茭白的遗传距离较远,野生茭白能够与栽培茭白明显区分开.本实验选取的野生茭白植株茎部不能膨大,受菰黑粉菌胁迫较少,虽然可以开花但结实率极低,无法进行有性繁殖;此外,由于野茭不具有田间栽培价值,其分株栽培次数远少于栽培茭白,进而导致遗传多样性变化与栽培茭白存在明显差异.
茭白孕茭与菰黑粉菌侵染密切相关,经过长期的选育种和地区间相互引种,茭白植株内的菰黑粉菌可能也发生了遗传变异,相关变异可能与茭白品种驯化密切相关,后续研究将开展菰黑粉菌的分离鉴定及遗传多样性分析,综合比较茭白品种间菰黑粉菌的多态性及其与茭白遗传多样性的关系,为今后的茭白品种选育工作提供理论依据.
【参考文献】
[1]YAN Ning, WANG Xiaoqing , XU Xiaofeng , et al. Plant growth and photosynthetic performance ofZizanialatifoliaare altered by endophyticUstilagoesculentainfection[J]. Physiological and Molecular Plant Pathology,2013,83:75-83.
[2]黄凯丰,江解增,秦玉莲,等.茭白肉质茎膳食纤维含量及理化特性的研究[J].扬州大学学报(农业与生命科学版),2007,28(2):88-90.
HUANG Kaifeng, JIANG Jiezeng, QIN Yulian, et al. Studies on dietary contents ofZizaniagall and some physical and chemical characteristics[J]. Journal of Yangzhou University (Agricultural and Life Science Edition),2007,28(2):88-90.
[3]卢宝荣.利用生物多样性合理布局探索茭白的可持续生产模式[J].浙江农业学报,2003,15(3):118-123.
LU Baorong. Exploring sustainable production model of Jiaobai(ZizaniacaducifloraL.)through strategic biodiversity deloyments[J]. Acta Agriculturae Zhejiangensis,2003,15(3):118-123.
[4]俞晓平,李建荣,施建苗,等.水生蔬菜茭白及其无害化生产技术[J].浙江农业学报,2003,15(3):109-117.
YU Xiaoping, LI Jianrong, SHI Jianmiao, et al. The aquatic vegetable, Jiaobai(Zizaniacaduciflora.L.)and its safe production in Zhejiang province[J]. Acta Agriculturae Zhejiangensis,2003,15(3):109-117.
[5]刘义满,柯卫东,黄新芳,等.茭白遗传多样性与育种技术[J].长江蔬菜,2009,16(8):1-4.
LIU Yiman, HE Weidong, HUANG Xinfang, et al. Genetic diversity and breeding techniques of wter bamboo (ZizanialatifoliaTurcz)[J]. Jouranl of Chang Jiang Vegetales,2009,16(8):1-4.
[6]丁潮洪,华金渭,胡婷婷,等.利用SRAP技术分析茭白种质资源遗传多样性[J].浙江农业学报,2010,22(5):576-579.
DING Chaohong, HUA Jinwei, HU Tingting, et al. Genetic diversity of water bamboo (ZizanialatifoliaTurcz) germplasms in Zhejiang employing SRAP markers[J]. Acta Agriculturae Zhejiangensis,2010,22(5):576-579.
[7]郑殿升.中国作物遗传资源的多样性[J].中国农业科技导报,2000,2(2):45-49.
ZHANG Diansheng. Diversity of crop genetic resources in China[J]. Review of China Agricultural Science and Technology,2000,2(2):45-49.
[8]俞晓平,张珏锋,吕仲贤,等.浙江省12个主栽茭白品种亲缘关系的RAPD分析[J].科技通报,2005,21(2):137-141.
YU Xiaoping , ZHANG Juefeng, LU Zhongxian, et al. DNA polymorphism of 12 selected water oat varieties (Zizaniacaduciflora) collected from Zhejiang[J]. Bulletin of Science and Technology,2003,15(3):109-117.
[9]赵煦泓,尤文雨,崔海峰,等.茭白黑粉菌核相变化及ISSR分子标记筛选的研究[J].中国计量学院学报,2011(2):176-180.
ZHAO Xunhong, YOU Wenyu, CUI Haifeng, et al. Studies on changes in nuclear conditions and molecule marker selection of polymorphism inUstilagoesculenta[J]. Journal of China University of Metrology,2011(2):176-180.
[10]GIRMA G, TESFAYE K, BEKELE E. Inter simple sequence repeat (ISSR) analysis of wild and cultivated rice species from Ethiopia[J]. African Journal of Biotechnology,2013,9(32):5048-5059.
[11]ZHANG Jingze, CHU Fuqiang, GUO Deping, et al. Cytology and ultrastructure of interactions betweenUstilagoesculentaandZizanialatifolia[J]. Mycological Progress,2012,11(2):499-508.
[12]TERRELL E E, BATRA L R.ZizanialatifoliaandUstilagoesculenta, a grass-fungus association[J]. Economic Botany,1982,36(3):274-285.
[13]GUO Longbiao, QIU Jie, HAN Zujing, et al. A host plant genome (Zizanialatifolia) after a century-long endophyte infection[J]. The Plant Journal,2015,83(4):600-609.
[14]YOU Wenyu, LIU Qian, ZOU Keqin, et al. Morphological and molecular differences in two strains ofUstilagoesculenta[J]. Current Microbiology,2011,62(1):44-54.
[15]SUZUKI T, CHOI J H, KAWAGUCHI T, et al. Makomotindoline from makomotake,Zizanialatifoliainfected withUstilagoesculenta[J]. Bioorganic & Medicinal Chemistry Letters,2012,22(13):4246-4248.
【文章编号】1004-1540(2016)02-0161-06
DOI:10.3969/j.issn.1004-1540.2016.02.007
【收稿日期】2016-04-15《中国计量学院学报》网址:zgjl.cbpt.cnki.net
【基金项目】国家科技支撑计划项目(No.2012BAD27B01),国家自然科学基金支撑项目(No.31201499).
【作者简介】李帅(1989-),男,河南省安阳人,硕士研究生,主要研究方向为植物与微生物互作. E-mail:498733136@qq.com 通信联系人:叶子弘,女,教授.E-mail: zhye@cjlu.edu.cn
【中图分类号】Q946
【文献标志码】A
Genome ISSR analysis of different varieties ofZizanialatifolia
LI Shuai, CUI Haifeng, ZHANG Yafen, ZHANG Zijie, YU Xiaoping, YE Zihong
(Zhejiang Provincial Key Laboratory of Biometrology and Inspection and Quarantine Technique,College of Life Sciences, China Jiliang University, Hangzhou 310018, China)
Abstract:Twenty different varieties of Z. latifolia germplasm resources were collected; and genomic polymorphism analysis based on the ISSR method was carried out. The result showed that there was a significant polymorphism between the wild and the cultivated varieties, while different sources of the cultivated also exhibited genomic polymorphisms with a distribution of 12%-25%. A preliminary cluster analysis for the polymorphism locus of Z. latifolia using DNS shows that there is obvious distance in Z. latifolia between the wild and the cultivated varieties. The distribution and cultivation characteristics of Z. latifolia are related to the genetic diversity.
Key words:Zizania latifolia; germplasm resource; genomic polymorphism; ISSR analysis

