巨龙竹肉桂醇脱氢酶基因(DsCAD)的克隆及功能分析
孙金金,朱金鑫,王 娟,杨宇明,王 毅
(1.西南林业大学,云南 昆明 650224;2.云南省林业科学院 国家林业局云南珍稀濒特森林植物繁育和保护重点实验室,云南 昆明 650201;3.云南省林业科学院 云南省森林培育与开发利用重点实验室,云南 昆明 650201)
巨龙竹肉桂醇脱氢酶基因(DsCAD)的克隆及功能分析
孙金金1,2,朱金鑫1,2,王 娟2,3,杨宇明2,3,王 毅2,3
(1.西南林业大学,云南 昆明 650224;2.云南省林业科学院 国家林业局云南珍稀濒特森林植物繁育和保护重点实验室,云南 昆明 650201;3.云南省林业科学院 云南省森林培育与开发利用重点实验室,云南 昆明 650201)
肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)是木质素生物合成途径的关键酶。研究根据巨龙竹转录组数据设计的一对特异引物,运用逆转录PCR(RT-PCR)技术从巨龙竹茎秆中克隆得到肉桂醇脱氢酶基因DsCAD,该基因包含1080 bp的完整cDNA开放阅读框,编码359个氨基酸,理论相对分子质量38689.6,等电点6.18。利用生物信息学方法对DsCAD进行分析,结果显示:DsCAD氨基酸序列包含CAD超家族的保守结构域,具有植物CAD基因的典型特征;其与禾本科植物CAD基因的同源性较高,亲缘关系较近,其中与孝顺竹的同源性高达95%。荧光定量PCR检测结果显示DsCAD基因在巨龙竹竹笋中的表达量要高于茎秆,而在茎秆中的表达量有明显高于叶。
肉桂醇脱氢酶;巨龙竹;基因克隆;荧光定量
木质素是由苯丙烷单体组成的复杂的酚类聚合物,主要存在于植物的次生细胞壁中,是生物圈中最丰富的生物聚合物之一,在植物体中的含量仅次于纤维素。作为填充和黏合物质,木质素在细胞壁中与纤维素和半纤维素等多糖分子相互紧密粘合,可以增强植物体的机械强度和疏水性,同时也是植物对抗病原体和各种外界侵害的物理屏障[1-2]。但是,由于结构复杂难以降解,木质素的存在对木质纤维的开发利用造成不利影响,成为牧草消化、植物化学制浆和木质纤维转化为生物乙醇等过程中的限制性因素[3]。木质素主要通过苯丙烷途径和木质素特异途径合成,这一过程从苯丙氨酸或酪氨酸的脱氢基开始,再经过羟基化、甲基化和氧化还原反应生成木质素单体的3种前体物质——香豆醇(p-coumaryl alcohol)、芥子醇(sinapyl alcohol)及松柏醇(coniferyl alcohol),它们分别聚合为对-羟基苯基(p-hydroxyphenyl,H型)、紫丁香基(syringyl,S型)和愈创木基(guaiacyl,G型)3种木质素单体[4]。肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)是木质素生物合成途径最早被研究的酶之一,在木质素合成途径中具有非常重要的作用。CAD属于NADPH依赖性酶,作用于木质素单体生物合成的最后一步,催化肉桂醛(香豆醛、芥子醛和松柏醛)还原成相应的肉桂醇(香豆醇、芥子醇和松柏醇),这些肉桂醇是生成木质素单体的前体物质[5]。自1973年CAD基因被发现以来,国内外学者利用分子生物学等对其酶学性质、组成结构、克隆及转基因等方面进行了研究,并取得了一定的进展[6]。目前,已从多种植物中克隆了CAD基因,如烟草(Nicotianatabacum)[7]、茶(Camelliasinensis)[8]、钝鳞紫背苔(Plagiochasmaappendiculatum)[9]、杨树(Populustomentosa)[10]、高粱(Sorghumbicolor)[11]、马尾松(Pinusmassoniana)[12]、棉花(Gossypiumhirsutum)[13]等,但尚未见巨龙竹CAD基因克隆的相关报道。
巨龙竹(Dendrocalamussinicus)分布于云南省的南部与西南部,贾良智等于1982年在西双版纳首次发现并命名[14],为禾本科竹亚科牡竹属大型合轴型丛生竹类,是云南特有的珍稀竹种,其秆高达30 m,胸径可达30 cm以上,是迄今全世界发现的最高大的竹子。根据基部竹秆形态的不同,巨龙竹可分为“通直”与“歪脚”两种秆形[15]。作为秆形最大的工业用材竹种,巨龙竹具有体积大、生长快、竹壁厚、抗压力强、通直度好以及不受用材限制等优点,可以作为建筑、引水管道、制浆造纸等用材,有着巨大的经济开发价值和广阔的应用前景[16][17]。自巨龙竹被发现以来,许多学者对其生物学特性、繁育技术、竹材理化性质及用途和遗传多样性等方面进行了研究[18]。
本研究首次从巨龙竹中克隆出木质素合成途径起关键作用的肉桂醇脱氢酶基因DsCAD,并对其进行生物信息学分析,为研究巨龙竹的木质素生物合成奠定了基础,同时为利用基因工程技术调控木质素合成以生产优质巨龙竹用材提供靶向基因。
1 材料与方法
1.1 实验材料与试剂
巨龙竹分子样本采于云南省普洱市云兴园艺有限公司苗圃基地,分别剪取当年生巨龙竹的竹笋、竹秆、竹叶组织,立即放入液氮中速冻备用。克隆试剂盒pESY-T3及感受态细胞Trans1-T1购于全式金公司; LA-Taq酶、First cDNA Synthesis Kit购自大连宝生物工程有限公司;TRIzol试剂购自普洛麦格公司, Tiangen2×Taq酶购自天根生化科技公司。
1.2 实验方法
1.2.1 巨龙竹肉桂醇脱氢酶基因的克隆 使用DNAMAN软件分析NCBI数据中的肉桂醇脱氢酶(CAD)基因序列的保守区域,以保守序列为模板,通过Blast技术对巨龙竹转录组数据进行分析,筛选出可能存在的肉桂醇脱氢酶基因序列,根据筛选的CAD序列,设计特异引物DsCAD-F和DsCAD-R(见表1)。根据TRIzol试剂操作步骤提取巨龙竹茎秆组织的总RNA,用1%的琼脂糖凝胶检测其质量,根据First cDNA Synthesis Kit操作说明,合成cDNA第一链。以巨龙竹茎秆的cDNA第一链为模板,DsCAD-F和DsCAD-R为引物,扩增巨龙竹CAD基因片段。扩增条件(50μL)为10×LA Taq Buffer 5μL,dNTP Mixture 4μL,DsCAD-F 1μL,DsCAD -R 1 μL,cDNA 3 μL,TaKaRa LA Taq 1 μL,ddH2O 35 μL。扩增条件:94 ℃ 预变性5 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃ 延伸90 s,30个循环;72 ℃延伸7 min,4℃结束反应后用0.8%琼脂糖凝胶电泳检测。扩增的PCR产物经回收纯化后连接到pEASY-T3载体,转化到Trans1-T1感受态细胞中,然后涂布在含有AMP抗性的LB固体平板培养基上,过夜培养后挑选克隆,接种到0.5 mL液体培养基中, 37℃震荡培养12 h后,菌落PCR检测阳性克隆插入片段,将有预期插入片段的阳性克隆送上海生工检测,测序结果用Conting Express软件进行全长序列拼接以获得巨龙竹CAD基因的完整序列。
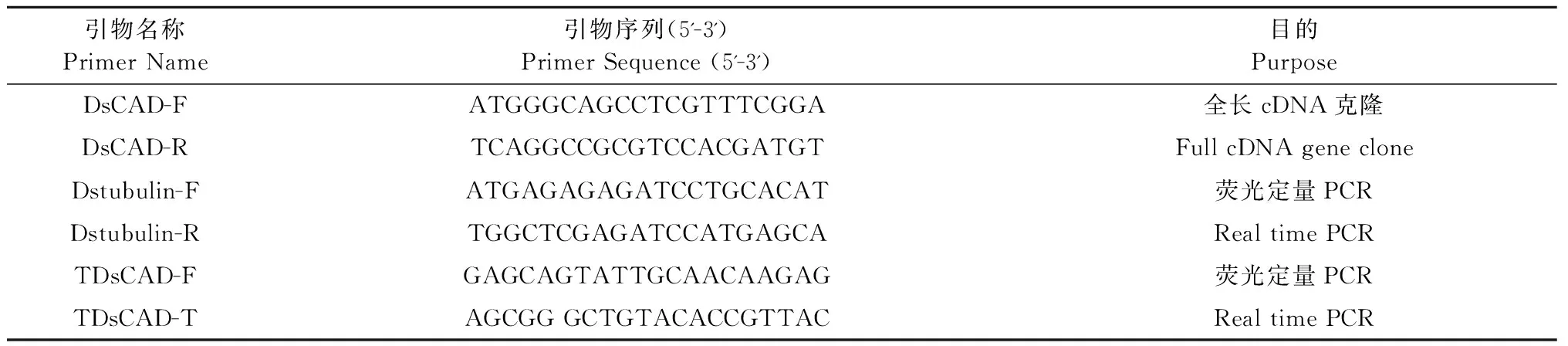
表1 文中PCR所用引物序列
1.2.2 巨龙竹CAD基因的生物信息学分析 利用NCBI数据库(http://web.expasy.org/protparam)的Blast工具、DNAMAN等软件对克隆得到的巨龙竹CAD与NCBI数据库中其他植物CAD编码蛋白的氨基酸序列进行同源性分析及多重序列比对,其蛋白质理化特性通过ExPASy的Protparam在线工具( )进行分析,并利用ProtScale在线软件(http://web.expasy.org/protscale/)对其亲疏水性做进一步分析,使用TMHMM在线软件(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP4.0在线工具(http://www.cbs.dtu.dk/services/SignalP/)分析其跨膜结构和肽信号,在线软件Psipred(http://bioinf.cs.ucl.ac.uk/psipred/)预测其二级结构,SWISS-MODEL在线工具(http://swissmodel.expasy.org/)对其进行同源三级结构建模,最后运用MEGA7软件的Neighbor-joining(邻位相连)算法以1000次boot straping检验绘制系统进化树。

图1 巨龙竹DsCAD基因克隆PCR扩增Fig.1 PCR amplified product of the DsCAD gene clone M: 1k DNA marker (Takara)
1.2.3 巨龙竹不同组织DsCAD的实时荧光定量(Real time PCR)表达分析 按照SGTriEx 高纯总RNA提取试剂盒方法分别提取竹笋、竹秆、竹叶组织的RNA。采用First cDNA Synthesis Kit试剂盒获得cDNA第一链。以各组织的cDNA为模板、TDsCAD-F和TDsCAD-R为引物(表1),采用Real time PCR的方法检测DsCAD在巨龙竹的笋、茎、叶3个不同组织的表达情况。Real time PCR反应试剂用2×SG Green qPCR Mix,以tubulin为内参基因,PCR扩增引物为Dstubulin-F和Dstubulin-R(见表1)。PCR反应体系15 μL,反应程序为:95℃ 10 min;95℃ 20 s;60℃ 30 s,72℃ 25 s,35个循环,72℃单点检测信号。反应结束后,60℃连续检测信号产生溶解曲线。用GraphPad Prism 5软件进行数据统计分析,每个样品3次重复,灭菌水对空白对照。
2 结果与分析
2.1 巨龙竹DsCAD基因克隆
使用特异引物DsCAD-F和DsCAD-R,以巨龙竹茎秆的cDNA为模板, 利用逆转录PCR(RT-PCR)方法扩增得到一条全长1 080 bp的基因片段(见图1),使用NCBI数据库ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)工具对其测序结果进行了序列分析发现,该片段包含起始密码子ATG和终止密码子GTA在内的完整cDNA开放阅读框(ORF),编码359个氨基酸,将其命名为DsCAD。

图2 巨龙竹CAD与其他植物CAD多重序列比对Fig.2 Multiple sequence alignment of the DsCAD and other plant CAD amino acid sequences
2.2 巨龙竹DsCAD基因的生物信息学分析
2.2.1 DsCAD氨基酸序列分析及多重序列比对 使用NCBI的Blast工具对克隆到的DsCAD编码的蛋白质氨基酸序列进行分析,并利用DNAMAN软件将DsCAD氨基酸序列与4种植物的CAD氨基酸序列进行多序列比对,4种植物分别为孝顺竹(Bambusamultiplex,登录号为ADG02378)、玉米(Zeamays,登录号为NP_001105654)、小麦(Triticumaestivum,登录号为ADI59734)、短花药野生稻(Oryzabrachyantha,登录号为XP_006647011),结果见图2。分析发现DsCAD蛋白N端包含两个Zn2+结合点位(BoxⅠ和BoxⅡ,图2)和1个NADP(H)辅酶结合点位(BoxⅢ,图2),这些结构域存在于CAD超家族中,是CAD蛋白共同的保守结构域,表明DsCAD属于CAD蛋白家族[19]。经氨基酸多序列比对发现,DsCAD氨基酸序列与孝顺竹、玉米、小麦、短花药野生稻CAD氨基酸序列的一致性分别达到95%、90%、88%、92%,进一步证实克隆得到DsCAD基因为CAD基因。
2.2.2 DsCAD编码蛋白质理化性质及结构预测 利用ExPASy在线工具Protparam分析DsCAD蛋白质理化特性,预测其理论相对分子质量为38 689.6,理论等电点为6.18,亲水性总平均值为0.055,预测该蛋白的应为疏水性蛋白。使用ExPASy在线工具ProtScale进一步分析DsCAD编码的蛋白的亲疏水性,预测结果显示其为疏水性蛋白,与Protparam工具预测结果一致。TMHMM在线分析DsCAD蛋白显示,发现其不具有跨膜结构,同时利用SignalP4.0在线工具分析发现其不包含信号肽序列,说明该蛋白应定位于细胞质基质中,不属于膜蛋白或分泌蛋白。使用在线软件Psipred预测DsCAD蛋白的二级结构,其中无规则卷曲约59.89%,β-折叠约为22.84%,α-螺旋约占17.27%。SWISS-MODEL在线工具以拟南芥肉桂醇脱氢酶AtCAD5蛋白的晶体结构为参考模板,对DsCAD蛋白进行同源三级结构建模(图3),二者的蛋白序列同源性达72.39%。在拟南芥的CAD基因家族中,只有AtCAD4和AtCAD5对木质素的合成起关键作用[20],据此推测DsCAD应具备与AtCAD5相似的催化功能。

图3 巨龙竹DsCAD蛋白质三维结构预测Fig.3 Three-dimensional structure prediction of DsCAD
2.2.3 DsCAD基因系统进化树分析 利用MEGA7软件将DsCAD与拟南芥9个CAD基因以及其他9种植物的CAD基因编码的氨基酸序列进行比对,用Neighbor-joining算法构建CAD基因系统进化树(图4),构建进化树所选用的CAD氨基酸序列的NCBI登录号分别为拟南芥Q9CAI3(AtCAD1)、Q9SJ25(AtCAD2)、Q9SJ10(AtCAD3)、P48523(AtCAD4)、O49482(AtCAD5)、O65621(AtCAD6)、Q02971(AtCAD7)、Q02972(AtCAD8)、P42734(AtCAD9),青蒿(Artemisiaannua)ACB54931,孝顺竹(Bambusamultiplex)ADG02378,油棕(Elaeisguineensis)XP_010943210,乌拉尔图小麦(Triticumurartu)EMS63282,芒草(Miscanthussinensis)ALE20537,川桑(Morusnotabilis)XP_010096287,烟草(Nicotianaattenuata)AFP43764,银合欢(Leucaenaleucocephala)ACG58885,黄瓜(Cucumissativus)XP_004140716。
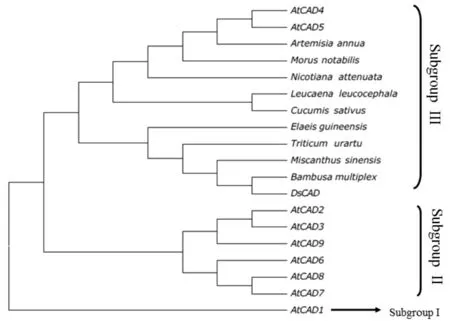
图4 巨龙竹与其他植物CAD系统进化树Fig.4 The phylogenetic tree of the DsCAD and other plants on CADs
CAD编码基因在多种植物体内存在基因家族,不同CAD同工酶在催化肉桂醛的生成肉桂醇的过程中表现出不同的活性,如拟南芥的9个CAD基因中只有AtCAD4和AtCAD5在木质素合成中起重要作用[21]。系统进化分析显示,DsCAD及其他9种植物的CAD蛋白与拟南芥AtCAD4和AtCAD5聚为一支(subgroupⅢ,图4),而与拟南芥其他CAD亚型(subgroupⅠ和subgroupⅡ,图4)亲缘关系较远,表明DsCAD与AtCAD4、AtCAD5在木质素合成中的功能相似,对巨龙竹木质素生物合成起着重要作用。在系统进化分支subgroupⅢ中,DsCAD又与油棕、乌拉尔图小麦、芒草、孝顺竹等单子叶植物聚为一类,表明它们的亲缘关系较近,其中与孝顺竹、芒草等禾本科植物亲缘关系更近;而拟南芥、青蒿、烟草、川桑、银合欢、黄瓜等与巨龙竹亲缘关系较远的双子叶植物则聚为另一类。
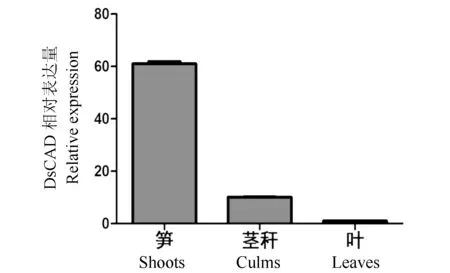
图5 巨龙竹DsCAD不同组织表达Fig.5 Real time PCR detection of the DsCAD in shoots, culms and leaves in Dendrocalamus sinicus
2.3 DsCAD在巨龙竹不同组织中的表达分析
采用实时荧光定量PCR(Real-time PCR)方法,以特异引物DsCAD-F和DsCAD-R检测DsCAD在巨龙竹的笋、茎秆和叶3个组织中的表达情况(结果见图5)。图5显示DsCAD基因在巨龙竹3个组织中表达量有所不同。竹笋中的表达量最高,茎秆中的表达量次之,在叶中的表达量最低。由DsCAD这种组织表达量的变化,可以推测巨龙竹为满足其巨大以及生长快速的特性,在竹笋期间已经合成大量的木质素以支撑整个高大植株的生长,而茎秆的木质化过程则相对缓慢些。
3 结论与讨论
肉桂醇脱氢酶作为植物木质素合成中重要的限速酶,可以将不同的肉桂醛转化成相应的肉桂醇,从而影响木质素的形成与结构,是调控木质素合成的理想控制点[22]。目前,已有调控CAD基因以降低植物植株的木质素含量或改变其组成结构以利于降解的报道,如对烟草和杨树的CAD基因反义抑制显示,其木质素含量变化很小,但组成结构发生很大变化,更有利于木质素的抽取[23];通过抑制4CL基因表达来获得低木质化的玉米[1]、挪威云杉(Piceaabies)[24]等转基因植株。此外,由于可以与高分子产生较强的分子间作用力,利用木质素制备高强度复合材料成为近年来的研究热点,这些研究为利用基因工程增加工业用材植物的木质素含量或改造组分增加其强度,从而为生产环保的建筑材料等产品提供了一些启示[25]。
巨龙竹因其特有的秆材优异性,被视为最具科学研究价值和开发利用潜力的经济用材竹种之一,在人造板材、制浆造纸和生物炼制等领域表现出极高的开发研究价值,其中通直型巨龙竹还是特大型工业用材的优良竹种[26]。巨龙竹分布的滇西南和滇南地区为傣族、佤族、拉祜族等少数民族聚居的边疆地区,合理开发利用巨龙竹发展竹产业,有利于提高当地经济发展水平、改善生态环境[27]。
本研究运用逆转录PCR(RT-PCR)方法从巨龙竹茎秆中克隆得到肉桂醇脱氢酶DsCAD,其包含1080 bp完整的cDNA开放阅读框,编码359个氨基酸;利用生物信息学软件对其进行序列分析、多重氨基酸序列比对、理化性质分析、结构预测及系统进化分析,确定DsCAD为巨龙竹木质素合成中有重要作用的CAD基因,为深入研究巨龙竹木质素的合成机制奠定基础,也为利用基因工程技术调控巨龙竹的木质素合成,生产优质巨龙竹用材及造纸原料提供靶向基因。
[1] Fornalé S, Capellades M, Encina A, et al. Altered lignin biosynthesis improves cellulosic bioethanol production in transgenic maize plants down-regulated for cinnamyl alcohol dehydrogenase[J]. Molecular Plant, 2012, 5(4): 817-830.
[2] 谷振军. 赤桉木质素单体合成途径的基因家族研究[D]. 中南林业科技大学, 2014.
[3] 胡可, 严雪锋, 栗丹, 等. 沉默CCR和CAD基因培育低木质素含量转基因多年生黑麦草[J]. 草业学报, 2013, 22(5): 72-83.
[4] 郭光艳, 柏峰, 刘伟, 等. 转录因子对木质素生物合成调控的研究进展[J]. 中国农业科学, 2015, 48(7): 1277-1287.
[5] Pandey B, Pandey V P, Dwivedi U N. Cloning, expression, functional validation and modeling of cinnamyl alcohol dehydrogenase isolated from xylem of Leucaena leucocephala[J]. Protein expression and purification, 2011, 79(2): 197-203.
[6] 曹佳强, 李波, 杨洋, 等.木质素生物合成中肉桂醇脱氢酶基因(CAD)的研究进展[J]. 分子生物育种, 2014, 12(5): 1034-1043.
[7] Knight M E, Halpin C, Schuch W. Identification and characterization of cDNA clones encoding cinnamyl alcohol dehydrogenase from tobaco[J]. Plant Molecular Biology, 1992, 19(5): 793-801.
[8] Deng W W, Zhang M, Wu J Q, et al. Molecular cloning, functional analysis of three cinnamyl alcohol dehydrogenase (CAD) genes in the leaves of tea plant, Camellia sinensis[J]. Journal of plant physiology, 2013, 170(3): 272-282.
[9] Sun Y, Wu Y, Zhao Y, et al. Molecular cloning and biochemical characterization of two cinnamyl alcohol dehydrogenases from a liverwort Plagiochasma appendiculatum[J]. Plant physiology and biochemistry, 2013, 70: 133-141.
[10] 任珊珊, 赵艳玲, 白华, 等. 杨树肉桂醇脱氢酶基因序列和表达模式分析及CAD4酶活性检测[J]. 华中农业大学学报, 2011, 30(5): 578-584.
[11] 王丽华, 李杰勤, 詹秋文, 等. 高粱 SbCAD4 基因的克隆与序列分析及原核表达分析[J]. 湖南农业大学学报: 自然科学版, 2015, 41(6): 595-601.
[12] 张逢凯, 潘婷, 盛璐, 等. 马尾松 CAD 基因的克隆及其编码蛋白质的结构预测[J]. 分子植物育种, 2014, 12(4): 638-645.
[13] 倪志勇, 李波, 范玲. 棉花肉桂醇脱氢酶基因 GhCAD3 的克隆及原核表达[J]. 核农学报, 2010 (5): 910-916.
[14] 贾良智, 孙吉良. 我国发现巨龙竹[J]. 竹类研究, 1982, 1 (1): 10.
[15] 谷志佳, 杨汉奇, 孙茂盛, 等. 巨龙竹资源分布特点及其开花结实现象[J]. 林业科学研究, 2012, 25(1): 1-5.
[16] 吴谨会, 谭宏超. 巨龙竹的生长发育规律及播种育苗技术[J]. 云南林业, 2006, 27(6): 21-22.
[17] 普晓兰, 杜凡. 巨龙竹纤维形态及变异规律的研究[J]. 云南林业科技, 2003 (1): 1-4.
[18] 刘世男, 辉朝茂. 珍稀竹种巨龙竹的研究现状和展望[J]. 世界竹藤通讯, 2011 (5): 26-30.
[19] 张鲁斌, 谷会, 弓德强, 等. 植物肉桂醇脱氢酶及其基因研究进展[J]. 西北植物学报, 2011, 31(1): 204-211.
[20] Kim S J, Kim M R, Bedgar D L, et al. Functional reclassification of the putative cinnamyl alcohol dehydrogenase multigene family in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(6): 1455-1460.
[21] 龚琰, 许梦秋. 木质素合成关键酶——肉桂醇脱氢酶的研究进展[J]. 生物技术通报, 2010, 4: 47-49.
[22] 陈博雯, 蒋华, 覃鹏飞, 等. 尾叶桉 GLU4 无性系肉桂酰乙醇脱氢酶基因克隆及序列分析[J]. 西部林业科学, 2014, 43(2): 19-24.
[23] 孔华, 郭安平, 郭运玲, 等. 木质素生物合成及转基因调控研究进展[J]. 热带农业工程, 2009, 33(5): 47-53.
[24] 陈永忠. 低木质素转基因挪威云杉的植株再生及功能基因表达的微阵列检测[D]. 中南林学院, 2002.
[25] 马艾丽. 木质素高值化材料的制备与应用性能研究[D]. 华南理工大学, 2014.
[26] 史正军. 甜龙竹及巨龙竹半纤维素, 木质素结构诠释及相互间化学键合机制解析 [D][D]. 北京林业大学, 2013.
[27] 孙茂盛, 汤成松, 杨宇明, 等. 特有珍稀竹种巨龙竹种子育苗技术[J]. 世界竹藤通讯, 2013 (1): 22-25.
Cloning and Functional Analysis of Cinnamyl Alcohol Dehydrogenase Gene fromDendrocalamussinicus
SUN Jin-jin1,2, ZHU Jin-xin1,2, WANG Juan2,3,YANG Yu-ming2,3, WANG Yi2,3
(1.Southwest Forestry University,Kunming 650224,Yunnan, China;2.The Key Laboratory of Rare and Endangered Forest Plants of State Forestry Administration,Yunnan Academy of Forestry,Kunming 650201,Yunnan, China;3.The Key Laboratory of Forest Plants Cultivation and Utilization,Yunnan Academy of Forestry,Kunming 650201,Yunnan, China)
Cinnamyl alcohol dehydrogenase (CAD) is one of the key enzymes in lignin biosynthesis. In this study, a CAD gene (designated as DsCAD) was obtained from the culm ofDendrocalamussinicusby RT-PCR with a pair of special primers designed based on the transcriptome date. The DsCAD gene has a 1080bp open reading frame (ORF) that is predicted to encode a protein of 359 amino acids with predicted molecular mass of 38689.6 and a basic isoelectric point of 6.18. DsCAD gene was analyzed by bioinformatics tools. The results showed that the DsCAD encoding sequence has the conserved domain of CAD superfamily and it has typical characteristics of CAD genes in plants.Dendrocalamussinicushas more closer relative relationship with Poaceae plants and the DsCAD sequence shared high sequence identity(95%) withBambusamultiplex. Real time PCR analysis showed that the DsCAD was most strongly expressed in the shoots. This result will provide useful information for lignins biosynthesis research ofDendrocalamussinicusin future.
Cinnamyl alcohol dehydrogenase;Dendrocalamussinicus; Gene clone; Real time PCR
2016-03-21
云南省对外科技合作计划(2014IA3);云南省基础研究重点项目(2013FA054);云南省中青年学术技术带头人后备人才培养项目(2010CI016)
孙金金(1986-),女,硕士研究生,主要从事植物地理学研究。通信作者:王毅(1981-),男,助理研究员,博士,主要从植物分子生物学研究。E-mail:228285818@qq.com

