胫骨内注射大鼠骨转移疼痛模型的显像研究
刘从进宋洁平毛应启梁王渊恺朱汇庆张光明刘兴党
胫骨内注射大鼠骨转移疼痛模型的显像研究
刘从进1宋洁平2毛应启梁3王渊恺1朱汇庆1张光明1刘兴党1
【摘要】目的:探讨胫骨内注射法建立的大鼠乳腺癌骨转移疼痛模型骨病灶的影像学确认方法。方法:将Walker 256大鼠乳腺癌腹水瘤注射入Wistar大鼠胫骨腔内,制作乳腺癌骨癌痛模型;以胫骨内注射等量PBS溶液作为对照组。使用von-Frey法,测量大鼠后足机械痛觉阈值,观察各组疼痛变化。对模型组和对照组进行99mTc-MDP骨显像和CT成像,观察骨病灶的骨代谢变化及骨质结构的变化。结果:造模的第3~5天,乳腺癌骨转移疼痛大鼠的机械痛觉阈值较基础值明显下降(P <0.01),并持续下降83.2%左右,至第9天左右达到最痛(P <0.001),后下降曲线趋于缓慢变化。造模3~5天后,模型组机械痛觉阈值显著低于对照组(P <0.01),这个差别持续增大至第9天左右。99mTc-MDP骨显像显示所有模型组大鼠胫骨种植肿瘤细胞处放射性摄取显著高于对侧,CT见造模侧胫骨上段骨质破坏,对侧骨质结构正常,未见其他部位骨病灶存在。而对照组所有大鼠骨显像示两侧胫骨放射性分布对称,CT显示两侧骨质结构正常。结论:胫骨内注射法大鼠骨癌痛模型疼痛确切。99mTc-MDP骨显像以及CT可以从骨代谢和骨结构评估骨癌痛模型病灶的发生,是确认此类骨转移疼痛模型造模的成功较好的影像学方法。
【关键词】骨癌痛模型;99mTc-MDP;骨显像;X线计算机,体层摄影术;机械痛觉阈值
肿瘤骨转移疼痛是影响晚期肿瘤患者生命质量的重要因素,是临床和研究中比较受到关注的方向之一[1-3]。使用合适稳定的动物模型是基础研究的重要方法,以骨转移疼痛为主要研究目的、通过向雌性大鼠胫骨内注射Walker256乳腺癌细胞是比较成熟的造模方法[4-5]。临床上核素骨显像和CT在骨病灶检出上具有各自的优势,本研究中核素骨显像和CT在胫骨内注射骨转移模型中同样具有显像识别价值,有了更多的体内显像手段,有助于我们对模型制作进行更直接的影像学评估。
方 法
1.材料
1.1实验动物:雌性Wistar大鼠(体重70~-80g,140~160g),购自中国科学院上海实验动物中心。动物饲养于12h/12h昼夜交替,室温22±1℃环境中,自由摄食和饮水,在实验环境中适应1周后进行实验。每次行为实验前均进行环境适应性训练,以排除应激干扰。所有实验均严格按照国际实验动物使用准则对实验动物进行处理。32只大鼠随机分2组:模型大鼠24只,对照组8只。
1.2肿瘤细胞来源:Walker256 大鼠乳腺癌细胞由复旦大学上海医学院中西医结合系实验室提供。
1.3. 试剂/药品:99mTc-MDP购买自上海欣科医药有限公司。
1.4. 仪器设备:SPECT/CT:SymbiaT16,Siemens, 美国
2.方法
2.1 动物模型制作:参照文献[5]培养获得Walker256腹水瘤细胞。
大鼠使用10%水合氯醛(4ml/kg)腹腔注射麻醉,以大鼠脚趾对有齿镊钳夹无反应为麻醉满意指标。微量进样器依次吸入:1μl空气、2μl明胶海绵水溶液、lμl空气、4μl肿瘤细胞或者PBS溶液(用于对照组)。酒精消毒待手术部位皮肤后,使用文献中[5]的改良法,不暴露胫骨平台,用7号针头在右膝关节髌韧带内侧缘沿胫骨纵轴往胫骨远端钻约1cm,然后将准备好的微量进样器的内容物注射入对应的各组骨髓腔内。最后均推入2μl凝胶海绵溶液封口。
2.2 von Frey机械痛觉超敏测定:大鼠置于不锈钢钢丝网底的特制有机玻璃盒子中,保持环境安静,室温21~23℃,让大鼠适应20min后,根据Dixon介绍的up-and-down法:将一系列von Frey细丝按照一定的顺序刺激大鼠脚掌中部皮肤,观察大鼠缩足反应。大鼠对von Frey细丝的刺激有缩足动作称为阳性反应,反之成为阴性反应。刺激从2.0g开始,当阳性反应时,改用低一级刺激,当阴性反应时,改用高一级的刺激。从第一次阳性反应后再测试5次,然后用软件计算出50% von Frey反应阈值作为机械性痛觉阈值。
2.399mTc-MDP骨显像、CT扫描及图像分析:造模后10d行99mTc-MDP骨显像。大鼠10%水合氯醛(4ml/kg)腹腔注射麻醉后,行尾静脉给药,每只大鼠1mCi的99mTc-MDP,2h后,再行腹腔麻醉,并将大鼠固定于硬纸板上,使用Siemens symbiat16 SPECT/CT行静态骨扫描显像。采集参数:Count:1000Kcts;zoom:1.23;Matrix-Size:256×256。采集结束后使用工作站对数据进行处理,得到可视的骨扫描显像。观察组件放射性摄取差异。在Image J (National Institute of Health,USA)软件中使用ROI方法比较分析两侧后肢胫骨上段放射性计数。
骨显像结束后即刻行CT扫描。使用SiemensSymbia T16 SPECT/CT的16排CT扫描,采集参数:120kV,100mAs。窗宽窗位设为骨窗。图像分析:视觉观察,发现骨质破坏记为阳性,否则为阴性。
结 果
1.机械疼痛阈值
实验组大鼠的基础痛觉阈值(BSL:造模前1周内3次测痛结果平均值)右侧为11.05±0.35g,左侧为11.40±0.25g,对照组两侧基础痛觉阈值分别为11.77±0.34g和11.63±0.13g,各组数据之间无统计学差异(P >0.05)。模型组造模侧(右侧)肢体的疼痛随后迅速加重,至第3天即明显低于对侧及对照组的左右侧(P <0.01)。至第7~9天,疼痛基本达到最低水平位置,变化趋于稳定,在第9天,痛觉阈值已降低至1.86±1.10g,下降了约83.2%。实验组左侧后肢虽没有进行造模手术,但观察到与造模侧同步的疼痛感觉变化,幅度上略好于造模侧。对照组两侧后肢痛觉阈值随着测痛次数的增加,出现轻微的下降,并在第13天时左侧后肢有比基础值统计学差异的降低(P <0.05)。见图1。
2.99mTc-MDP骨显像
造模第10天使用西门子Symbia T16 SPECT进行大鼠静态显像(图2),图像导出DICOM格式后用Image J计算右侧与左侧胫骨上段放射性摄取比值(R/L),对照组比值为:1.03±0.06,而模型组比值为:1.23±0.11,两组均数比较P<0.001。
3.CT骨形态及离体骨组织形态
造模第10天,使用西门子Symbia T16所带CT对大鼠进行X线断层显像,如图3所示,模型组均见到造模侧骨质破坏,其中1只大鼠造模处见软组织肿块,而对侧(左侧)骨结构未见异常。对照组两侧胫骨CT显像均未见异常。第28天处死大鼠取离体胫骨,可见模型组造模胫骨色泽黯哑,表面不光滑,骨质破坏,变脆易折断。对照组胫骨色泽光亮,骨质结构完整。
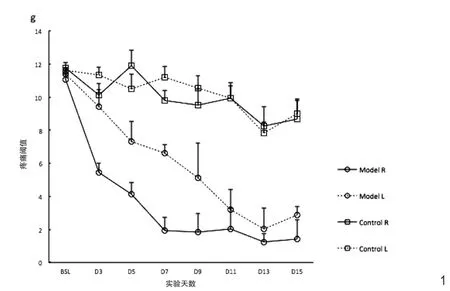
图1 造模术后两组大鼠左右后肢机械痛觉阈值变化。模型组造模侧肢体机械痛觉阈值显著下降,同时对侧同步下降,出现镜像疼痛。对照组随着测痛次数增加,痛觉阈值略有下降。Model:实验组,Control:对照组。R:右侧后肢(造模侧),L:左侧后肢。
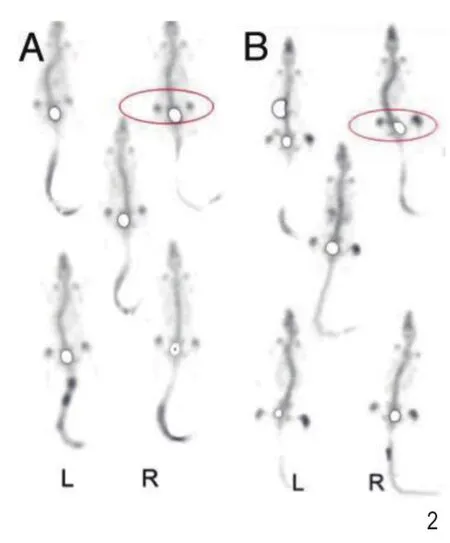
图299mTc-MDP骨显像。 A.对照组,两侧胫骨放射性摄取基本对称。B.模型组,右侧胫骨放射性摄取显著高于对侧。
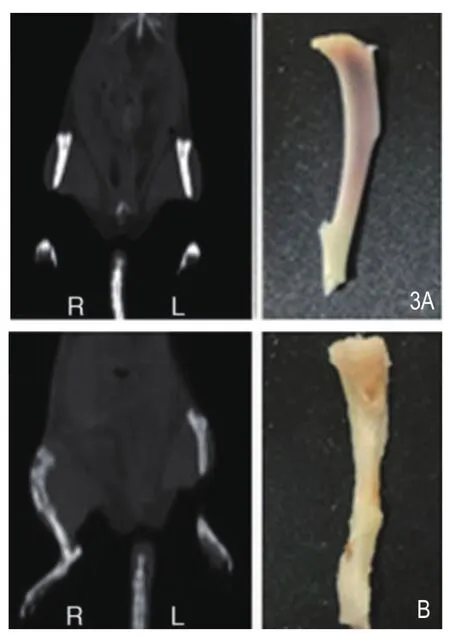
图3 大鼠CT显像及离体骨组织形态。A.对照组,CT见两侧胫骨骨质结构正常,离体右胫骨见形态正常,骨表面光滑,色泽光亮。B.模型组,CT见右侧胫骨骨质破坏,左侧正常;离体右侧胫骨色泽黯哑,表面不光滑,骨质破坏。
讨 论
骨癌痛模型是研究肿瘤骨转移疼痛的主要工具,目前造模包括心内注射肿瘤细胞、静脉注射肿瘤细胞和胫骨内注射肿瘤细胞三种主要的方法。前两种方法主要在裸鼠中开展,模型成功率较低,且容易引起其他脏器部位转移,骨转移灶位置不确切,模型动物存活时间短等局限。胫骨内注射相对前两种方法在机制上不能完全代表血运转移的发生,但其造模成功率高,转移部位确切,诱发的转移性疼痛显著,且模型动物存活时间较长[6-7]。对以疼痛为研究目的的研究具有非常高的价值。本试验中使用了毛应启梁等发表的改良造模方法,用7号针胫骨平台经皮钻孔,避免暴露胫骨,减轻实验动物造模创伤。使用明胶封闭肿瘤细胞在微量注射器后进行注射,有效防止肿瘤细胞在皮下骨外种植,本试验中仅1例大鼠造模处出现软组织肿块,造模时肿瘤细胞播撒或胫骨内肿瘤扩张至胫骨外可能。
在使用von Frey观察大鼠后肢疼痛时,可以明确肿瘤骨转移模型的疼痛发生,第7天后疼痛趋向稳定。同时可以观察到非造模侧后肢疼痛伴随发生,考虑认为镜像疼痛,与既往文献报道一致[8],这种现象机制尚不清楚,体液机制认为是体液内炎症因子致使对侧脊髓神经根的炎症刺激反应,我们在后续实验里将对脊髓组织的炎症因子进行分析比较。对照组大鼠出现痛觉阈值轻微的降低,考虑认为是反复von Frey纤维针刺激大鼠足底后引起的痛觉过敏。
99mTc-MDP骨显像,在临床中应用广泛,是肿瘤骨转移诊断的重要手段。其对骨病灶高敏感性,能够发现较早的骨转移病灶,但特异性相对较差。本试验中使用临床使用的SPECT/CT设备,在150g左右的大鼠显像上,使用低能高分辨准直器,显像能力尚不能达到足够清晰,使用针孔准直器有可能改善图像质量[9]。西门子Symbia T16所带CT为16排诊断级别CT,在大鼠断层显像中,能够清晰显示胫骨横断面的结构,诊断骨质破坏的结果与后续离体组织随访一致,诊断准确性高。
近年来,micro-SPECT的应用愈来愈广泛,对于动物实验是非常有价值的设备。但很多基础研究者对核医学的相关设备和技术手段缺乏足够的了解,较少有作者使用骨显像的方法验证骨癌痛模型,故核医学在辅助基础研究中尚有很多可以拓展的空间。尤其是micro-SPECT/CT和micro-PET/CT等混合显像设备,能够从功能代谢以及微小解剖结构上帮助研究者观察活体内的组织内在变化。
参 考 文 献
[1]陈万青,张思维,郑荣寿,等. 中国2009年恶性肿瘤发病和死亡分析.中国肿瘤,2013,22:2-12
[2]Burger V, D'Olimpio JT. Improving quality of life through pain control. Clin J Oncol Nurs,2013,17:117-118.
[3]LIU CJ, Song JP, Mao-Ying QL, et al. Bone metastatic pain palliation in a modifed rat bone cancer pain model using 188Re-HEDP therapy. Journal of Nuclear Medicine, 2015,56:1199.
[4]谭煌英,于莉莉,高福云,等.大鼠骨癌痛模型的建立及组织学研究 .癌症进展,2005,3:75-79.
[5]Mao-Ying QL, Zhao J, Dong ZQ, et al. A rat model of bone cancer pain induced by intra-tibia inoculation of Walker 256 mammary gland carcinoma cells. Biochemical and Biophysics Research Communications,2006, 345: 1292-1298.
[6]韩帅,杨兴海,万宗淼,等.用于活体成像的人肺腺癌白发骨转移小鼠模型.国际骨科学杂志, 2015, 36: 151-156.
[7]李晓青,孙玉明,黄章翔,等. Walker256乳腺癌细胞构建大鼠胫骨骨癌痛模型.中国肿瘤生物治疗杂志,2008,15:41-45.
[8]黄章翔,李晓菁,赵志奇,等.癌症痛大鼠模型中镜像痛现象观察.西南国防医药,2009,19: 30-32.
[9]GAO XL, YANG SF, YU YL, et al. The pinhole SPECT for animal model of bone metastasis with SPC-A-1BM human pulmonary adenocarcinoma bone metastasis cell line. Nuclear Science and Techniques, 200819: 290-296.
中国医学计算机成像杂志,2016,22:269-273
Chin Comput Med Imag,2016,22:269-273
1 Department of Nuclear Medicine, Huashan Hospital of Fudan University
2 Department of Nuclear Medicine, Dongfang Hospital of Tongji University
3 Shanghai Medical College of Fudan University
Same contribution as the frst author: LIU Cong-jin,SONG Jie-ping
Address: 12 Wulumuqi Middle Rd, Shanghai 200040,P.R.C.
Address Correspondence to LIU Xing-dang (E-mail: xingdliu@yahoo.com)Foundation items: 1. Natural Science Foundation of China No. 81201113;2. Shanghai Municipal Commission of Health and Family Plan Youth Research Project No. 20124Y069
中图分类号:R445.6
文献标志码:A
文章编号:1006-5741(2016)-03-0269-05
收稿时间:(2016.02.04;修回时间:2016.04.07)
作者单位:1 复旦大学附属华山医院核医学科2 同济大学大学附属东方医院核医学科3 复旦大学上海医学院中西医结合系并列第一作者:刘从进,宋洁平
通信地址:上海市乌鲁木齐中路12号, 上海 200040
通信作者:刘兴党(电子邮箱:xingdliu@yahoo.com)
基金项目:国家自然科学基金 No. 81201113;上海市卫计委青年科学基金项目(20124Y069)
Bone Imaging Study in Rat Bone Metastatic Pain Model via Tibia Injection
LIU Cong-jin1, SONG Jie-ping2, MAO Ying-qi-liang3, WANG Yuan-kai1,ZHU Hui-qing1, ZHANG Guang-ming1, LIU Xing-dang1
【Abstract】Purpose: To investigate the imaging methods to confirm bone lesions in rat bone metastatic pain model via tibia injection of breast cancer cells. Methods: Bone cancer pain model of breast cancer were made by injection of walker 256 mammary carcinoma cells cultured in ascites into Wistar rats' tibial cavity; The other group of rats were injected with equal volume of PBS solution into tibial cavity which was take as the control group. von-Frey method was used to measure the mechanical pain threshold of the rat back feet to observe the changes of pain in each group.99mTc-MDP bone imaging and CT imaging were performed in the model group and control group to observe the changes of bone metabolism and bone structure. Results: Three to fve days after the model was made,the mechanical pain threshold of the breast cancer bone metastasis pain rats model was decreased signifcantly when compared to the basic values (P <0.01), and was continued to decline by about 83.2%, on 9th day the pain was reached the most heavy degree (P <0.001), and after that the decline curve was changed slowly. Three to fve days after the model was made, the mechanical pain threshold in the model group was signifcantly lower than thatin the control group (P <0.01). The difference was enlarged to the biggest while in the following 9 days. The results of99mTc-MDP bone scintigraphy showed that the location of tibia planted tumor cells in model group had signifcantly higher radioactivity than the contralateral tibia bone. CT scans showed bone destruction in the same side tibia. The bone structure of the other side of tibia was normal. While in the control group bone imaging showed that both sides of the tibia had similar radioactivity, and CT scans showed normal bone structure in both sides. Conclusion: Intratibia injection method of rat bone cancer model can arise exactly pain sites.99mTc-MDP bone scintigraphy and X-ray CT imaging can evaluate the occurrence of lesions of bone cancer pain from bone metabolism and bone structure.99mTc-MDP bone scintigraphy and X-ray CT imaging are suitable imaging methods to confrm such intratibia injection bone metastasis pain rat model..
【Key words】Bone cancer pain model;99mTc-MDP; Bone scintigraphy; X-ray computed,tomography; Mechanical pain threshold

