无机化学中的水解反应
陈亚光(东北师范大学化学学院,长春130024)
·自学之友·
无机化学中的水解反应
陈亚光*
(东北师范大学化学学院,长春130024)
摘要:在无机化学领域中,水解反应早已为人熟知,但很少被系统讨论。本文将无机化学中的水解反应进行汇总并分类:水溶液中的水解反应,固态物质加热时的水解反应和水解缩合反应。本文介绍了水溶液中水解反应的水解机理、水解反应及水解反应产物在生产、生活中的应用。
关键词:水解反应;水解机理;无机化合物;应用
无机化学中的化学反应可以分为两大类:氧化还原反应和非氧化还原反应。氧化还原反应是在反应前后元素的氧化数发生变化的化学反应。非氧化还原反应是在反应过程中发生原子或原子团交换的化学反应。非氧化还原反应可以分为酸碱中和反应、水解反应、配位反应、沉淀反应(结晶反应)和热分解反应等。
水解反应是水与另一化合物反应,该化合物分解为两部分,水中氢原子加到其中的一部分,而羟基加到另一部分,因而得到两种或两种以上新的化合物的反应过程。这个水解反应的概念适用于有机化学中卤代烃、酯的水解反应,也适用于共价型卤化物如SiCl4、TiCl4的水解反应。但在无机化学中,水解反应的概念常表达为:在溶液中,盐电离出来的离子跟水所电离出来的H+或OH-离子结合生成弱电解质的反应[1]或盐解离产生的离子与水作用,使水的解离平衡发生移动,从而影响溶液的酸碱性的作用(反应)[2,3]。实际上,上述两种表达都不够全面,因为一些共价型卤化物、卤素互化物不能称为盐,但它们都能发生强烈的水解反应。因此建议将水解反应表达为:在水溶液中,当离子型化合物的阳离子(阴离子)或共价型化合物中的正电性(负电性)的原子具有足够强的极化能力,以至在与水分子发生作用时使水分子中的O―H键断裂,阳离子(阴离子)或共价型化合物的正电性(负电性)的原子结合OH-基团(H+离子)、生成难溶物质或弱电解质(配离子,弱酸、弱碱等),放出H+(放出OH-基团)的过程。由此可知,极化能力很弱的阳离子如第一主族的金属离子Li+、Na+、K+、Rb+、Cs+和第二主族的金属离子Ca2+、Sr2+、Ba2+不能使水分子的O―H键断裂,因此通常说这些离子不发生水解反应,而只以水合离子的形式存在于水溶液中。强酸的阴离子如Cl-、Br-、NO、ClO等离子也不能使水分子的O―H键断裂,因此通常认为这些阴离子也不发生水解反应。从酸碱质子理论的角度看,发生水解的(水合)阳离子或阴离子是弱的质子酸或弱的质子碱,因此,在酸碱质子理论中,水解反应实质上是两性的水分子与质子酸、质子碱之间进行的质子传递反应。而在酸碱电子理论中,水解反应实质上是在路易斯酸和路易斯碱之间进行的酸碱反应。
在无机化学中,大多数的化合物都可以发生水解反应,而且水解反应的反应类型、进行的程度以及反应机理各不相同[4]。本文将水解反应进行分类并对各类水解反应发生的条件和机理进行讨论。
1 水溶液中的水解反应
由于水是最常用的一种溶剂,因此在水溶液中发生的水解反应是一类重要的反应。水解反应改变溶液的酸度,同时也改变物质的存在形态。目前在合成领域及材料领域用来制备纳米粒子的一种常用方法——溶胶-凝胶法就是利用金属化合物的水解反应实现的。
在水溶液中的水解反应可根据反应进行的程度分为完全水解反应和不完全水解反应。
1.1 完全水解反应
完全水解反应是指化合物中的阳离子或共价型化合物的正电性的原子完全转化为氢氧化物(含氧酸)的反应。一些高氧化数金属的卤化物、非金属元素的共价型卤化物,除CCl4、SF6外均强烈地进行水解反应,生成相应的氢氧化物(水合氧化物或含氧酸)和卤化氢。

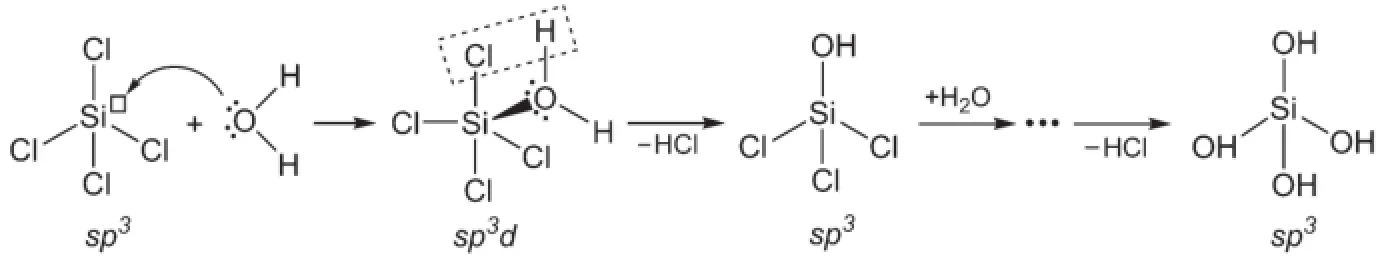
图1 亲核水解反应示意图
1.2 水解反应机理
详细观察以上水解反应可以发现,能发生水解反应的化合物的中心原子或是具有空的价轨道,或是具有未成键的价电子对。第三周期及以下各周期元素都是具有空轨道的元素,它们的水解反应以SiCl4的水解(反应(3))为例进行说明[4,5]。Si是第三周期第四主族元素,4个在sp3杂化轨道上的价电子与4个Cl原子在p轨道上的价电子配对形成4个极性共价单键,它的3d轨道没有填充电子。当SiCl4与H2O接触时,水分子的氧原子利用它的孤电子对向正电性的Si原子进攻(图1)。硅原子利用它的空轨道接受氧原子的孤电子对,并由四配位的四面体几何构型转变为五配位的三角双锥几何构型。由于Si―O键(键能为466 kJ·mol-1)比Si―Cl键(360 kJ·mol-1)稳定,一个Si―Cl键断裂,生成一个Si―O键。由于Si―O键的生成削弱了水分子的O―H键,导致一个H―O键断裂,生成四面体构型的中间产物SiCl3OH和H+、Cl-。在水分子的作用下,SiCl3OH中的Si―Cl键依次断裂,Si―O键依次生成,最后得到完全水解产物正硅酸Si(OH)4。在上述反应的反应过程中,水分子进攻的是正电性的Si原子,因此这类水解反应也称为亲核水解反应。
第二周期元素Be、B的氯化物BeCl2、BCl3的水解反应也是利用空轨道进行的,只不过它们利用的空轨道是第二电子层的2p轨道。
在NCl3分子中,N原子是具有孤对电子的中心原子,而且孤对电子指向四面体的一个角顶,很容易与其他具有空轨道的原子相互作用。当NCl3与H2O接触时,水分子的氢原子向NCl3的N原子靠近,利用它的空轨道(H―O键的电子对严重偏向氧原子,近似认为H原子的轨道为空的)接受N原子的孤对电子,生成配位共价键(图2)。由于N―H键的键能(386 kJ·mol-1)大于N―Cl键的键能(313 kJ·mol-1),因此稳定性较差的N―Cl键和水分子的一个O―H键断裂,氢原子与氮原子结合,解离出的OH基与Cl原子结合,生成水解反应的中间产物NCl2H和HOCl。同样,在水分子的作用下,NCl2H中的N―Cl键依次断裂,N―H键依次生成,水解反应的最终产物是氨(NH3)。在上述反应的反应过程中,水分子进攻的是负电性的N原子,因此这类水解反应也称为亲电水解反应(反应(5))。
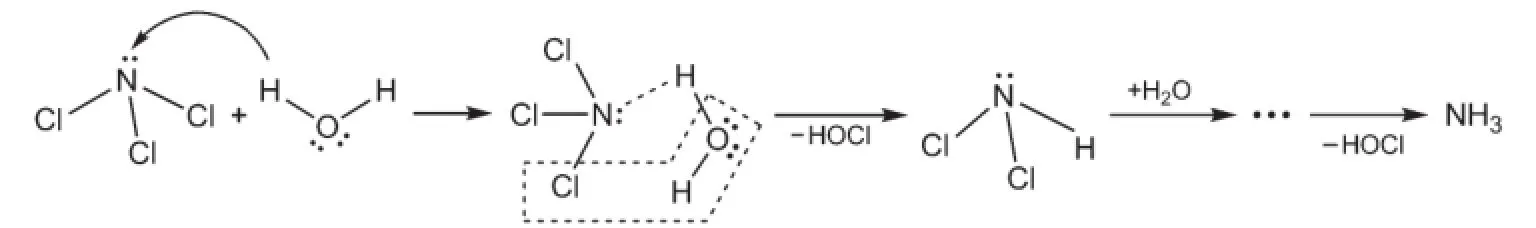
图2 亲电水解反应示意图
N元素的同族元素P位于第三周期,在NCl3的同类化合物PCl3中,P原子既有孤对电子又有空的d轨道。因此在PCl3与H2O接触时,上述两种反应可以同时进行(图3)。水解产物是四配位的亚磷酸HPO(OH)2(反应(6))。
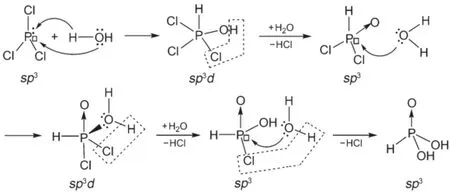
图3 PCl3水解反应示意图
1.3 不完全水解反应
此类水解反应的特点是反应物与生成物在水溶液中建立水解平衡,生成物H+离子或OH-离子可改变溶液的酸碱性。
1.3.1 不生成难溶物质的水解反应
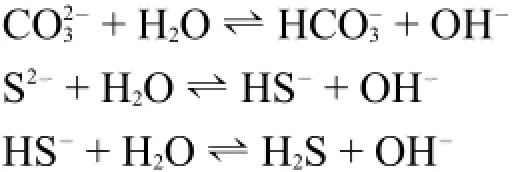
极化能力较强的金属阳离子和铵离子的水解产物一般是氢氧化物或羟基配离子,释放的氢质子使溶液呈现酸性。
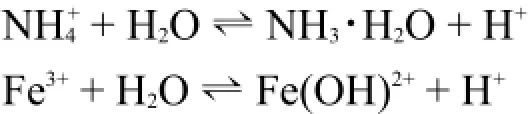
大部分低价过渡金属的强酸盐进行这类反应,它们的溶液呈现弱酸性。
加热能促进某些阳离子实现完全水解,在溶液中析出氢氧化物沉淀。
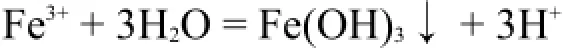
镧系元素离子Ln3+的半径是+3氧化数离子中离子半径最大的,因此它们的极化能力较弱,在水溶液中,仅进行微弱的水解反应[6]:
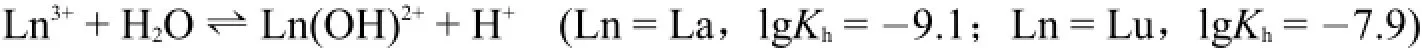
对于不完全水解反应,水解反应的程度可以用水解反应的平衡常数(Kh)来表示。
1.3.2 生成难溶物的水解反应
第五主族元素的+3氧化数的氯化物从上至下中心原子的半径依次增加,极化能力降低,水解程度也随之降低。而且Sb3+和Bi3+的水解中间产物是难溶的,因此它们的氯化物的水解产物是难溶碱式氯化物或氯氧化物。
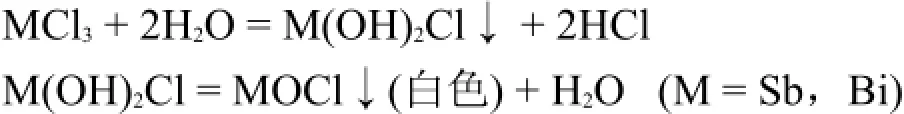
SnCl2的水解现象是最为人熟知的,它的水解反应为:
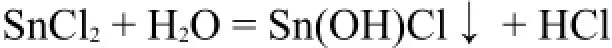
2 加热条件下的水解反应
这类水解反应主要发生在具有较强极化能力的阳离子的水合化合物上。当加热这些固态水合盐时,往往得不到相应的无水盐。例如:
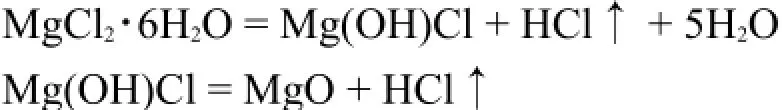
极化能力较强的金属离子的水合盐如AlCl3·6H2O、CuCl2·2H2O等也进行此类反应。
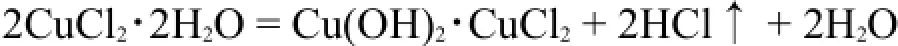
尽管镧系元素在水溶液中仅进行微弱的水解反应,但在加热时镧系元素尤其是重镧系元素的水合卤化物也会进行同样的水解反应,生成卤氧化物[7]:
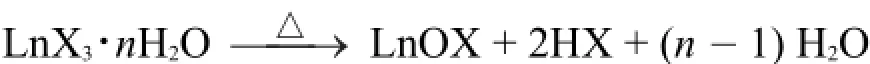
3 水解缩合反应
在水溶液中,一些高氧化数的金属离子如Fe3+、Al3+在浓度稍高的溶液中,会生成双核或多核的水解产物。如Fe3+离子在浓度为1.0 mol·L-1的溶液中水解反应的主要产物是双核的配离子,即[(H2O)4Fe(OH)2Fe(H2O)4]4+[8]。
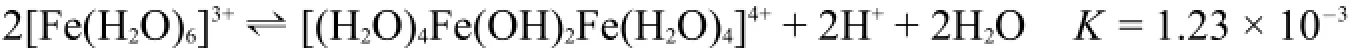
向溶液中加入碱或加热溶液会使Fe3+离子完全水解,生成组成为FeO(OH)的胶状物质,该物质通常也写作Fe(OH)3。
Al3+离子的水解程度比Fe3+离子的稍弱,但也使溶液的酸度明显增加。
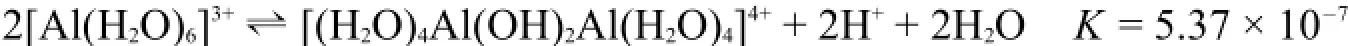
同样,Sc3+离子也生成多种水解产物。例如,在高氯酸溶液中Sc3+离子的存在形式主要是ScOH2+、Sc2(OH、Sc3(OH和Sc3(OH。
4 水解反应及其水解产物的应用
我们最熟悉的碳酸钠、碳酸氢钠、磷酸钠等能作为碱使用就是基于它们的水解反应。其他的应用还包括以下几个方面。
4.1 泡沫灭火器
根据二氧化碳既不能燃烧也不能支持燃烧的性质,人们研制了各种各样的二氧化碳灭火器:泡沫灭火器、干粉灭火器及液体二氧化碳灭火器。其中泡沫灭火器是利用Al3+和CO离子的水解反应互相促进、生成二氧化碳的原理。泡沫灭火器内有两个容器,分别盛放硫酸铝和碳酸氢钠溶液,两种溶液互不接触,不发生任何化学反应(平时千万不能碰倒泡沫灭火器)。当使用泡沫灭火器灭火时,把灭火器倒立,两种溶液混合在一起,就会产生大量的二氧化碳气体:
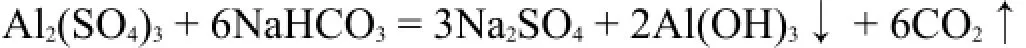
除了两种反应物外,灭火器中还加入了一些发泡剂。打开开关,泡沫从灭火器中喷出,覆盖在燃烧物品上,使燃烧的物质与空气隔离,并降低温度,达到灭火的目的。
4.2 水的净化
自然界的水(河水、湖水、水库水)中存在多种物质,如可溶的无机离子K+、Na+、Ca2+、Mg2+、SO、Cl-,悬浮的细小的矿物颗粒和腐殖质等有机物。为使其达到饮用标准通常经过下面的过程进行净化:
自然水→混凝→沉淀→过滤→杀菌→净水
其中的混凝过程需要使用高效净水剂——碱式氯化铝。碱式氯化铝为无色或黄色树脂状固体,其组成为[Al2(OH)nCl6-n]m(1<n<5,m<10)。碱式氯化铝是介于AlCl3和Al(OH)3之间的一系列水解中间产物聚合而成的高分子化合物(多羟基多核配合物)。氯离子解离后形成带高正电荷的胶体粒子。这些带正电荷的胶体粒子具有强的吸附水中泥土胶粒的能力,因而可以实现高的凝聚效率和沉淀作用。
4.3 产品纯化
在工业生产中,常利用将Fe3+离子水解析出氢氧化铁沉淀的方法,除去产品中的杂质铁。工业生产中向含Fe2+离子的硫酸盐溶液中加入氧化剂(如NaClO3),使Fe2+离子全部转化为Fe3+离子,然后调节溶液的pH在1.6-1.8范围内,加热至85-95°C促进Fe3+离子水解。Fe3+离子的水解产物以黄色的黄铁矾晶体(M2Fe6(SO4)4(OH)12,M=K+、Na+、NH)析出:
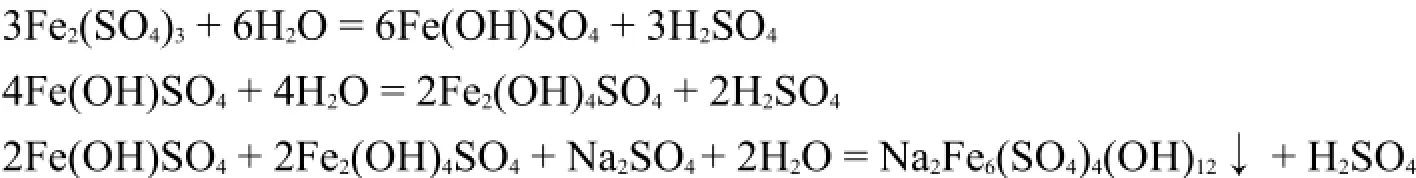
4.4 纳米粉的制备[9]
纳米粉又称为超微粉或超细粉,一般指粒径在100 nm以下的粉末或颗粒。纳米粉是一种介于原子、分子与宏观物体之间,处于中间物态的固体颗粒材料。纳米粉的制备方法多达十几种,其中的水解法和溶胶-凝胶法都是利用水解反应。例如在氧化锆(ZrO2)纳米粉的制备中,是将四氯化锆和二氯氧锆在沸水中循环地加水水解,Zr(IV)的水解产物为水合氧化锆。经焙烧后得到粒径为20 nm左右的氧化锆纳米粉。在溶胶-凝胶法制备纳米粉时,通常使用有机溶剂来控制水的量,使金属盐有控制地水解而形成溶胶。溶胶中的胶体粒子进一步缩合形成凝胶。对凝胶进行热处理得到纳米粉。例如铌钽酸钾纳米粉的制备:
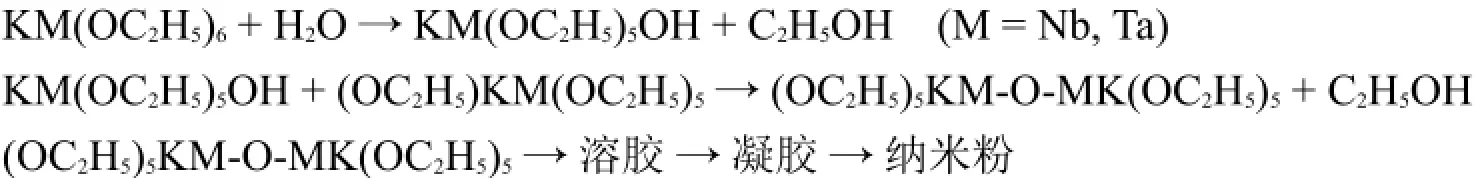
参考文献
[1]人民教育出版社化学室编.化学(第二册).北京:人民教育出版社,2003:64.
[2]宋天佑,程 鹏,王杏乔,徐家宁.无机化学(上册).第2版.北京:高等教育出版社,2009:234.
[3]刘睦清,胡嘉琳.上饶师范学院学报,2001,21(3),103.
[4]冯长君.大学化学,1991,6(5),31.
[5]陈亚光,胡满成,魏 朔.无机化学(下册).北京:北京师范大学出版社,2011:306.
[6]Thompson,L.C.Complexes in Handbook on the Physics and Chemistry of Rare Earths.Vol.4;Gschneidner,K.A.,Jr.,Eyring,L.Eds.;North Holland Publishing Company:Amsterdam,1979;pp 209.
[7]张若桦,申泮文.稀土元素化学.天津:天津科学技术出版社,1987:110.
[8]大连理工大学无机化学教研室.无机化学(下册).北京:高等教育出版社,1993:547,774.
[9]王世敏,徐祖勋,傅 晶.纳米材料制备技术.北京:化学工业出版社,2002:64.
中图分类号:O611.3;G64
doi:10.3866/PKU.DXHX20160474www.dxhx.pku.edu.cn
*通讯作者,Email:chenyg146@nenu.edu.cn
Hydrolysis Reaction in lnorganic Chemistry
CHEN Ya-Guang*
(Faculty of Chemistry,Northeast Normal University,Changchun 130024,P.R.China)
Abstract:In the field of inorganic chemistry,hydrolysis reactions are rarely discussed systematically.In this paper,the inorganic chemistry hydrolysis reactions are divided into three categories:the hydrolysis reactions in aqua solution and on heating,as well as the hydrolysis condensation reactions.The hydrolysis mechanism in aqua solution and application of the hydrolysis reactions and products in industry production and daily life are introduced briefly.
Key Words:Hydrolysis reaction;Hydrolysis mechanism;Inorganic compound;Application

