温度对副溶血弧菌T3SS中相关基因表达的影响*
丁晓燕,曲凌云,王 琛,田欣欣,孙承君,王敏强
(1.烟台大学 生命科学学院,山东 烟台 264005;2.国家海洋局 第一海洋研究所,山东 青岛 266061;3.海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
温度对副溶血弧菌T3SS中相关基因表达的影响*
丁晓燕1,2,曲凌云2,3*,王琛1,2,田欣欣2,孙承君2,王敏强1
(1.烟台大学 生命科学学院,山东 烟台 264005;2.国家海洋局 第一海洋研究所,山东 青岛 266061;3.海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
摘要:III型分泌系统(type III secretion system,T3SS)是副溶血弧菌主要的毒力因子之一,能传递与致病有关的毒性因子来发挥病原菌的毒性,而温度是影响细菌基因表达等生命活动的关键生态因子。本文以ATCC17802和JA21作为实验菌株,分别提取其RNA,在不同温度和温度应激条件下,以pvuA为内参基因,以副溶血弧菌T3SS1的vcrD1、vopS、vopD1和T3SS2的vscC2β、vcrD2β、vopP2β作为目的基因,运用荧光定量PCR(RT-PCR)技术检测T3SS相关基因的表达下,用ΔΔCt法计算基因表达差异。结果表明:副溶血弧菌(Vibrio parahaemolyticus) ATCC17802菌株的T3SS1基因在16 ℃表达量最高,T3SS2基因在25 ℃表达量最高。副溶血弧菌JA21菌株的T3SS1基因和T3SS2基因均在25 ℃表达量最高。2株副溶血弧菌从不同的培养温度转入到应激温度37 ℃后,T3SS1和T3SS2基因的表达量均被显著诱导,并表现出时间依赖性,呈现先升高后降低的趋势。这为进一步探究环境因素与副溶血弧菌致病力的关系提供了科学依据。
关键词:副溶血弧菌;T3SS;RT-PCR;基因表达
副溶血弧菌(Vibrioparahaemolyticus) 属于弧菌科弧菌属,是一种嗜盐嗜温性的革兰氏阴性短杆菌[1],主要生活在海洋环境、盐湖和鱼虾贝类等海产品中。副溶血弧菌能感染鱼类、对虾、文蛤、九孔鲍等,引起水生动物疾病[2],对水产养殖行业造成危害;人类误食带有副溶血弧菌的海产品可导致肠胃炎、呕吐、发烧等症状,严重者甚至引发败血症[3]。副溶血弧菌病主要在中国、日本等沿海国家或地区流行,我国部分沿海地区,细菌性食物中毒的病例中副溶血弧菌食物中毒占居首位(31%)[4]。副溶血弧菌的致病性与其产生的多种毒力因子密切相关,其中III型分泌系统(type III secretion system,T3SS)是副溶血弧菌的主要毒力因子之一,具有细胞毒性[5]和肠毒性[6]。2002年Tagomori[7]完成第一株副溶血弧菌全基因组测序,发现副溶血弧菌含有两套III型分泌系统(T3SS),分别是T3SS1,T3SS2。 T3SS1位于染色体1的毒力岛上,具有30个开放阅读框,且T3SS1存在于所有的副溶血弧菌分离株中,其G+C含量与基因组其它区域有差别,被认为是该菌的一个遗传标记[8]。副溶血弧菌T3SS1 主要贡献对宿主细胞的细胞毒性,引发一系列的细胞效应,介导宿主细胞的自体吞噬作用,最后导致细胞死亡。副溶血弧菌T3SS2位于染色体2的毒力岛上,主要具有肠毒性[9],引起腹泻和破坏肠道组织,同时也发挥少量细胞毒性,在感染过程中发挥重要功能。
环境温度作为关键生态因子之一,其变化会影响微生物等生命体的生命活动[10-11],Hoe和Gogven[12]研究表明外界环境温度的变化可诱导细菌分泌系统的表达。Rao等[13]发现,迟缓爱德华氏菌在感染过程中经历了由环境温度到宿主温度的变化,T3SS的表达相应的受到温度的调控,37 ℃条件下与28 ℃条件下T3SS的转运蛋白表达量不同,而在20 ℃条件下,没有检测到T3SS转运蛋白的表达。Vilches等[14]发现环境因子诱导嗜水气单胞菌AH-3菌株T3SS的表达,其中Ca2+的消耗和高浓度Mg2+是最主要的因素,温度升高也能促进表达。庞欢瑛等[15]研究了溶藻弧菌T3SS转运蛋白vscO基因在不同环境下的表达差异,结果显示vscO基因在特定的环境下表达量最高。而关于环境因子对副溶血弧菌T3SS表达的影响未曾见到报道。
本研究共选取T3SS中6个相关结构和效应蛋白基因为目的基因,采用RT-PCR方法比较不同生长温度和温度应激条件下副溶血弧菌T3SS中相关基因的表达差异,以探讨副溶血弧菌T3SS基因表达与环境温度适应性之间的关系,并进一步探究环境因素变化对副溶血弧菌致病因子表达的影响。
1材料与方法
1.1菌株来源及毒力基因特征
本研究使用的菌株保存于国家海洋局第一海洋研究所免疫与疾控实验室近海微生物资源库。其中,副溶血弧菌ATCC17802购自中国普通微生物菌种保藏管理中心,副溶血弧菌JA21为本实验室分离。

表1 副溶血弧菌T3SS基因信息
1.2引物设计
根据GeneBank数据库中副溶血弧菌T3SS基因,利用Primer Premier 5.0 软件在T3SS基因比较保守区域设计特异性引物,引物序列见表2。 内标基因pvuA上、下游引物序列引用自参考文献[20]。引物均由上海生工生物工程股份有限公司合成。

表2 RT-PCR所用引物
1.3实验试剂与仪器
细菌培养所用2216E培养基按照《微生物学实验》(第三版)[21]进行配制;细菌RNA提取试剂盒R6950-01购自Omega公司;逆转录试剂盒RR047A、荧光定量PCR试剂盒RR820A购自Takara公司;荧光定量PCR仪型号为Applied Biosystems 7500。
1.4实验方法
1.4.1培养温度对T3SS基因表达的影响
将2株副溶血弧菌ATCC17802、JA21接种于2216E培养基中,37 ℃[22]摇床震荡过夜培养,将过夜培养的细菌以1%的比例接种于2216E培养基中,分别放置于16,20,25和37 ℃条件下120 rpm/min摇床震荡培养。根据生长曲线估计培养时间,在OD600达到0.6时,取菌液4 ℃离心取沉淀,用RNA提取试剂盒(Omega)提取总RNA用于T3SS基因转录水平差异的检测。每个实验组各设3个平行。
1.4.2温度应激对T3SS基因表达的影响
将2株副溶血弧菌ATCC17802、JA21接种于2216E培养基中,37 ℃摇床震荡过夜培养,将过夜培养的细菌以1%的比例接种于2216E培养基中, 分别放置于16,20,25和37 ℃条件下120 rpm/min摇床震荡培养。根据生长曲线估计培养时间,待培养至OD600达到0.6,离心弃上清,用等体积2216E培养基重悬菌体沉淀,放置于模拟人体温度的37 ℃条件下120 rpm/min摇床震荡培养,分别于1,2,3和4 h取菌液4 ℃离心取沉淀,用RNA提取试剂盒提取总RNA用于T3SS基因转录水平差异的检测。每个实验组各设3个平行。
1.4.3总RNA提取与反转录
使用Omega细菌RNA提取试剂盒提取副溶血弧菌的总RNA,操作在紫外线灭菌的独立RNA实验室中进行。提取的总RNA的完整性用1.5%的琼脂糖凝胶电泳检测,同时用紫外分光光度计确定RNA浓度。
反转录使用Takara反转录试剂盒,首先去除总RNA中残留的基因组,随后将RNA反转录成单链cDNA,反转录产物cDNA分装后置于-80 ℃保存。
1.4.4荧光定量PCR反应体系与条件
反应体系为20 μL,其中:cDNA 2 μL,2×SYBR Premix Ex Taq II(Tli RNaseH Plus) 10 μL,50×ROX Reference Dye II 0.4 μL,浓度为10 μmol/L的上下游引物各0.8 μL,无菌双蒸水6 μL。
反应条件:95 ℃ 5 min预变性;95 ℃ 10 s,55 ℃ 30 s, 72 ℃ 34 s,40个循环,72 ℃实时检测荧光信号,同时进行ROX值校正。最后进行RT-PCR溶解曲线分析。
1.5数据处理
RT-PCR结果采用2-ΔΔCt法分析不同条件下T3SS基因表达差异。每个菌株以培养温度37 ℃为对照组。
2结果
2.1提取的总RNA检测结果
用1.5%的琼脂糖凝胶电泳检测提取的副溶血弧菌总RNA的完整性,结果显示5SrRNA条带很弱,几乎不可见,而16SrRNA,23SrRNA条带明亮清晰,说明提取的总RNA条带完整。利用紫外分光光度计检测总RNA浓度及纯度,A260/280数值处于1.8~2.0,说明RNA可以进行下一步反转录。分析pvuA基因和vcrD1,vopS,vopD1,vscC2β,vcrD2β,vopP2β基因溶解曲线可知只有单峰值,排除了非特异性扩增,阴性对照无扩增曲线,表明加样时无交叉污染。
2.2荧光定量PCR结果
2.2.1不同培养温度下副溶血弧菌T3SS基因的表达差异
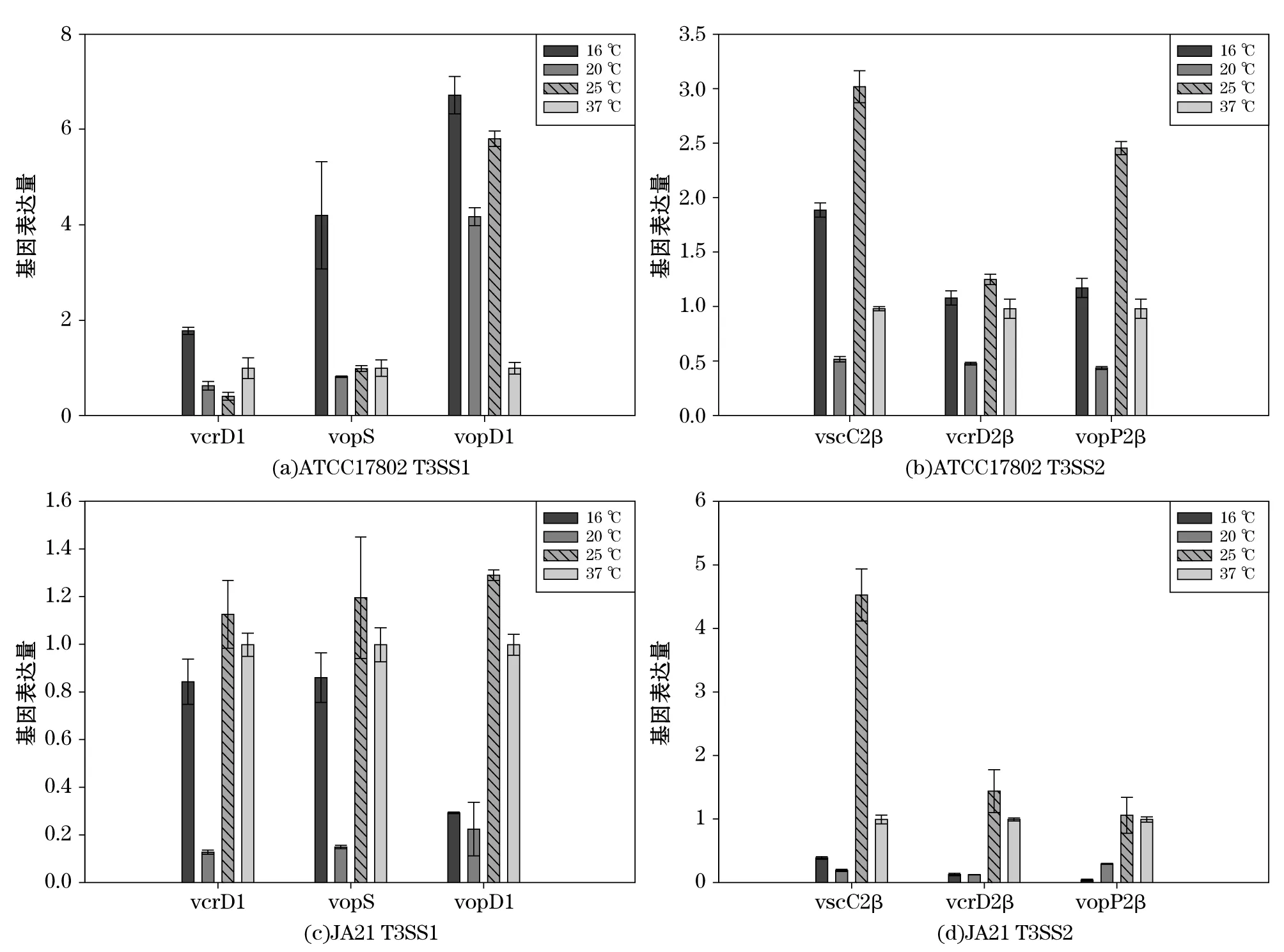
图1 副溶血弧菌在不同温度下T3SS基因的表达差异Fig.1 Differential expression of T3SS gene in V. parahaemolyticus cultured at different temperature
将2株副溶血弧菌ATCC17802和JA21分别接种于不同培养温度的2216E培养基中生长,比较T3SS基因的表达差异。实验结果表明(图1):副溶血弧菌ATCC17802的T3SS1基因在16 ℃表达量最高,其次是25 ℃;其中16 ℃时T3SS1内膜蛋白基因vcrD1的表达量是最低组的4.31倍,T3SS1转运蛋白基因vopD1的表达量最低组的5.11倍,T3SS1效应蛋白基因vopS的表达量是最低组的6.71倍;T3SS2基因在25 ℃表达量最高,其次是16 ℃;其中25 ℃时T3SS2内膜蛋白基因vcrD2β的表达量是最低组的2.61倍,T3SS2外膜蛋白基因vscC2β的表达量是最低组的5.80倍,T3SS2效应蛋白基因vopP2β的表达量是最低组的5.59倍;副溶血弧菌JA21的T3SS1基因和T3SS2基因均在25 ℃表达量最高,其次是37 ℃;其中25 ℃时T3SS1内膜蛋白基因vcrD1的表达量是最低组的1.34倍,T3SS1转运蛋白基因vopD1的表达量是最低组的5.72倍,T3SS1效应蛋白基因vopS的表达量是最低组的1.39倍;25 ℃时T3SS2编码内膜蛋白基因vcrD2β的表达量是最低组的11.02倍,T3SS2外膜蛋白基因vscC2β的表达量是最低组的22.75倍,T3SS2效应蛋白基因vopP2β的表达量是最低组的22.60倍。整体而言,2株副溶血弧菌T3SS基因均在20 ℃表达量最低。
2.2.2温度应激条件下副溶血弧菌T3SS基因表达差异
图2 副溶血弧菌从16 ℃转入37 ℃培养1, 2, 3和4 h后与培养温度为16 ℃和37 ℃条件下的T3SS基因表达差异Fig.2 Differential expression of T3SS gene in V. parahaemolyticus at 1, 2, 3和4 h after transporting from 16 ℃ to 37 ℃ compared with which cultured at temperature 16 ℃ and 37 ℃
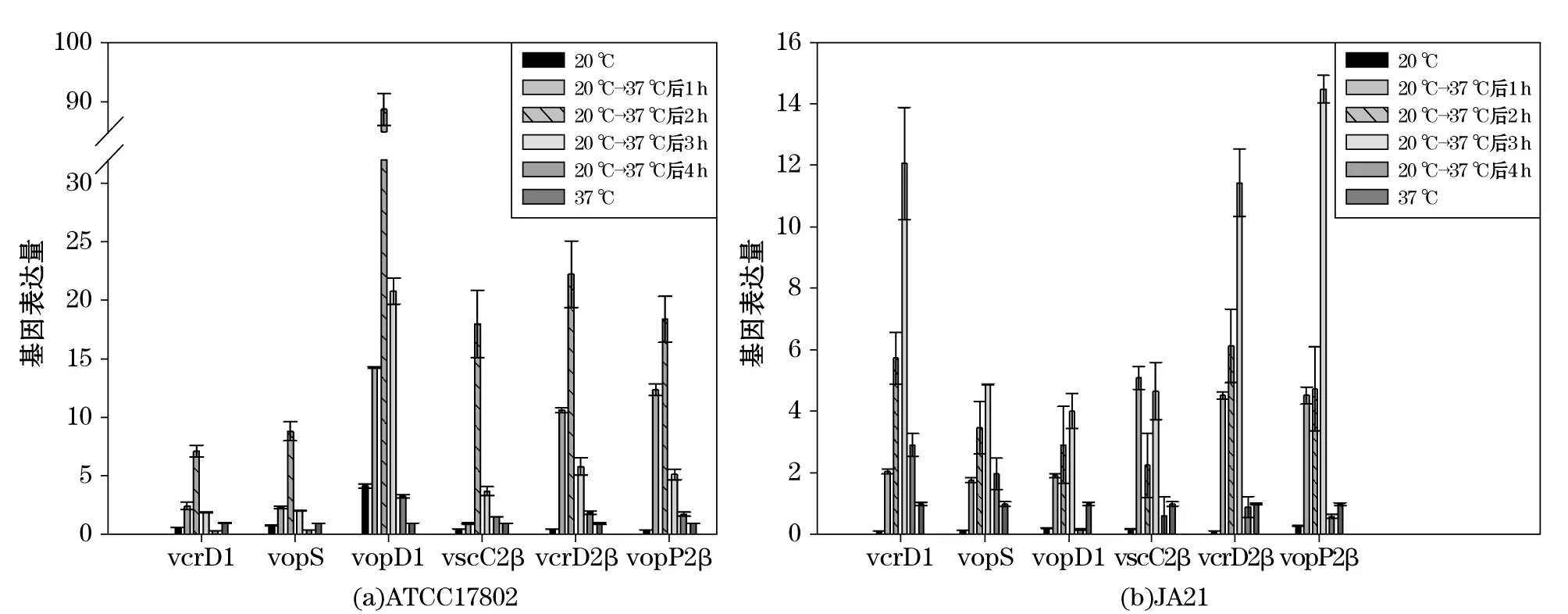
图3 副溶血弧菌从20 ℃转入37 ℃培养1, 2, 3和4 h后与培养温度为20 ℃和37 ℃条件下的T3SS基因表达差异Fig.3 Differential expression of T3SS gene in V. parahaemolyticus at 1, 2, 3和4 h after transporting from 20 ℃ to 37 ℃ compared with which cultured at temperature 20 ℃ and 37 ℃
如图2a所示,副溶血弧菌ATCC17802从培养温度16 ℃转入37 ℃后1 h,T3SS基因的表达量明显升高,除vopS外其它基因在2 h时达到最高值,然后表达量开始回落。其中,T3SS1转运蛋白基因vopD1的表达量是对照组(37 ℃)的157.97倍,远高于其他基因。除此之外5个T3SS基因在最高值处的变化范围是12.05~28.91倍,其中表达量变化最小的是T3SS2效应蛋白基因vopP2β,表达量变化最大的是T3SS2外膜蛋白基因vscC2β。
如图2b所示,副溶血弧菌JA21从培养温度16 ℃转入37 ℃后1 h,T3SS基因的表达量明显升高,且T3SS1基因表达量在2 h时达到最高值,T3SS2基因表达量在1 h时达到最高值,然后表达量开始回落。T3SS基因在最高值处的变化范围是2.74~17.91倍,其中表达量变化最小的是T3SS2效应蛋白基因vopP2β,表达量变化最大的是T3SS2外膜蛋白基因vscC2β。

图4 副溶血弧菌从25 ℃转入37 ℃培养1, 2, 3和4 h后与培养温度为25 ℃和37 ℃条件下的T3SS基因表达差异Fig.4 Differential expression of T3SS gene in V. parahaemolyticus at 1, 2, 3和4 h after transporting from 25 ℃ to 37 ℃ compared with which cultured at temperature 25 ℃ and 37 ℃
如图3a所示,副溶血弧菌ATCC17802从培养温度20 ℃转入37 ℃后1 h,T3SS基因的表达量明显升高,且在2 h时达到最高值,然后表达量开始回落。其中T3SS1转运蛋白基因vopD1的表达量是对照组(37 ℃)的88.74倍,远高于其他基因。除此之外5个T3SS基因在最高值处的变化范围是7.14~22.25倍,其中表达量变化最小的是T3SS1内膜蛋白基因vcrD1,表达量变化最大的是T3SS2内膜蛋白基因vcrD2β。
如图3b所示,副溶血弧菌JA21从培养温度20 ℃转入37 ℃后1 h,T3SS1基因和T3SS2基因的表达量明显升高,除vscC2β外在3 h时达到最高值,然后表达量开始回落。T3SS基因在最高值处的变化范围是4.01~14.47倍,其中表达量变化最小的是T3SS1转运蛋白基因vopD1,表达量变化最大的是T3SS2效应蛋白基因vopP2β。
如图4a所示,副溶血弧菌ATCC17802从培养温度25 ℃转入37 ℃后1 h,T3SS1基因和T3SS2基因的表达量明显升高,且在2 h时达到最高值,然后表达量开始回落。其中T3SS1转运蛋白基因vopD1的表达量是对照组(37 ℃)的71.71倍,远高于其他基因。除此之外5个T3SS基因在最高值处的变化范围是4.26~21.33倍,其中表达量变化最小的是T3SS1内膜蛋白基因vcrD1,表达量变化最大的是T3SS2内膜蛋白基因vcrD2β。
如图4b所示,副溶血弧菌JA21从培养温度25 ℃转入37 ℃后1 h,T3SS1基因和T3SS2基因的表达量明显升高,且在1 h达到最高值,然后表达量开始回落。T3SS基因在最高值处的变化范围是3.59~7.46倍,其中表达量变化最小的是T3SS2效应蛋白基因vopP2β,表达量变化最大的是T3SS2内膜蛋白基因vcrD2β。
由图2,3,4结果可见,2株副溶血弧菌从不同的培养温度转入到应激温度37 ℃后,T3SS基因的表达量明显升高,既高于在原本的培养温度时的表达量,也高于2株菌在培养温度为37 ℃时的表达,转入应激条件下的副溶血弧菌T3SS基因表现出显著的时间依赖性,表现为先升高后降低的趋势。
3讨论与分析
T3SS作为副溶血弧菌的主要毒力因子之一, 能传递与致病有关的毒性因子来发挥病原菌的毒性,而温度是影响细菌基因表达等生命活动的关键生态因子。
副溶血弧菌T3SS1主要贡献对宿主细胞的细胞毒性,介导宿主细胞的自体吞噬作用,最后导致细胞死亡。vcrD1编码的内膜蛋白是组成T3SS1分泌装置基体的一部分,在此基础上针管状结构蛋白才能继续生长。vopD1编码的转运蛋白功能是在宿主细胞的细胞膜表面形成孔洞,效应蛋白沿该通道进入宿主细胞内,此外还具有对HeLa细胞的毒性和接触溶血活性[23]。图1a、1c显示,副溶血弧菌ATCC17802和JA21的vcrD1和vopD1基因分别在16 ℃和25 ℃条件下表达量最高。转运蛋白vopD1的高表达量有利于T3SS分泌通道的完善,释放分泌蛋白,表现细菌毒性。vopS编码的效应蛋白可导致细胞变圆和通过抑制RhoB的鸟苷三磷酸酶导致肌动蛋白细胞骨架的崩溃,并且vopS可以使AMPylation 阻止Rho家族的鸟苷三磷酸酶与下游的效应蛋白反应,因此抑制受感染细胞内肌动蛋白的重排[17]。图1a 、1c显示,副溶血弧菌ATCC17802和JA21的vopS基因分别在16 ℃和25 ℃条件下表达量最高,暗示2株菌分别在16 ℃和25 ℃温度下,其相关毒素分泌较多。
上述实验结果表明副溶血弧菌ATCC17802、JA21在不同的环境温度下表现对宿主细胞不同的细胞毒性作用,即它们表现最强细胞毒性的温度不同。副溶血弧菌ATCC17802和JA21的T3SS1分别在16 ℃和25 ℃表达量最高,二者的差异可能是由于菌株来源不同,菌株宿主的生存环境温度有所差异,造成了温度调控的多样性。吕远志[24]在研究迟缓爱德华氏菌的双组份系统的毒力调控机制中发现,在相同的温度条件下,不同来源的2株菌的T3SS转运蛋白EseBCD的分泌量差异很大,实验现象与本实验相似。Zhou等[25]研究表明副溶血弧菌T3SS1主要受exsACDE操纵子的调控,在诱导条件下ExsA蛋白促进T3SS1介导的细胞毒性的表达,而ExsD可以结合ExsA从而阻断其对T3SS1表达的促进作用,ExsC结合ExsD 释放ExsA, 从而促进T3SS1的表达。Kodama等[26]研究证明,H-NS蛋白能够通过抑制exsA基因的表达来调控T3SS1的表达,而H-NS蛋白能够响应环境刺激对许多系统起调控作用,因此温度对副溶血弧菌T3SS1表达的影响是否与H-NS蛋白和exsACDE操纵子响应环境温度有关及其响应机制仍需进一步验证。
副溶血弧菌T3SS2位于染色体2的毒力岛上,具有肠毒性,在感染过程中发挥重要作用。vcrD2β和vscC2β分别编码T3SS2内膜蛋白和外膜蛋白,这2种蛋白是组成T3SS2分泌装置基体的一部分。图1b、1d显示,副溶血弧菌ATCC17802和JA21的vscC2β、vcrD2β基因都是在25 ℃表达量最高,暗示在25 ℃条件下,副溶血弧菌T3SS2的基底装置部分组装最多。vopP2β编码的效应蛋白能活化激酶催化环结构中保守的赖氨酸乙酰化,阻止ATP的结合,最终组织激酶的磷酸化[19]。图1d显示JA21的vopP2β基因在25 ℃和37 ℃条件下表达量远高于16 ℃和20 ℃,提示副溶血弧菌JA21的T3SS2的效应蛋白基因可能在高温环境下表达量高,在低温环境下表达量低。图1b、1d显示,副溶血弧菌ATCC17802和JA21的 vopP2β基因都在25 ℃下表达量最高,暗示在该温度下T3SS2分泌的毒力因子最多。由效应蛋白的功能描述可知,副溶血弧菌的T3SS2能够破坏肠道组织,诱导腹泻,并且具有一定的细胞毒性,是发挥感染作用的重要毒力因子。本文研究显示,在25 ℃下,2株副溶血弧菌的T3SS2表达量均最高;而且陈星等[27]研究表明,副溶血弧菌耐热直接溶血素基因tdh也在25 ℃表达量最高,溶血活性最强;由此暗示此温度下,养殖环境中的副溶血弧菌对受感染宿主有较强的致病性。
本实验还研究了副溶血弧菌从不同培养温度转入人体温度37 ℃培养1, 2, 3和4 h后T3SS基因的表达差异。实验结果如2.2.2所示,2株副溶血弧菌从不同的培养温度转入到应激温度37 ℃后,T3SS基因的表达量明显升高,其中副溶血弧菌ATCC17802从不同培养温度转入37 ℃后2 h,vopD1的表达量升高异常显著。vopD1是T3SS1的转运蛋白,在形成T3SS1的早期阶段,细菌只具备横跨膜的环状基底部分和在此基础上突出的针管状装置,当细菌与宿主细胞接触后,T3SS1通过针管状通道输出转运蛋白安装到针管结构的顶端,转运蛋白在靶细胞膜上形成孔洞,效应蛋白通过孔洞进入宿主细胞[28]。副溶血弧菌ATCC17802的vopD1表达量的大量升高,可能是由于温度应激条件能诱导副溶血弧菌释放转运蛋白,完善分泌通道,释放分泌蛋白。
应激条件下2株菌T3SS基因的表达表现出显著的时间依赖性,表现为先升高后降低的趋势,4 h后T3SS表达量明显降低,由于37 ℃是模拟人体温度,可以猜测副溶血弧菌被误食进入人体后,前3 h T3SS的表达量是最高的,即副溶血弧菌分泌的毒素较多,随后T3SS基因表达量降低。比较2株副溶血弧菌转入37 ℃后T3SS基因表达量的变化,可以发现,ATCC17802的T3SS基因表达量变化显著高于JA21,说明ATCC17802对温度变化的反应更强烈,应激条件下毒力因子基因表达增加显著。
苑淑宾,朱爱贵[28]认为,条件致病菌一般情况下不会引起养殖动物发生病害,但一些环境因子,例如温度、盐度等均可以调控其致病性相关蛋白的表达,从而影响细菌的致病性[29]。庞欢瑛等[15]对溶藻弧菌T3SS的转运蛋白vscO基因的表达差异进行了研究,结果显示vscO基因在28 ℃时表达量最高。这与本研究中副溶血弧菌17802和JA21的T3SS在25 ℃表达量最高相似。Rao等[12]认为,迟缓爱德华氏菌在感染过程中经历了由环境温度到宿主温度的变化,T3SS的表达相应的受到温度的调控, 实验结果表明在28 ℃条件下,T3SS的转运蛋白表达最高,而在20 ℃条件下,没有检测到T3SS转运蛋白的表达, 说明迟缓爱德华氏菌T3SS的转运蛋白表达量在不同培养温度下有较大差异,这与本研究中副溶血弧菌的T3SS基因在不同培养温度下表达差异显著的现象一致。
探究环境因素对副溶血弧菌致病力的影响,将有助于揭示副溶血弧菌的致病规律。综上研究,温度的变化对副溶血弧菌T3SS基因的表达具有显著的影响,但是不同的基因对温度的响应不同。由副溶血弧菌全基因组测序表明[7],副溶血弧菌的基因结构与耶尔森氏菌相似,已有文献显示耶尔森菌的T3SS具有多个操纵子[30],副溶血弧菌T3SS基因对温度不同的响应特性是否根源于不同基因受不同的操纵子调控有待进一步的验证。
参考文献(References):
[1]SU Y C, LIU C.Vibrioparahaemolyticus: a concern of seafood safety[J]. Food Microbiology, 2007, 24(6): 549-558.
[2]YU Y, WU B B, FANG W H. Type III secretion system ofVibrioparahaemolyticus-A review[J]. Acta Microbiologica Sinica, 2009,49(7) : 848-852. 俞盈, 吴蓓蓓, 方维焕. 副溶血弧菌的III型分泌系统[J]. 微生物学报, 2009,49(7): 848-852.
[3]YEUNG P M, BOOR K J. Epidemiology, pathogenesis, and prevention of foodborneVibrioparahaemolyticusinfections[J]. Foodborne Pathogens & Disease, 2004, 1(2): 74-88.
[4]LIU X, CHEN Y, WANG X, et al. Foodborne disease outbreaks in China from 1992 to 2001 national foodborne disease surveillance system[J]. Journal of Hygiene Research, 2004, 33(6): 725-727.
[5]BURDETTE D L, YARBROUGH M L, ORVEDAHL A, et al.Vibrioparahaemolyticusorchestrates a multifaceted host cell infection by induction of autophagy, cell rounding, and then cell lysis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(34): 12497-12502.
[6]HAM H, ORTH K. The role of type III secretion system 2 inVibrioparahaemolyticuspathogenicity[J]. Journal of Microbiology, 2012, 50(5): 719-725.
[7]TAGOMORI K, IIDA T, HONDA T. Comparison of genome structures of vibrios, bacteria possessing two chromosomes[J]. Journal of Bacteriology, 2002, 184(16): 4351-4358.
[8]MAKINO K, OSHIMA K, KUROKAWA K, et al. Genome sequence ofVibrioparahaemolyticus: a pathogenic mechanism distinct from that ofV.cholerae[J]. The Lancet, 2003, 361(9359): 743-749.
[9]DING X Y, ZHU P F, WANG M Q, et al. Research progress of Type III secretion system in common mariculture Gram-negative pathogenic bacterium[J]. Journal of Anhui Agricultural Sciences, 2015, 13:156-161,172. 丁晓燕,朱鹏飞,王敏强,等. 海水常见革兰氏阴性病原菌III型分泌系统的研究进展[J]. 安徽农业科学, 2015, 13:156-161,172.
[10]CHEN B Z, WANG Z L, ZHU M Y, et al. Effect of temperature and salinity on growth of prorocentrum dentatum and comparisons between growths of prorocentrum dentatum and skeletonema costatum[J]. Advances in Marine Science, 2005, 23(1): 60-64. 陈炳章, 王宗灵, 朱明远,等. 温度, 盐度对具齿原甲藻生长的影响及其与中肋骨条藻的比较[J]. 海洋科学进展, 2005, 23(1): 60-64.
[11]DOU J J, WANG Y, SUN Y, et al. Effect of temperature and salinity on plasma marine of arctic sea-ice bacteria[J]. Advances in Marine Science, 2013, 31(2): 229-236. 窦京娇, 王燕, 孙岳,等. 温盐变化对北极海冰细菌质膜的影响研究[J]. 海洋科学进展, 2013, 31(2): 229-236.
[12]HOE N P, GOGVEN J D. Temperature sensing in Versinia pestis: translation of the LerF activator protein is thermally regulated[J].Journal of Bacteriol, 1993, 175(24): 7901-7909.
[13]RAO P S, YAMADA Y, TAN Y P, et al. Use of proteomics to identify novel virulence determinants that are required for Edwardsiella tarda pathogenesis[J]. Molecular Microbiology, 2004, 53(2): 573-586.
[14]VILCHES S, JIMENEZ N, TOMAS J M, et al. Aeromonas hydrophila AH-3 type III secretion system expression and regulatory network[J]. Applied Environmental Microbiology, 2009, 75(19): 6382-6392.
[15]PANG H Y, ZHOU Z J, DING J, et al. Different expressions of vscO gene fromVibrioAlginolyticusin different environments[J].Journal of Jishou University:Natural Sciences Edition, 2014,4:59-63. 庞欢瑛,周泽军,丁燏,等. 溶藻弧菌vscO基因在不同环境下的表达差异[J]. 吉首大学学报:自然科学版,2014,4:59-63.
[16]PARK K S, ONO T, ROKUDA M, et al. Functional characterization of two type III secretion systems ofVibrioparahaemolyticus[J].Infection and Immunity, 2004, 72(11): 6659-6665.
[17]YARBROUGH M L, LI Y, KINCH L N, et al. AMPylation of Rho GTPases byVibrioVopS disrupts effector binding and downstream signaling[J]. Science, 2009, 323(5911): 269-272.
[18]SHIMOHATA T, MAWATARI K, IBA H, et al. VopB1 and VopD1 are essential for translocation of type III secretion system 1 effectors ofVibrioparahaemolyticus[J].Canadian Journal of Microbiology, 2012, 58(8): 1002-1007.
[19]TROSKY J E, LI Y, MUKHERJEE S, et al. VopA inhibits ATP binding by acetylating the catalytic loop of MAPK kinases[J].The Journal of Biological Chemictry, 2007, 282(47): 34299-34305.
[20]COUTARD F, LOZACH S, POMMEPUY M, et al. Real-time reverse transcription-PCR for transcriptional expression analysis of virulence and housekeeping genes in viable but nonculturableVibrioparahaemolyticusafter recovery of culturability[J]. Applied and Environmental Microbiology, 2007, 73(16): 5183-5189.
[21]SHEN P. Microbiology experiment[M]. Beijing:China Higher Education Press,2007. 沈萍. 微生物学实验[M]. 北京:高等教育出版社, 2007.
[22]ZHAO G Y, SHEN K M, LI J R. Improving enrichment M edium and culture condi tions in bacteriumVibrioparahaemolyticus[J]. Fisheries Science, 2010, 29(3): 137-141. 赵广英, 申科敏, 励建荣. 副溶血性弧菌增菌培养基及培养条件的改进[J]. 水产科学, 2010, 29(3): 137-141.
[23]ONO T, PARK K S, UETA M, et al. Identification of proteins secreted viaVibrioparahaemolyticustype III secretion system 1[J]. Infection and Immunity, 2006, 74(2): 1032-1042.
[24]LV Y Z. Virulence regulation by two-component systems in edwardsiella tarda[D].Shanghai:East China University of Science and Technology,2013. 吕远志. 迟钝爱德华氏菌双组分系统的毒力调控机制[D].上海:华东理工大学, 2013.
[25]ZHOU X, KONKEL M E, CALL D R. Regulation of type III secretion system 1 gene expression inVibrioparahaemolyticusis dependent on interactions between ExsA, ExsC, and ExsD[J]. Virulence, 2010, 1(4): 260-272.
[26]KODAMA T, YAMAZAKI C, PARK K S, et al. Transcription ofVibrioparahaemolyticusT3SS1 genes is regulated by a dual regulation system consisting of the ExsACDE regulatory cascade and H-NS[J]. FEMS Microbiology letters, 2010, 311(1): 10-7.
[27]CHEN X, PAN Y J, SUN X H, et al. Detection of tlh and tdh expression differences inVibrioparahaemolyticusby real-time quantitative PCR[J]. Microbiology China, 2011, 38(7): 1077-1083. 陈星, 潘迎捷, 孙晓红, 等. 荧光定量 PCR 法检测副溶血弧菌 tlh 和 tdh 基因的表达差异[J]. 微生物学通报, 2011, 38(7): 1077-1083.
[28]DEANE J E, ABRUSCI P, JOHNSON S, et al. Timing is everything: the regulation of type III secretion[J].Cellular and Molecular Life Sciences, 2010, 67(7): 1065-1075.
[29]YUAN S B, ZHU A Y. Progress on pathogenicity research onVibrioalginolyticusto aquatic products[J]. Journal of Zhejiang Ocean University:Natural Science, 2012, 31(3): 256-264. 苑淑宾, 朱爱意. 溶藻弧菌对水产动物致病性及其防治的研究进展[J]. 浙江海洋学院学报: 自然科学版, 2012, 31(3): 256-264.
[30]CORNELIS G R, BOLAND A, BOYD A P, et al. The virulence plasmid of Yersinia, an antihost genome[J]. Microbiology and Molecular Biology Reviews, 1998, 62(4): 1315-1352.
Received: September 9, 2015
*收稿日期:2015-09-09
作者简介:丁晓燕(1990-),女,山东青岛人,硕士研究生.主要从事海洋微生物分子生物学方面研究.E-mail:dingxiaoyan1010@163.com *通讯作者:曲凌云(1975-),女,山东荣成人,研究员,博士,硕士生导师,主要从事海洋微生物和海洋分子生物学以及海水养殖动物病原微生物学方面研究.E-mail:qly@fio.org.cn(王佳实编辑)
中图分类号:X834
文献标识码:A
文章编号:1671-6647(2016)02-0250-10
doi:10.3969/j.issn.1671-6647.2016.02.010
Effect of Temperature on T3SS Gene Expression ofVibrioparahaemolyticus
DING Xiao-yan1,2, QU Ling-yun2,3, WANG Chen1,2, TIAN Xin-xin2,SUN Cheng-jun2, WANG Min-qiang1
(1.CollegeofLifeSciences,YantaiUniversity, Yantai 264005, China;2.TheFirstInstituteofOceanography,SOA, Qingdao 266061, China;3.NationalLaboratoryforMarineScienceandTechnology,FunctionLaboratoryforMarineFisheriesScienceandFoodProductionProcesses,Qingdao 266237, China)
Abstract:T3SS (Type III secretion system) is one of the major virulence factors of Vibrio parahaemolyticus, which could deliver pathogenic virulence factors or effectors to eukaryotic host cells, and temperature is one of the key ecological factors which could influence gene expression. We can compare the virulence of strains which in different culture temperature and stress conditionsby comparing the expression level of T3SS genes, including vcrD1, vopS, vopD1, vscC2β, vcrD2β, vopP2β, which encode T3SS1 inner membrane protein, T3SS1 effector, T3SS1 translocator, T3SS2 outer membrane protein, T3SS2 inner membrane protein and T3SS2 effector, respectively. In this paper, we extracted total RNA from two kinds of Vibrio parahaemolyticus ATCC17802 and JA21 cultured under different temperature and stress condition. By means of established fluorescence quantitative RT-PCR method which using pvuA as the internal standard gene and the ΔΔCt method as the calculation method,the transcription changes of the T3SS mRNA were studied. The results showed that in V. parahaemolyticus 17802, T3SS1 exhibited highest expression at 16℃ while T3SS2 exhibited highest expression at 25℃. In V. parahaemolyticus JA21, both T3SS1 and T3SS2 exhibited highest expression at 25℃. The expression level of T3SS of the 2 strains V. parahaemolyticus changed over time in response to stress condition, and were significantly increased compared to control group at 1h after transporting from culture temperature into stress condition. After the peak point, the expression level dropped down. This research provides a scientific basis for the study of the relationship between the environmental factors and the pathogenicity of Vibrio parahaemolyticus.
Key words:V. parahaemolyticus; T3SS; RT-PCR; gene expression
资助项目:国家科技支撑计划项目——海洋水产病害实用化检测及预警技术的建立与应用(2012BAD17B01);青岛海洋科学与技术国家实验室鳌山科技创新计划项目——近海健康养殖关键技术研究与新生产模式构建(2015ASKJ02-03);海洋公益性行业科研专项——重要鱼类增养殖区致病细菌基因芯片检测技术研究开发与示范(201105007-1);山东省自主创新及成果转化专项——重要水产养殖病害防治替代产品(2014ZZCX06205);泰山学者海外人才项目

