消油剂处理180#燃料油对黄海胆(GlyptocidarisCrenularis)抗氧化酶系统影响的初步探究*
殷 悦,熊德琪,张欣欣,何 山,段美娜,吕昕璐
(大连海事大学 环境科学与工程学院,辽宁 大连 116026)
消油剂处理180#燃料油对黄海胆(GlyptocidarisCrenularis)抗氧化酶系统影响的初步探究*
殷悦,熊德琪*,张欣欣,何山,段美娜,吕昕璐
(大连海事大学 环境科学与工程学院,辽宁 大连 116026)
摘要:本文研究了180#燃料油分散液(Water-Accomodated Fractions, WAFs)和乳化液(Chemical Enhanced Water-Accomodated Fractions, CEWAFs)对黄海胆(Glyptocidaris Crenularis)肠和性腺组织抗氧化酶系统的毒性影响。将黄海胆暴露在不同质量浓度的WAFs和CEWAFs中,96 h后提取其肠和性腺,测定暴露期抗氧化系统各酶的活性;再用海水培养,7 d后进行恢复期抗氧化酶活性测定。研究结果显示,WAFs和CEWAFs对抗氧化酶活性均呈现先诱导后抑制效应,暴露期海胆肠组织的过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽巯基转移酶(GST)和谷胱甘肽(GSH)在WAFs中的最大诱导率分别为40.21%,46.03%,26.01%,23.89%;在CEWAFs中的最大诱导率分别为38.60%,48.83%,29.34%,27.86%。实验组性腺组织抗氧化酶活性最大诱导率均高于肠组织,且恢复期与暴露期规律基本一致。由此可知,黄海胆性腺组织较肠组织对石油烃更为敏感。通过对比可以得出海胆CAT、SOD对石油烃污染的敏感度更高,更适合作为监测海洋石油烃污染的生物标志物。对照组间差异不明显,说明消油剂本身对生物无明显急性毒性效应。
关键词:消油剂;180#燃料油;黄海胆;抗氧化酶系;酶活性
随着全球一体化的趋势日益推进,我国对外经贸往来也更加频繁,并且由于水路运输凭借费用低、运输距离长、运输吨位大等优势成为主要运输方式,故沿海地区船运事业蓬勃发展,船用燃料油已然占据燃料油市场的主导地位[1-4]。船用燃料油主要由石油的裂化残渣油和直馏残渣油制成,主要成分含有非烃化合物、胶质、沥青质等[5]。本实验所用的180#燃料油,粘度大热值高,化学性质稳定不易降解。当其聚集于深层海域,就会污染海洋生态环境,破坏底栖生物结构,从而给渔业带来不利影响[6]。目前,虽已研发出消油剂来清理海面上的油污,但其给海洋生物带来的危害也是不容忽视的[7-8]。Hannah等[9]以蓝蟹幼体作为受试生物,研究了消油剂对其急性毒性效应,结果表明随着消油剂质量浓度增加蓝蟹幼体活动灵活性下降。E. Cotou等[10]通过消油剂对生长期卤虫无节幼体的三磷酸腺苷酶促系统毒性作用研究,发现了消油剂对生物的毒性效应。Gong等[11],Etkinds[12],Lessard和Demarlog[13],Xia等[14]研究表明,消油剂是由表面活性剂及含有大量多环芳烃等毒性极强的有机溶剂和助剂组成,故其不仅不能彻底清除油污而且会造成二次污染。
目前,已有大量关于石油烃对海洋中藻类、浮游微生物、鱼类、甲壳类等海洋生物的毒性效应影响研究[15-20]。国内外很多学者对抗氧化酶防御系统的研究表明,生物体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽转硫酶(GST)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽含量(GSH)等活性(含量)升高或降低程度往往与机体受毒性影响程度有着一定关系[21-25]。因此,抗氧化酶系统的活性被作为生物毒理研究的重要指标,对它的测定也是判断环境污染的警示性手段。本文选用180#燃料油和GM-2型消油剂对黄海胆(GlyptocidarisCrenularis)进行急性毒理实验,测定其SOD,CAT,GST酶活性和GSH含量,为海洋溢油污染对底栖生物的影响评估提供实验基础和参考依据。
1材料与方法
1.1实验材料
1.1.1受试生物
本实验选用将黄海胆(GlyptocidarisCrenularis)置于室温(13±2) ℃、盐度31.4的实验室养3个月后,选择生理性状正常、反应敏捷、状态健康、大小一致的海胆进行实验。实验用海胆直径(5±0.2) cm左右、体重(57.4±3.2) g、30个月龄左右。
1.1.2受试油品
本实验选用180#船用燃料油作为受试油品,黏度大,在50 ℃时其运动黏度小于180,热值高,含有大量的非烃化物、胶质和沥青质,由大连船舶燃料公司提供。
本实验选用GM-2型消油剂作为实验消油剂,购自青岛光明环保技术有限公司。
1.1.3实验仪器
JY92-Ⅱ型细胞破碎仪、微型离心机(Beckman Microfuge 18)、冷冻台式离心机(Thermo Fisher)、酶标仪、基因研究型超纯水机(FJY2002-UVF-P)、DK-8D型电热恒温水浴锅、FA1004型电子天平、JDS-109U红外测油仪、JB-3型磁力搅拌器、Beckman J2-MC型高速冷冻离心机、HH-S水浴锅等。
1.1.4实验试剂
无水乙醇(分析纯)、考马斯亮蓝蛋白测定试剂盒(购自南京建成生物工程研究所)、抗氧化酶活性测试试剂盒(购自南京建成生物工程研究所)、NaCl(分析纯)、CCl4(红外测油专用)等。
1.2受试液制备
1.2.1180#燃料油WAFs(Water-Accomodated Fractions)的制备
将180#燃料油与过滤海水按一定质量体积比例混合,置于2 L烧杯中封口避光,磁力搅伴器低速揽拌24 h,控制漩涡高度为总体系高度的25%~30%。静置6 h后,分离下层水相即为WAF母液。将母液置于4 ℃环境中避光保存,实验前稀释至所需浓度。
1.2.2180#燃料油CEWAFs(Chemical Enhanced Water-Accomodated Fractions)的制备
将180#燃料油与过滤海水按一定的质量体积比混合,并加入油品质量20%的消油剂,揽拌24 h后静置6 h,分离下层水相即为CEWAFs母液,置于4 ℃环境中避光保存备用。
以上受试液制备均为预实验所用,油水配比浓度可按实验具体要求改变。
1.2.3消油剂空白对照组受试液制备
在2 L海水中加入油品质量20%的GM-2型消油剂,按照上述方法与上述2种受试液一同搅拌24 h后,静置6 h,分离下层水相,置于4 ℃环境中避光贮存待用。
1.2.4实验浓度梯度设定
根据预实验测得的96 h-EC50值为实验组的WAFs组和CEWAFs组设置5个质量浓度梯度,分别用红外测油仪测出其实际质量浓度(表1)。

表1 质量浓度梯度设定
1.3实验方法
1.3.1暴露实验
暴露期分为实验组和对照组。实验组包括WAFs组和CEWAFs组,将18只黄海胆置于32 cm×16.5 cm×24 cm玻璃缸中,暴露在根据预实验所设定的0.312 5,0.625,1.25,2.5和5 g/L五组质量浓度WAFs和CEWAFs(总体积为2 L)中培养。对照组为海水空白对照和消油剂空白对照,按照最佳分散比例,消油剂对照组受试液2 L海水中加入2 g消油剂;海水对照组即受试液仅为2 L海水。进行24 h更换一次受试液的半静态暴露,96 h后,从容器中随机选取3只海胆用于实验。
1.3.2恢复实验
暴露期后只用2 L海水培养,24 h换1次水,7 d后按上述方法进行实验。
1.3.3样品预处理
取各实验组及对照组中海胆部分肠和性腺组织,在4 ℃生理盐水(0.86%)中漂洗,用滤纸拭干后,置于10 mL小烧杯中,称重并记录。向小烧杯中加入2/3体积的质量为组织样品9倍的生理盐水,用医用剪刀尽快剪碎组织,整个过程应将小烧杯置于冰水中进行。
将超声粉碎机的电流调至400A,超声时间为5 s/次,间隔10 s,重复5次,即得到组织匀浆。
将制备好的10%组织匀浆用低温高速离心机在4 ℃、转速为2 000 r/min条件下离心10 min,取上清液用于后续实验。
1.3.4酶活性测定
蛋白含量测定需按照考马斯亮蓝试剂盒说明书进行操作。
抗氧化酶活性的测定参照SOD,CAT,GSH-Px,GST试剂盒说明书进行。
1.4数据处理
诱导率计算公式:
诱导率=(Ni-N)/N×100%,
(1)
式中,Ni为实验组受诱导后酶活性(含量);N为对照组酶活性(含量)。
各酶活性的计算公式均根据试剂盒内说明书进行计算。实验结果数据采用SPSS 19.0数据分析软件,对数据进行单因素方差分析。当0.01≤p≤0.05时认为差异显著,p≤0.01时认为差异极显著。
2结果与分析
2.1暴露期黄海胆体内酶活性变化
暴露在油水配比质量浓度分别为0.312 5,0.625,1.25,2.5和5 g/L的燃料油WAFs和CEWAFs中96 h的黄海胆,其肠和性腺组织中CAT、SOD、GST酶活性及GSH含量不仅实验组与对照组差异显著,而且各实验组间亦存在显著差异,图1~图4可清晰反映出2种暴露液对黄海胆肠和性腺组织中抗氧化酶活性的影响。
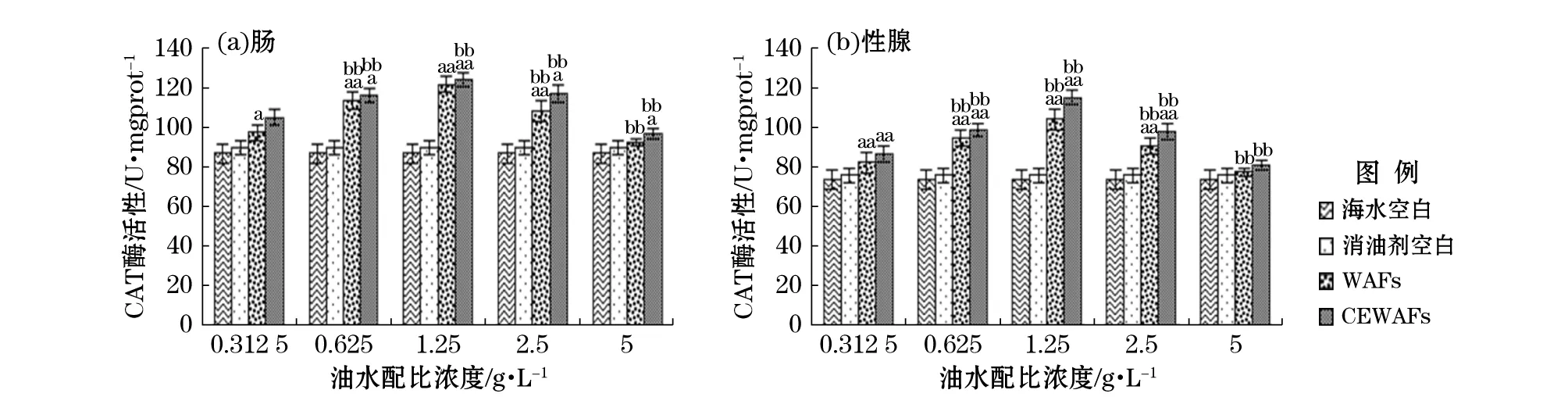
注:U/mgprot中U为酶活性单位,mgprot为毫克蛋白,表示每毫克蛋白中酶活性大小;“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图1 暴露期WAFs和CEWAFs对黄海胆肠和性腺的CAT酶活性影响Fig.1 Effect of WAFs and CEWAFs on CAT activity of G. Crenularis in intestine and gonad during the exposure period
由图1可知,黄海胆经不同质量浓度的WAFs和CEWAFs暴露96 h后,其肠和性腺组织的CAT酶活性变化趋势大致相同,均先升高后降低。质量浓度为0.625 g/L到1.25 g/L时实验组与对照组存在显著差异,说明暴露液对CAT酶活性诱导作用显著。当油水配比质量浓度为1.25 g/L时,肠和性腺的CAT酶活性达到最大诱导值,即在WAFs和CEWAFs中分别为120.72,103.19 U/mgprot和123.02,114.14 U/mgprot。
注:U/mgprot中U为酶活性单位,mgprot为毫克蛋白,表示每毫克蛋白中酶活性大小;“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图2 暴露期WAFs和CEWAFs对黄海胆肠和性腺的SOD酶活性影响Fig.2 Effect of WAFs and CEWAFs on SOD activity of G. Crenularis in intestine and gonad during exposure period
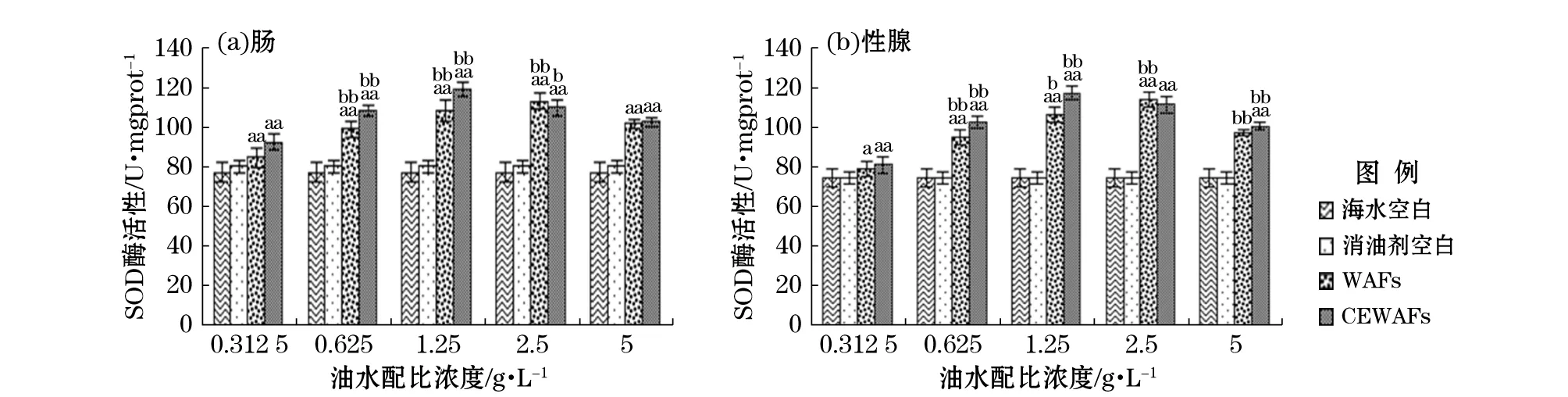
由图2可知,实验组肠和性腺组织SOD酶活性明显高于对照组,说明WAFs和CEWAFs对SOD显著诱导。而酶活性总体呈现先增大后减小趋势,说明一定质量浓度时诱导作用减弱,出现抑制效应。WAFs组油水配比质量浓度为2.5 g/L时,SOD酶活性出现最大诱导值,肠为113.06 U/mgprot、性腺为113.67 U/mgprot;而CEWAFs组,油水配比质量浓度为1.25 g/L时,SOD酶活性达到最大诱导值,肠和性腺分别为119.57,116.95 U/mgprot。
注:U/mgprot中U为酶活性单位,mgprot为毫克蛋白,表示毫克蛋白中酶活性大小;“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图3 暴露过程中WAFs和CEWAFs对黄海胆肠和性腺的GST酶活性影响Fig.3 Effect of WAFs and CEWAFs on GST activity of G. Crenularis in intestine and gonad during the exposure period
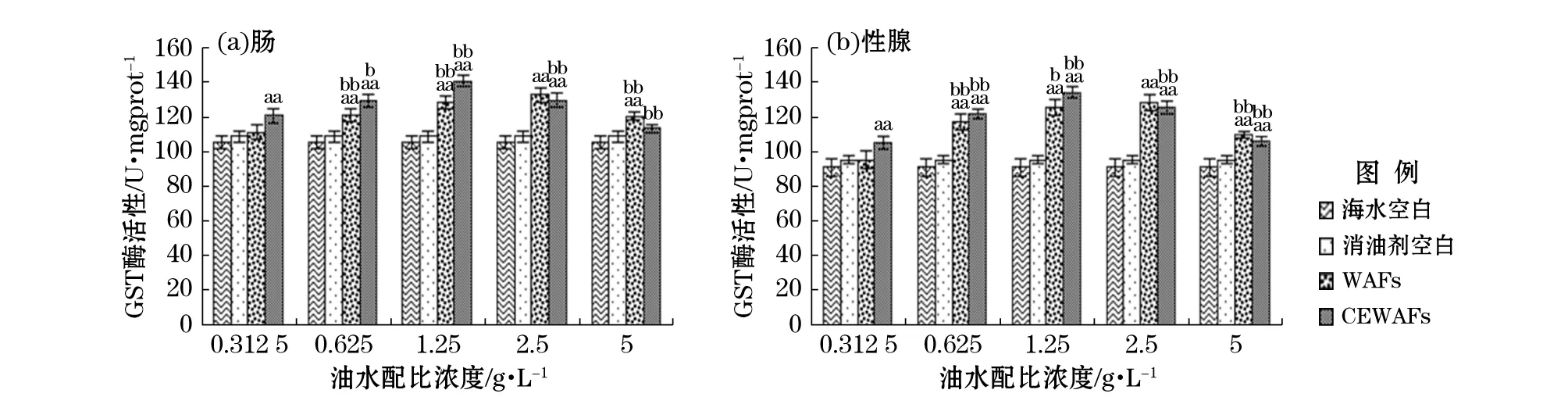
由图3可知,暴露期黄海胆肠和性腺组织的GST酶活性均随着WAFs和CEWAFs质量浓度的升高先增大后减小。当油水配比质量浓度0.312 5 g/L时各组织GST酶活性均WAFs组低于CEWAFs组,说明此质量浓度时CEWAFs组对GST酶活性诱导强度大于WAFs。而油水配比质量浓度5 g/L时,情况则相反。当油水配比浓度为2.5 g/L时,暴露在WAFs中的海胆肠和性腺中GST酶活性均最大,即最大诱导值为127.82,128.46 U/mgprot;而油水配比浓度为1.25 g/L时,CEWAFs中海胆肠和性腺中GST酶活性均最大,最大诱导值为140.19,134.13 U/mgprot。

注:“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图4 暴露期WAFs和CEWAFs对黄海胆肠和性腺的GSH含量影响Fig.4 Effect of WAFs and CEWAFs on GSH content of G. Crenularis in intestine andgonad during the exposure periodd
由图4可知,当油水配比质量浓度为0.312 5 g/L时,肠和性腺组织中GSH含量均略有上升,说明2种暴露液对GSH酶含量的诱导作用较弱。随着油水配比质量浓度的升高,GSH含量增加,说明2种受试液对GSH酶活性诱导效应增强。达到最大值后酶活下降,发生抑制作用。当油水配比质量浓度为1.25 g/L时,暴露在WAFs和CEWAFs中的黄海胆肠和性腺GSH含量均达到最大诱导值,即肠中分别为178.67,191.03 μmol/L,性腺中分别为170.81,187.97 μmol/L。而且相邻浓度组之间基本上存在极显著差异。
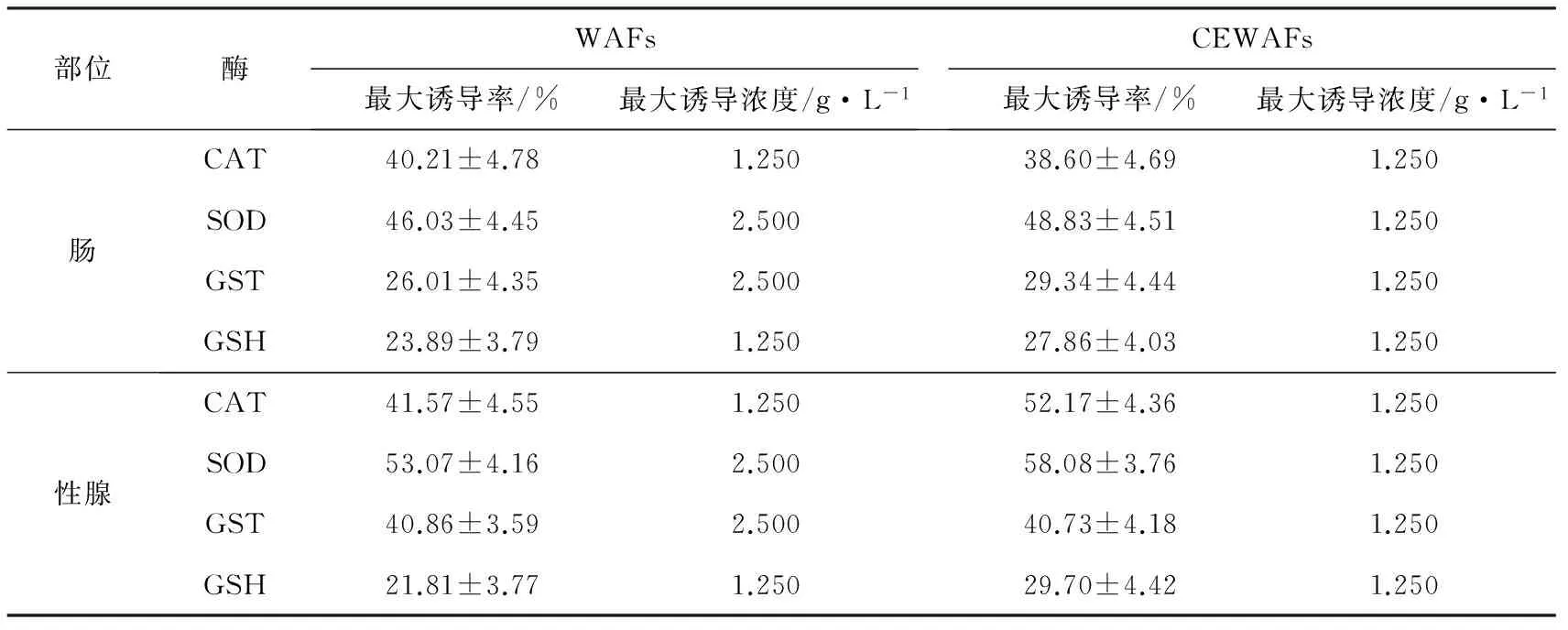
表2 暴露期WAFs与CEWAFs对黄海胆抗氧化酶活性诱导效应的比较
由表2可见,WAFs组油水配比质量浓度为2.5 g/L时,肠和性腺组织中的SOD和GST均达到最大诱导率,即该质量浓度对SOD和GST酶活性诱导作用最强;而CEWAFs组油水配比质量浓度在1.25 g/L时对CAT,SOD,GST,GSH酶活性诱导强度最大。从最大诱导率来看,无论是肠还是性腺,SOD和CAT均为最大,可以说明二者对暴露液的诱导作用敏感度最高。
2.2恢复期黄海胆体内酶活性变化
经过7 d恢复期,海胆肠和性腺中CAT,SOD和GST酶活性和GSH含量变化趋势与暴露期大体一致,如图5~图8。
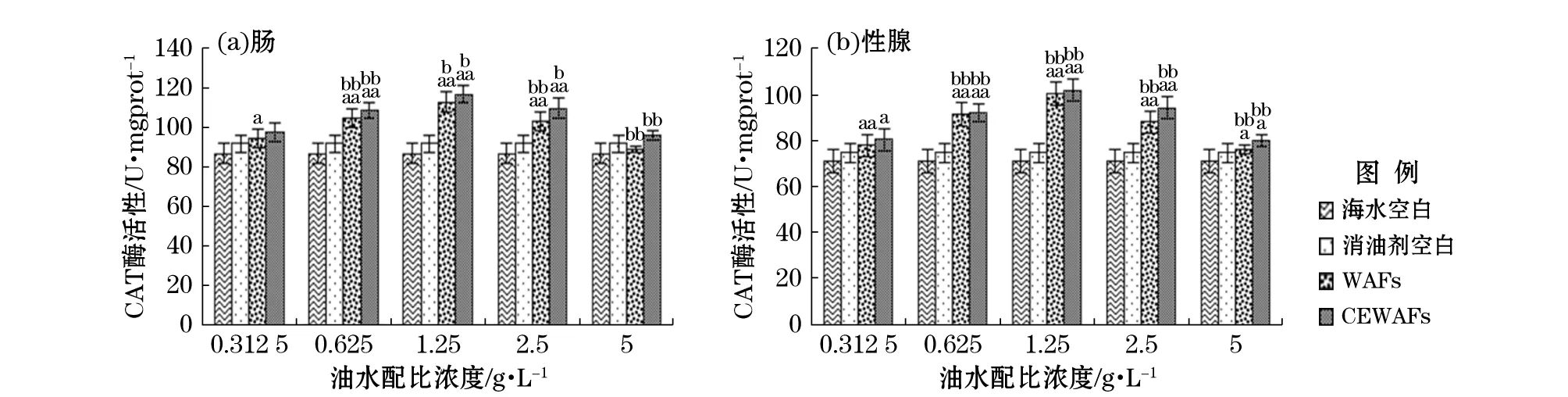
注:U/mgprot中U为酶活性单位,mgprot为毫克蛋白,表示每毫克蛋白中酶活性大小;“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图5 恢复期WAFs和CEWAFs对黄海胆肠和性腺的CAT酶活性影响Fig.5 Effect of WAFs and CEWAFs on CAT activity of G. Crenularis in intestine and gonad during the recovery period
由图5可见,恢复期的黄海胆肠和性腺组织的CAT酶活性发生了显著变化,相邻质量浓度组之间表现出极显著差异,变化趋势随着暴露期油水配比质量浓度的增加呈先增加后降低。恢复期同暴露期相比,实验组的酶活性均有所降低,说明活性有所恢复。暴露在WAFs和CEWAFs中的黄海胆均在恢复期油水配比质量浓度为1.25 g/L时肠和性腺组织的CAT酶活性最大,肠中最大诱导值WAFs组为111.98 U/mgprot、CEWAFs组为99.68 U/mgprot,性腺中最大诱导值WAFs组为115.84 U/mgprot,CEWAFs组为101.31 U/mgprot。
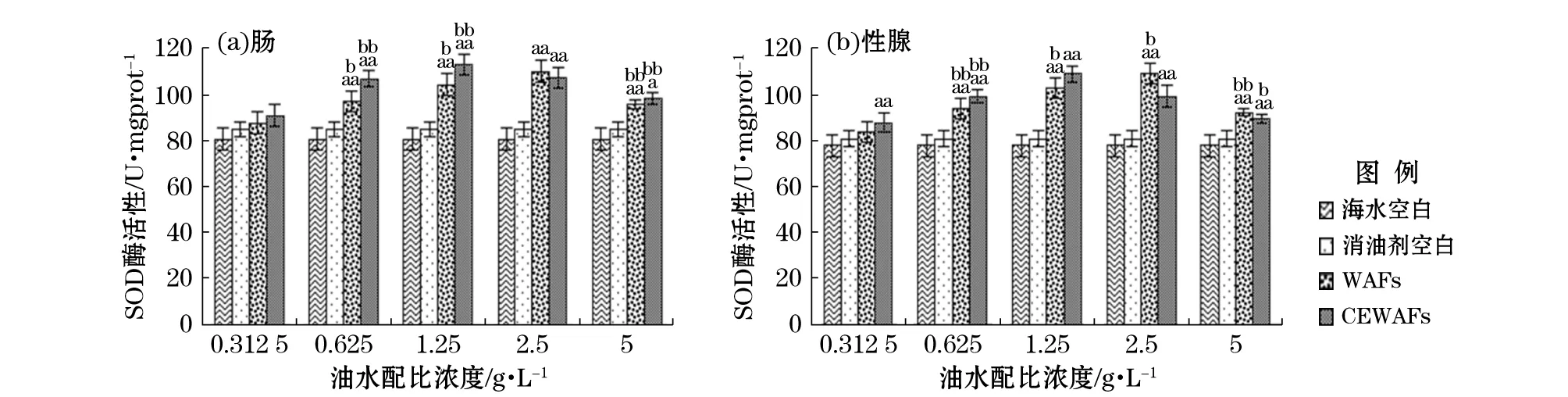
注:U/mgprot中U为酶活性单位,mgprot为毫克蛋白,表示每毫克蛋白中酶活性大小;“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图6 恢复期WAFs和CEWAFs对黄海胆肠和性腺的SOD酶活性影响Fig.6 Effect of WAFs and CEWAFs on SOD activity of G. Crenularis in intestine and gonad during the recovery period
经过7 d恢复期,黄海胆肠和性腺中SOD酶活性同暴露期相比,对应油水配比质量浓度下的SOD酶活性与对照组差异性减弱,随着WAFs和CEWAFs质量浓度的增大酶活性仍呈现先增加后降低的趋势,但变化程度减小。海胆肠和性腺组织SOD酶活性最大诱导值出现在质量浓度为2.5 g/LWAFs组,即109.47,109.06 U/mgprot。CEWAFs组肠和性腺组织的SOD酶活性达到最大诱导值的油水配比质量浓度为1.25 g/L,即112.33,108.70 U/mgprot(图6)。
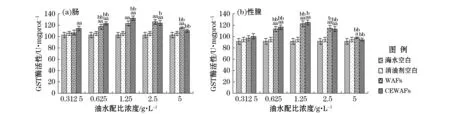
注:U/mgprot中U为酶活性单位,mgprot为毫克蛋白,表示每毫克蛋白中酶活性大小;“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图7 恢复期WAFs和CEWAFs对黄海胆肠和性腺的GST酶活性影响Fig.7 Effect of WAFs and CEWAFs on GST activity of G. Crenularis in intestine and gonad during the recovery period
当油水配比质量浓度为0.312 5 g/L时,性腺组织中实验组与对照组无显著差异,油水配比质量浓度为0.625,1.25和2.5 g/L时,实验组与对照组均呈现极显著差异,而且相邻浓度组之间亦差异显著,肠组织中GST酶活性的差异形态与性腺组织基本一致。与暴露期WAFs和CEWAFs油水配比质量浓度对应的肠和性腺中GST酶活性均随着配比质量浓度的增大出现先增加后降低的趋势,而这种变化程度和暴露期相比较小,最大诱导值也下降,暴露期WAFs和CEWAFs中肠组织的GST酶活性最大诱导值分别为132.26 U/mgprot和140.19 U/mgprot;恢复期对应WAFs和CEWAFs中肠组织的GST酶活性最大诱导值分别为125.04 U/mgprot和131.29 U/mgprot(图7)。
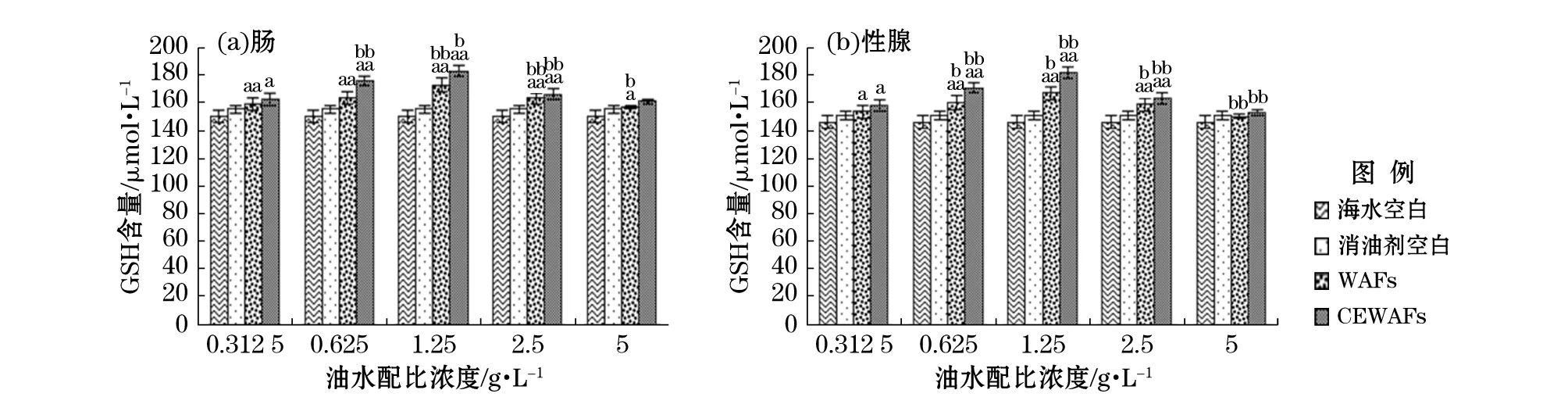
注:“a”表示该组数据和对照空白组数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“aa”表示差异极显著(p≤0.01);“b”表示组间数据进行单因素方差分析结果呈差异显著(0.01≤p≤0.05);“bb”表示差异极显著(p≤0.01)图8 恢复期WAFs和CEWAFs对黄海胆肠和性腺的GSH含量影响Fig.8 Effect of WAFs and CEWAFs on GSH content of G. Crenularis in intestine and gonad during the recovery period
如图8所示,和暴露期相比,经过7 d恢复肠和性腺中试验组GSH的含量有不同程度的降低,随着油水配比质量浓度的增大,含量出现先增加后降低的变化趋势,但变化程度明显下降。当油水配比质量浓度为0.312 5,0.625,1.25和2.5 g/L时,试验组和空白对照组的GSH含量呈现显著差异,相邻浓度组之间亦表现显著差异。在油水配比质量浓度为1.25 g/L时,肠中GSH含量在WAFs组和CEWAFs组中均出现最大诱导值,分别为172.90,182.81 μmol/L。而性腺中GSH含量在WAFs组和CEWAFs组中亦均出现最大诱导值,分别为166.84,181.35 μmol/L。
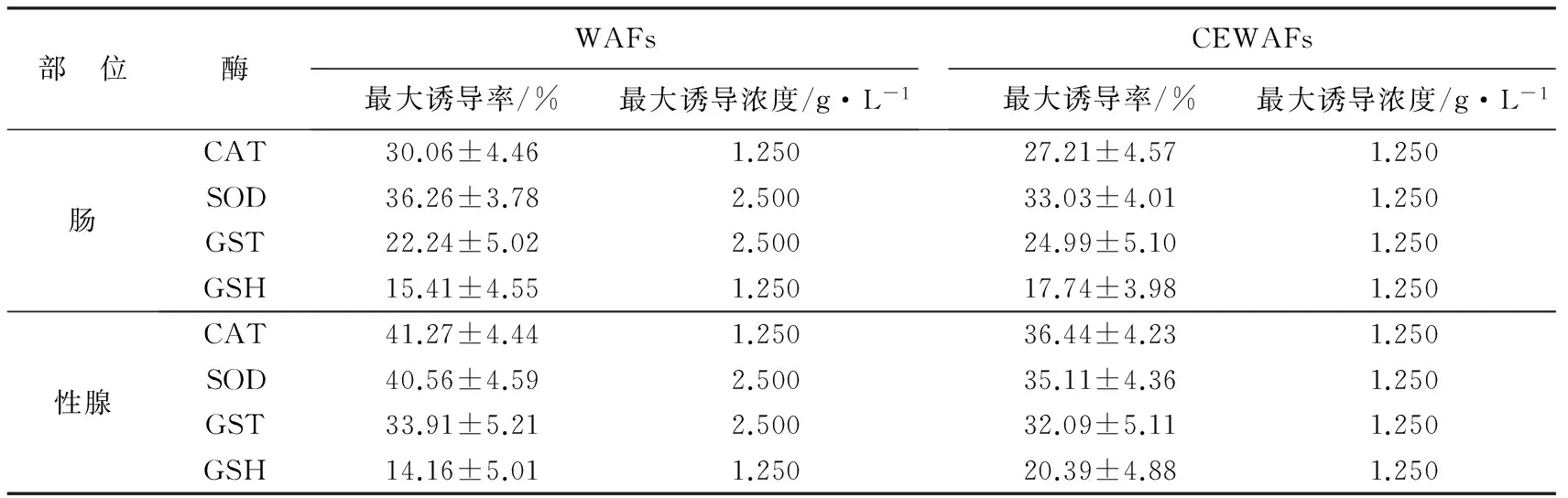
表3 恢复期WAFs与CEWAFs对黄海胆抗氧化酶活性诱导效应的比较
与暴露期相比,最大诱导率均有所下降。但WAFs和CEWAFs组对各酶活性的最大诱导浓度与暴露期相同。经过对比发现,WAFs组性腺中SOD酶活性恢复程度较其他3种酶相比最为显著,CEWAFs组性腺中CAT和SOD酶活性均显著恢复。
3讨论
剂量-效应柱形图是被采用最频繁的生物急性毒性研究结果的反应形式[26],它能清晰反映出想要对比的数值之间的差异情况。暴露期和恢复期各实验组的抗氧化酶活性均不同程度的高于对照组,说明WAFs和CEWAFs对肠和性腺的抗氧化酶系统均起着不同程度的诱导作用,从整体趋势看诱导强度先增大后减小。
在不同质量浓度组之间进行比较,0.312 5,0.625,1.25 g/L的CEWAFs对黄海胆的抗氧化酶诱导作用依次增强,达到最大诱导值后开始减弱,抗氧化酶活性开始下降。而WAFs对于SOD和GST酶活性最大诱导浓度达到2.5 g/L,CAT和GSH酶活性最大诱导浓度均为1.25 g/L。由此说明从最大诱导浓度开始,生物体细胞受损,抗氧化酶系统被破坏。尽管CEWAFs浓度约WAFs的3倍,但CEWAFs组2个时期的抗氧化酶活性整体却并没有高出WAFs组3倍。这与Milinkovitch等[27]的研究中得出了相同的结果,加入化学消油剂的暴露液(CD)总石油烃浓度近似原油分散液(MD)总石油烃浓度3倍,而所测得的GST和GPx均是CD略高于MD,而SOD、CAT则MD略高于CD,其原因可能是CD的PAH含量较MD低,ROS较少,故不能充分激发抗氧化酶活性[28]。这同时也说明了化学消油剂的使用,在一定程度上降低了石油中PAH的含量。
从表2和表3来看,不同组织之间受WAFs和CEWAFs的诱导影响规律为,性腺组织大于肠组织。且肠和性腺的SOD和CAT活性对于暴露液诱导和抑制作用的敏感性较GST和GSH要相对强一些。余群等[29-32]认为SOD和CAT活性更能在一定程度上反映生物毒性机制,因此更适合作为溢油污染的生物标志物。其研究石油烃胁迫对海洋生物的急性毒性影响结果显示,SOD和CAT酶活性随着暴污浓度的上升而增强,达到最大诱导值后便下降。说明SOD和CAT活性的增强是机体对抗氧化胁迫的一种调节机制,然而这种适应性调节能力有限,当剂量过高氧化胁迫压力增强时,氧化损伤在所难免,酶活降低,从而使机体细胞受损出现病变致畸甚至致死。本文中SOD和CAT活性受影响变化程度较为显著,恢复程度较好,因此二者可看作抗氧化防御机制的主要调节功能酶。
GSH是生物体内一种重要的抗氧化剂,其特点是水溶性较强。在谷胱甘肽过氧化物酶(GPx)作用下把 H2O2还原为 H2O,其自身被氧化为氧化型谷胱甘肽(GSSG)。而GSSG又可被还原酶催化受H转化为GSH,进而持续清除活性氧自由基,减轻氧化胁迫毒性影响。本实验中,GSH含量实验组始终高于对照组且CEWAFs组高于WAFs组,这与黄志斐等[33]研究BDE209胁迫对翡翠贻贝(Perna viridis)SOD,MDA和GSH的影响中结论相一致。表明随着暴露液浓度上升,GSH大量消耗同时也大量合成,故活性增加。达到最大诱导浓度后,机体氧化损伤加重,自身调节机制无法有效缓解氧化胁迫压力,GSH消耗远大于合成,故含量降低。
Milinkovitch等[34]和Marques等[35]在研究原油及消油剂对鲻鱼心脏组织生物标记物毒性效应中表明,CD组GST酶活性高于MD组,二者均显著高于对照组并且此规律在暴露期和恢复期相同,此结论与本文相一致。GST可促进氧化型PAH与GSH结合,故GST增加则GSH会有所减少,但本实验中并没用体现出此规律。
4结论
本文探究了180#燃料油WAFs和CEWAFs对黄海胆抗氧化酶活性的影响,得出如下结论:
1)暴露后的黄海胆肠和性腺组织中抗氧化酶活性随着暴露液浓度的增加出现先诱导后抑制的趋势,说明机体在WAFs和CEWAFs暴露下既可产生适应性“毒性兴奋”作用,表现为酶活性因受到诱导而升高;也受到抑制产生中毒反应,表现为各酶活力下降。
2)CEWAFs组和WAFs组的各酶活性最大诱导浓度均相同,说明二者对黄海胆抗氧化酶活性的效应浓度大致相同,然而二者质量浓度相差悬殊,这其中具体的机制还有待进一步的研究。
3)从抗氧化酶活性上来看,CAT和SOD这两种酶变化幅度较大,表现较为活跃,与其他学者研究作对比分析,得出结论,CAT和SOD可看作抗氧化防御机制的主要调节功能酶。二者也更适合作溢油污染评估分析的生物标记物。
4)暴露期肠和性腺的各酶活性最大诱导率均为CEWAFs组高于WAFs组,说明经过化学消油剂增溶后的180#燃料油乳化液毒性效应要高于燃料油单独作用的毒性效应。同时也反映了目前喷洒消油剂这种海上溢油的处理方法还有待进一步研究和改善,从而使溢油事故得到更加优化高效的防治。
参考文献(References):
[1]HUANG J Z. China’s fuel oil market today and outlook[J].Sino-Glabol Energy, 2013, 18(9): 73-78. 黄金珠. 中国燃料油市场现状与展望[J].中外能源, 2013, 18(9): 73-78.
[2]FU B. The current state and future development prospects of the Chinese market for boat fuel[J].International Petroleum Economics, 2009,(12): 23-26. 付斌. 中国船供油市场发展现状及前景展望[J].国际石油经济, 2009, (12): 23-26.
[3]TIAN G W. The simple analysis of admiralty fuel oil development[J].Petroleum & Petrochemical Today, 2010, 188(8): 17-20. 田广武. 船舶燃料油发展浅析[J].当代石油石化, 2010, 188: 17-20.
[4]ZUO L. The prospect of admiralty fuel oil market and techno-economic analysis of its production[J].Petroleum & Petrochemical Today, 2008, 8(16): 21-24. 左黎. 船舶燃料油市场前景及生产技术经济分析[J].当代石油石化, 2008, 16(8): 21-24.
[5]ZHU H Y. Sinopec marine fuel oil business development plan research[D].Beijing: Beijing University of Chemical Technology, 2013. 朱洪印. 中国石化船用燃料油业务发展规划研究[D].北京: 北京化工大学, 2013.
[6]FANG X, YANG W. The current status of petroleum pollution of the ocean and the prevention[J].Environmental Science and Management, 2007, 32(9): 78-80. 方曦, 杨文. 海洋石油污染研究现状及防治[J].环境科学与管理, 2007, 32(9): 78-80.
[8]FISHER W S, FOSS S S. A simple test for toxicity of number 2 fuel oil and oil dispersants to embryos of grass shrimp, palaemonetes pugio[J].Mar Pollut Bull, 1993, 26(7): 385- 391.
[9]HANNAH V P, MITCHELMORE C L. Acute toxicity of current and alternative oil spill chemical dispersants to early life stage blue crabs (Callinectes sapidus)[J].Chemosphere, 2015, 128: 14-20.
[10]COTOU E, CASTRITSI-CATHARIOS I, MORAITOU-APOSTOLOPOULOU M. Surfactant-based oil dispersant toxicity to developing nauplii of Artemia: effects on ATPase enzymatic system[J].Chemosphere, 2001, 42: 959-964.
[11]GONG Y Y, FU J, O'REILLY S E. Effects of oil dispersants on photodegradation of pyrene in marine water[J].Journal of Hazardous Materials, 2015, 287(28): 142-150.
[12]ETKINDS. Oilspill dispersants:From technologytopolicy[M].Arlington: Cutter Information Corp, 1999, 77-78.
[13]LESSARD R R, DEMARCOG. The significance of oil spill dispersants[J].Spill Science & Technology Bulletin, 2000, 6(1): 59-68.
[14]XIA W X, LIN H T, LI J C, et al. Application of dispersants in pollution control of oil spill[J].Techniques and Equipment for Environmental Pollution Control, 2004, 5(7): 39-43.夏文香, 林海涛, 李金成, 等. 分散剂在溢油污染控制中的应用[J].环境污染治理技术与设备, 2004, 5(7): 39-43.
[15]WANG J L, LIU C G, FENG J F, et al. Literature review of the effects of petroleum hydrocarbons on marine phytoplankton[J].Environmental Pollution & Control, 2011, 4(4): 81-86.王君丽, 刘春光, 冯剑丰, 等. 石油烃对海洋浮游植物生长的影响研究进展[J].环境污染与防治, 2011, 4(4): 81-86.
[16]MICHAEL L, RACHEL P. Toxicities of oils, dispersants and dispersed oils to algae and aquatic plants: Review and database value to resource sustainability[J].Environmental Pollution, 2013, 180: 345-367.
[17]HUANG Y J, CHEN Q Z, ZENG J N, et al. The impact of oil pollution on marine phytoplankton community growth change[J].Acta Ecologica Sinica, 2011, 31(2): 513-521.黄逸君, 陈全震, 曾江宁, 等. 石油污染对海洋浮游植物群落生长的影响[J].生态学报, 2011, 31(2): 513-521.
[18]SAMMUHM, NICKLESS G. Petroleum hydrocarbons in marinesediment and animals from the island of Malta[J].Environmental Pollution, 1978, 16(1): 17-30.
[19]RODRIGO A, CAMMIE H, EDWARD J B. Toxicity of dispersant Corexit 9500A and crude oil to marine microzooplankton[J].Ecotoxicology and Environmental Safety, 2014, 106: 76-85.
[20]EL SHEEKH M M, EL NAGGAR A H, OSMAN M E H, et al. Comparative studies on the green algaeChlorellahomosphaeraandChlorellavulgariswish respect to oil pollution the river Nile[J].Water, Air and Soil Pollution, 2000, 124(1): 79-83.
[21]REID D J, MACFARLANE G R. Potential biomarkers of crude oil exposure in the gastropod mollusc, Austrocochlea porcata: laboratory and manipulative field studies[J].Environmental Pollution, 2003, 126: 147-155.
[22]CHEN J C, MENG S L, HU G D, et al. Effects of low concentration of Atrazine on catalase activity in carassius auratus[J].Journal of Agro-Environment Science, 2008, 27(3): 1151-1156. 陈家长, 孟顺龙, 胡庚东, 等. 低浓度阿特拉津对鲫鱼过氧化氢酶(CAT)活性的影响[J].农业环境科学学报, 2008, 27(3): 1151-1156.
[23]WANG Y, ZHENG W Y, YU Q. Effects of fuel oil exposure on the activity of sedium-dependent glutathione peroxidase in viscera mass ofPagrosomusmajorlarvae[J].Acta Scientiae Circumstantiae, 2000, 20(1): 91-94. 翁妍, 郑微云, 余群. 石油污染对真鲷幼体谷胱甘肽过氧化物酶影响的研究[J].环境科学学报, 2000, 20(1): 91-94.
[24]SHEN A L, SHEN X Q. Effects of diesel fuel on the superoxide dismutase and catalase of zebra fish[J].Marine Fisheries, 2005, 27(4): 314-318. 沈盎绿, 沈新强. 柴油对斑马鱼超氧化物歧化酶和过氧化氢酶的影响[J].海洋渔业, 2005, 27(4): 314-318.
[25]HU G F, LI Z, LIANG H W, et al. Effects of Cadmium on SOD and CAT in hepatopancreas, antennary gland and gill of procambarus clarkii[J].Journal of Agro-Environment Science, 2009, 28(9): 1806-1811. 呼光富, 李忠, 梁宏伟, 等. 镉对克氏原螯虾肝胰腺触角腺及鳃中SOD和CAT活性的影响[J].农业环境科学学报, 2009, 28(9): 1806-1811.
[26]ZHENG W Y, WENG E Q. Environmental Toxicicology Outline[M].Xiamen: Xiamen University Press, 1993: 200-203. 郑微云,翁恩琪.环境毒理学概论[M].厦门:厦门大学出版社,1993: 200-203.
[27]MILINKOVITCH T, NDIAYE A, SANCHEZ W, et al. Liver antioxidant and plasma immune responses in juvenile golden grey mullet(Lizaaurata) exposed to dispersed crude oil[J].Aquatic Toxicology, 2011, 101: 155-164.
[28]SUN F H, ZHOU Q X, ZHANG Q R. Toxic effects of petroleum hydrocarbons and copper on PolychaeteNereisdiversicolorand on its antioxidant enzyme systems[J].Environmental Science, 2006, 27(7): 1415-1419. 孙福红,周启星,张倩如.石油烃、Cu2+对沙蚕的毒性效应及对其抗氧化酶系统的影响[J].环境科学, 2006, 27(7): 1415-1419.
[29]CLAIREAUX G, THéRON M, PRINEAU M, et al. Effects of oil exposure and dispersant use upon environmental adaptation performance and fitness in the European sea bass,Dicentrarchuslabrax[J].Aquatic Toxicology, 2013, 130-131: 160-170.
[30]CHEN R, ZHENG W Y, YU Q, et al. Effect of oil pollution on antioxidant enzyme of oyster(Ostreacucullata)[J]. Actascientiae Circumstantiae, 2002, 22(3): 385-388. 陈荣, 郑微云, 余群, 等.石油污染对僧帽牡蛎(Ostreacucullata)抗氧化酶的影响[J].环境科学学报, 2002, 22(3): 385-388.
[31]LIN K, CHUN G Z, YUK S W, et al. Dose and accumulative effects of spent lubricating oil on four common mangrove plants in South China[J].Ecotoxicology and Environmental Safety, 2011, 74: 55-66.
[32]DUSSAUZE M, DANION M, FLOCH S L, et al. Innate immunity and antioxidant systems in different tissues of sea bass(Dicentrarchuslabrax) exposed to crude oil dispersed mechanically or chemically with Corexit 9500[J].Ecotoxicology and Environmental Safety, 2015, 120: 270-278.
[33]HUANG Z, ZHANG Z, MA S W, et al. Effects of BDE209 on the SOD, MDA, GSH ofPernaviridis[J].Journal of Agro-Environment Science, 2012, 31(6): 1053-1059. 黄志斐, 张喆, 马胜伟, 等. BDE209胁迫对翡翠贻贝(Pernaviridis)SOD、MDA和GSH的影响[J].农业环境科学学报, 2012, 31(6): 1053-1059.
[34]MILINKOVITCH T, IMBERT N, SANCHEZ W, et al. Toxicological effects of crude oil and oil dispersant: Biomarkers in the heart of the juvenile golden grey mullet(Lizaaurata)[J].Ecotoxicology and Environmental Safety, 2013, 88: 1-8.
[35]MARQUES J A, SILVA H C, GUILOSKI I C, et al. Antioxidant defense responses inMytellaguyanensis(Lamarck,1819) exposed to an experimental diesel oil spill in Paranagu Bay(Paran, Brazil)[J].Ecotoxicology and Environmental Safety, 2014, 107: 269-275.
Received: June 25, 2015
*收稿日期:2015-06-25
作者简介:殷悦(1992-),女,黑龙江齐齐哈尔人,硕士研究生,主要从事环境毒理学方面研究.E-mail:18841129227@163.com *通讯作者:熊德琪(1967-),男,辽宁大连人,教授,博士,博士生导师,主要从事海洋生态毒理学与溢油损害评估方面研究.E-mail:xiongdq@dlmu.edu.cn(王佳实编辑)
中图分类号:X55
文献标识码:A
文章编号:1671-6647(2016)02-0292-12
doi:10.3969/j.issn.1671-6647.2016.02.014
Compound Toxicity of No.180 Fuel Oil Disposed by Oil Spill Dispersant onGlyptocidarisCrenularis
YIN Yue, XIONG De-qi, ZHANG Xin-xin, HE Shan, DUAN Mei-na, LÜ Xin-lu
(SchoolofEnvironmentalScienceandEngineering,DalianMaritimeUniversity, Dalian 116026, China)
Abstract:In this study, the compound toxic effects of 180# fuel oil water-accommodated fractions (WAFs) and chemically enhanced water-accommodated fractions (CEWAFs) on the antioxidant enzyme system in gonadal and intestinal tissues of Glyptocidaris Crenularis were investigated. During the exposure period, the sea urchins were exposed in different concentration gradient of WAFs and CEWAFs for 96 h, then a portion of its intestine and gonad was extracted for antioxidase activities determination. Subsequently, the exposure solution was replaced by filtered seawater to culture the rest of sea urchins for 7 d, then the same antioxidase activities of sea urchins were examined during the recovery period..The results indicated that the CEWAFs and WAFs demonstrated an inductive effect first and then an inhibitory effect to the antioxidase activity. In the exposure period, the maximum inductive rates of CAT、SOD、GST and GSH in WAFs were 40.21%,46.03%,26.01% and 23.89%, in CEWAFs they were 38.60%,48.83%,29.34% and 27.86% respectively. In disposal group, the maximum inductive rates of antioxidase activity in gonad were higher than those in intestine, and same phenomenon was observed during the recovery period as well. The results suggested that the gonad of Glyptocidaris Crenularis is more sensitive to the petroleum hydrocarbon than intestine. By comparison, the activity of CAT and SOD was more sensitive to petroleum hydrocarbon pollutant , suggesting CAT and SOD were better suited as a biomarker for marine oil spill pollution monitoring. There were no significant diversity between the two kinds of control suggesting that the chemical dispersant has inconspicuous toxicity itself.
Key words:oil spill dispersant; 180# fuel oil; Glyptocidaris Crenularis; antioxidase activity
资助项目:国家自然科学基金项目——消油剂处理溢油对模式生物海胆的联合毒性效应及机制研究(41276105/D0608);交通运输部应用基础研究项目——消油剂处理溢油对生物的复合毒害效应及机理研究(2013329225250)

