实验室病原菌检测能力的自我评估
陈梅玲,袁文,张谱华,王静,闵凡贵,赵维波,陈梅丽
实验室病原菌检测能力的自我评估
陈梅玲,袁文,张谱华,王静,闵凡贵,赵维波,陈梅丽
(广东省实验动物监测所/广东省实验动物重点实验室,广东 广州510663)
摘要:目的通过国际实验动物科学协会(ICLAS)提供的盲样对本实验室微生物检测能力进行自我评估。方法将ICLAS提供的7个盲样接种到血平板培养并纯化,依次通过革兰染色、氧化酶试验和触酶试验选择相应的梅里埃生化条上机进行鉴定。对于上述方法无法确认的样品则采用PCR和基因测序的方法进一步鉴别。结果对7个盲样进行分析后,最终确认1号为金黄色葡萄球菌,2号为铜绿假单胞菌,3号为肺炎链球菌,4号为欣氏鲍特菌,5号为粘质沙雷菌,6号为牛棒状杆菌,7号为嗜肺巴斯德杆菌,检测结果与ICLAS提供结果一致。结论本实验室病原菌检测质量可靠,实验人员的检测水平合格。
关键词:国际实验动物科学协会;病原菌;盲样
实验室能力验证,是指利用实验室间指定检测数据的比对,确定实验室从事特定测试活动的技术能力,是国际通行的实验室质量控制方法和认可机构确认实验室能力的有效技术手段[1-2],对提高实验室的检测水平以及社会声誉有重要意义[3-4],也是对实验室检测能力的综合锻炼与提高。
2007年国际实验动物科学协会(the international council for laboratory animal science,ICLAS)建立了实验动物诊断实验室绩效评估项目(PEP),旨在对动物检测实验室的检测能力进行监督和自我评估。该项目向全球的动物诊断实验室开放,每年定期向参与实验室发送盲样,参与实验室通过提交检测结果并与ICLAS结果进行比对,以验证自身的检测能力。此外对于出现问题的检测实验室,项目组织者
网络出版时间:2016-05-30 11:02 网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160530.1102.006.html可以提供相关的建议和帮助[5]。本单位作为实验动物的监督检测单位,肩负广东省乃至华南区其他部分省份实验动物质量的检测工作,检测能力的评估意义重大。为验证病原菌实验室检测能力,本单位在已参加2012年ICLAS-PEP能力验证的基础上参加了2014年ICLAS-PEP病原检测项目,此次实验出现了样品培养未能生长、鉴定结果的细菌不在ICLAS-PEP菌种目录里,现将检测结果和比对情况进行报道。
1 材料与方法
1.1 材料
1.1.1 样品 ICLAS提供的7个盲样,分别为小鼠肺匀浆(1号)、水样(2号)、大鼠鼻腔内容物(3号)、小鼠鼻气管内容物(4号)、小鼠盲肠内容物(5号)、小鼠皮拭子(6号)、大鼠呼吸道内容物(7号)。1.1.2 试剂 血平板(广州市迪景微生物科技有限公司);半固体动力生化管(北京陆桥技术责任有限公司);生化管、杆菌肽纸片和奥卜托新纸片(杭州天和微生物试剂有限公司);氧化酶试剂和生化鉴定条API STAPH、ID 32E、API 20 Strep、API 20NE、API CORYNE(Biomerieux公司);RNA提取试剂盒(Invitrogen公司);PrimeScriptⓇRT reagent Kit (Takara公司)。
1.1.3 仪器 SPX-288生化培养箱(江南仪器厂);1300生物安全柜(Thermo公司);ATB微生物鉴定仪器(Biomerieux公司);Tprofessional梯度PCR仪(Biometra公司);Powerpac Basic 164-5050电泳仪(Bio-Rad公司),Gel DocTM XR+全自动凝胶成像系统(Bio-Rad公司)。
1.2 方法
1.2.1 参考标准 《实验动物 微生物学检测方法(2)》(GB14926)及第2版《伯杰氏系统细菌学手册》。
1.2.2 培养 分别从样品保存管中吸取菌液10~20 μL划线接种到血平板上,置于生化培养箱中36℃培养24~48 h后,挑取单个菌落进行纯培养。
1.2.3 涂片染色镜检 挑取单个菌落涂片,革兰染色镜检。
1.2.4 氧化酶试验和触酶试验 挑取染色镜检为革兰阴性杆状的菌落做氧化酶试验;取染色镜检为革兰阳性球状和革兰阳性链球状的菌落做触酶试验。
1.2.5 生化反应 挑取纯培养物制备一定浓度的菌悬液,无菌操作将菌悬液注入试条的生化反应杯中,于29℃或36℃培养24 h后读取结果。
1.2.6 嗜肺巴斯德杆菌的PCR方法 挑取样品,提取RNA,按设置条件进行逆转录及PCR反应,具体如下:94℃预变性5 min;然后进行35个循环,94℃变性30 s,60℃退火30 s,72℃延伸1 min;最后72℃再次延伸10 min,120 V,25 min凝胶电泳。嗜肺巴斯德杆菌引物序列为:Forward:5′-AATTACAGCTCACTATTCGYCGTCA-3′;Reverse:5′-CCCAATGCAGTAATYAAYGTMCCCA-3′;扩增片段大小为1 039 bp。
1.2.7 基因测序方法 挑取样品,采用扩增细菌16 S rRNA的通用引物(引物序列为:Forward:5′-AGAGTTTGATCCTGGCTCAG-3′,Reverse:5′-AAG GAGGTGATCCAGCCGCA-3′,扩增片段大小为1 540 bp)进行PCR反应,具体条件如下:94℃预变性5 min;然后进行40个循环,94℃变性1 min,57℃退火1 min,72℃延伸2 min;最后72℃再次延伸10 min,120 V,25 min凝胶电泳。对目的扩增产物进行测序,使用DNASTAR软件和NCBI中BLAST软件进行序列比对。
2 结果
2.1 培养结果
细菌培养结果显示,1~6号盲样均可在血平板上正常生长,而7号盲样在血平板上未形成任何菌落,同时后续使用营养肉汤摇床培养,均未见生长。
2.2 镜检
镜检发现1、3和6号盲样为G+菌,2、4和5号盲样为G-杆菌,7号为G-小杆菌。结果见表1。

表1 革兰染色镜检特征和判定结果Table 1 Characteristics and results of Gram staining by microscopy
2.3 氧化酶试验和触酶试验
根据镜检结果,对1和3号盲样培养物进行触酶试验,2、4和5号盲样培养物进行氧化酶试验,并进行了初步判断,结果见表2。
2.4 生化鉴定
通过生化条对1~6号盲样进行鉴定,结果见表3。其中,1、2、4、5和6号盲样的生化条鉴定结果的鉴定百分数(%ID)都在96以上,可信度高,综合镜检结果可以初步确认为金黄色葡萄球菌、铜绿假单胞菌、鸟博特菌、粘质沙雷菌和牛棒状杆菌。3号盲样生化条鉴定结果无效。
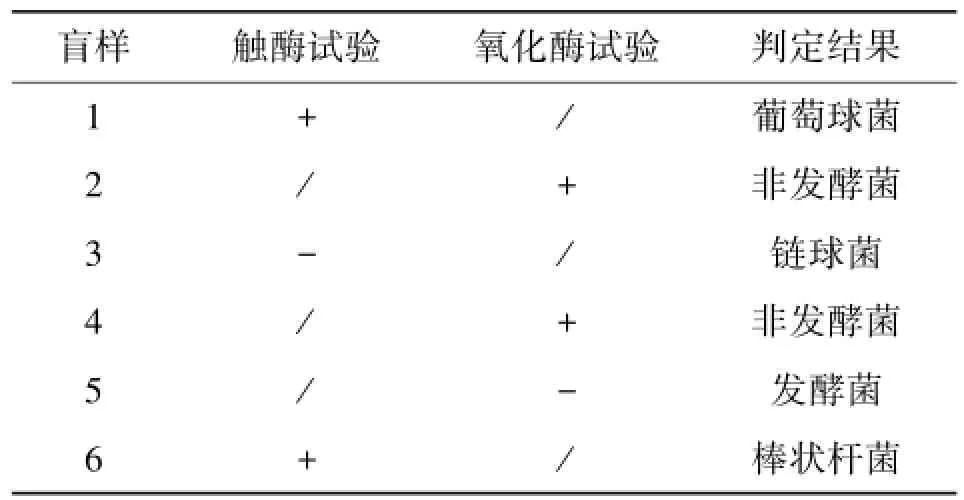
表2 氧化酶试验和触酶试验结果Table 2 Results of oxidase and catalase tests

表3 生化条鉴定结果Table 3 Results of biochemical identification
2.5 3号盲样的鉴定
3号盲样镜检和触酶试验实验初步判定为链球菌,但生化条鉴定结果无效。将培养物接种到液体培养基中培养24 h,染色镜检为双球菌。样品在血平板上培养48 h,菌落中央可凹陷致边缘隆起而呈脐窝状,疑似肺炎链球菌,进行鉴别生化试验。结果显示,胆汁溶菌试验阳性、奥卜托新(Optochin)敏感试验阳性,胆汁七叶苷阴性,因此确定3号盲样为肺炎链球菌。
2.6 4号盲样的鉴定
4号盲样经梅里埃生化条鉴定结果为鸟博特菌,%ID为96.6,评价良好。但是鉴于该菌为稀有菌株,相关生化反应(如触酶阳性、氧化酶阳性、硝酸盐还原阴性、尿素阴性、动力阴性)与欣氏鲍特菌一致,尚需要进一步区分。为此,项目组开展了相关的生化试验,结果见表4。通过生化反应仍无法确定4号盲样的最终结果。由于现有的生化反应不能区分两种菌,项目组对此结果不能完全可信。查找相关文献,重新进行相关生化反应,并进一步设计引物,扩增特异片段进行基因测序,使用DNASTAR软件和NCBI中BLAST软件进行序列比对,发现样品与欣氏鲍特菌3224的核苷酸同源性为100%,因此,确定4号盲样为欣氏鲍特菌。
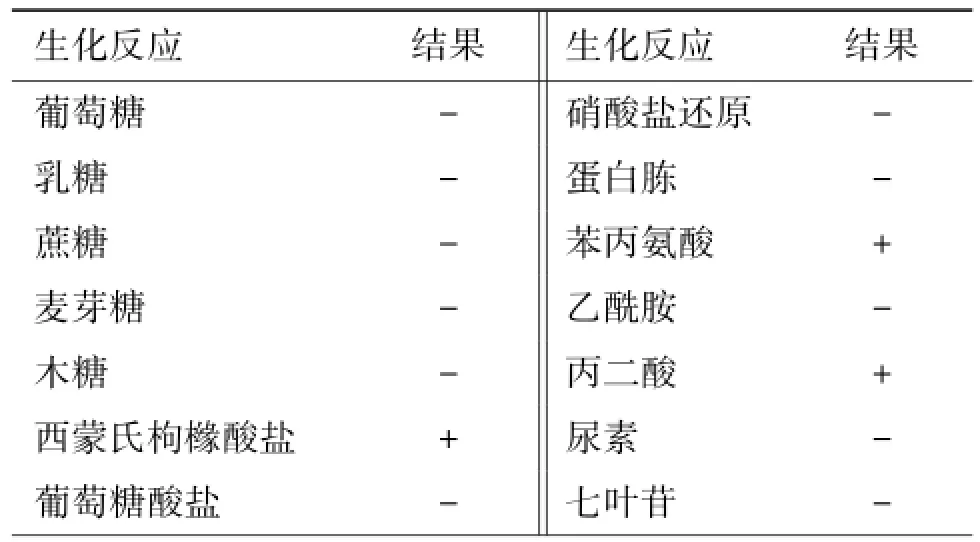
表4 4号盲样生化管鉴定结果Table 4 Results of biochemical identification of sample 4
2.7 7号盲样的鉴定
7号盲样在分离培养中发现菌已经死亡,无法使用常规的方法进行鉴定。将该盲样进行革兰染色,镜检发现为G-小杆菌,依据检测人员工作经验并结合实验动物常见病原检测情况,疑似嗜肺巴斯德杆菌,进而采用PCR方法对其进行鉴定,产物电泳结果(图1)显示,7号盲样扩增片段与阳性嗜肺巴斯德杆菌预期扩增结果1 039 bp特异性条带相符,确认7号盲样为嗜肺巴斯德杆菌。
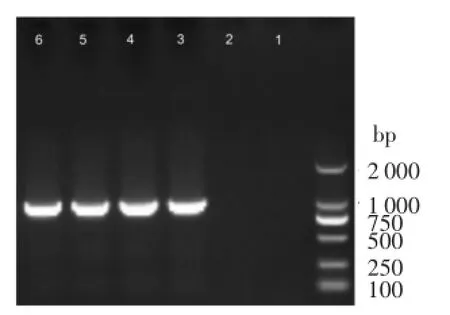
1和2为阴性对照;3和4为阳性嗜肺巴斯德杆菌;5和6为7号盲样。图1 7号盲样PCR鉴定结果Figure 1 PCR results of sample 7
2.8 与ICLAS结果比对
综合上述试验结果,1号为金黄色葡萄球菌,2号为铜绿假单胞菌,3号为肺炎链球菌,4号为欣氏鲍特菌,5号为粘质沙雷菌,6号为牛棒状杆菌,7号为嗜肺巴斯德杆菌,检测结果与ICLAS提供结果完全一致。
3 讨论
通过本次能力验证发现,在微生物菌株的鉴定过程中,不可一味相信生化反应条,特别是对于同种属的菌。生化条反应的局限性在于对多个生化反应出现相同结果的不同菌株无法进行区分,这就导致如果单纯依赖生化条进行菌株的鉴定不够科学。此外,有些菌株可能依靠传统的检测方法难以鉴定,需借助一些其他的辅助手段,如PCR和基因测序等。PCR方法由于其快速、灵敏的特点,可为传统的病原菌检测提供强有力的补充。
通过本次ICLAS-PEP项目,可以综合判断本单位微生物病原菌检测结果是可靠的,实验人员的检测水平和检测能力是合格的。此外,通过此次能力验证也提高了本单位微生物检验人员的分析能力。
参考文献:
[1]黄薇,黎明,黄剑屏,等.成都市疾控系统微生物实验室能力验证评价标准探讨及结果分析[J].现代预防医学,2011,38(11):2132-2134.
[2]中国合格评定国家认可委员会.能力验证结果的统计处理和能力评价指南:CNAS—GL02[S].北京:中国标准出版社,2014:5-6.
[3]陆娟.一次实验室间比对实验结果分析[J].现代预防医学,2013,40(14):2700-2702.
[4]中国实验室国家认可委员会.利用实验室间比对的能力验证:GB/T 15483.1—1999[S].北京:中国标准出版社,1999:25.
[5]纪静.一次微生物实验室室间比对的报告和体会[J].实验与检验医学,2011,29(3):275-276.
(责任编辑:幸建华)
中图分类号:R372
文献标志码:A
文章编号:1006-8783(2016)03-0370-04
DOI:10.16809/j.cnki.1006-8783.2016041204
收稿日期:2016-04-12
基金项目:广东省级科技计划项目(2014A070705003)
作者简介:陈梅玲(1985—),女,研究实习员,主要从事实验动物的病原微生物检测工作,Email:362265636@qq.com;通信作者:赵维波(1976—),男,副研究员,主要从事实验动物检测相关研究工作,Email:183775444@qq.com;陈梅丽(1971—),女,兽医师,主要从事实验动物标准化管理,Email:1071138433@qq.com。
Self-assessment of microbiological monitoring capacity in laboratory
CHEN Meiling,YUAN Wen,ZHANG Puhua,WANG Jin,MIN Fangui,ZHAO Weibo,CHEN Meili
(Guangdong Laboratory Animals Monitoring Institute,Guangdong Provincial Key Laboratory of Laboratory Animals,Guangzhou 510663,China)
AbstractObjective To test samples supplied by ICLAS for self-assessment of microbiological monitoring capacity in our laboratory.Methods Seven blind samples provided by ICLAS were cultured and purified in blood plates.The samples were tested by Gram staining oxidase test catalase test and the biochemical identification system.PCR and gene sequencing were used to identify the samples that did not be confirmed by the above methods.Results Samples from 1 to 7 were identified as Staphylococcus aureus Pseudomonas aeruginosa Streptococcus pneumoniae Cushing′s thibaut bacteria Serratia marcescens Corynebacterium bovis and Pasteurella pneumotropica respectively.These results were in agreement with those notified by ICLAS.
Conclusion The microbiological monitoring results in this laboratory are reliable and the monitoring level of the laboratory personnel is qualified.
Key wordsICLAS pathogen blind sample

