氯诺昔康干混悬剂的制备及其质量考察
沙峥,张洪,彭锐,张英,魏丹芸
氯诺昔康干混悬剂的制备及其质量考察
沙峥,张洪,彭锐,张英,魏丹芸
(武汉大学人民医院 药学部,湖北武汉430060)
摘要:目的制备氯诺昔康干混悬剂并对其质量进行考察。方法通过单因素试验,考察不同辅料对氯诺昔康干混悬剂沉降体积比及再分散性的影响,再运用正交试验优选出最优处方工艺;采用高效液相色谱法测定干混悬剂中氯诺昔康的质量分数,并对其溶出度及稳定性进行考察。结果最佳处方工艺为:以质量分数8%的CMC-Na和5%的黄原胶共同作为助悬剂,15%的微晶纤维素为崩解剂,15%的聚乙烯吡咯烷酮K30为黏合剂;3批样品标示质量分数平均值为98.7%;pH 7.4磷酸盐缓冲液作为溶出介质时,氯诺昔康溶出速度快且较平缓;稳定性试验显示制剂的各项检测指标均无明显变化。结论优化后的处方工艺简单、可行、稳定性可控、重复性好,所制备的制剂符合干混悬剂质量要求。
关键词:氯诺昔康;干混悬剂;处方工艺;高效液相色谱法;稳定性
氯诺昔康是一种新型非甾体抗感染药,常用于治疗手术镇痛、急慢性骨关节炎、脊椎炎和风湿性关节炎等。由于氯诺昔康血浆半衰期短,不良反应较轻,耐受性好,抗感染镇痛效果显著,从而受到越来越多医生和患者青睐[1]。目前,国内外上市的氯诺昔康有片剂和针剂2种。口服片剂易吸收,但生物利用度低,且受饮食影响易导致吸收慢[2]。针剂的不良反应主要是恶心、呕吐、胃痛、腹泻等胃肠道反应,发生率为10%,高于片剂的5.45%[3]。口服干混悬剂是将药物用适宜方法制成粉末状或颗粒状的制剂,使用时加水能够迅速分散成混悬剂[4],解决了混悬剂在储存过程中的稳定性问题。药物在混悬剂
网络出版时间:2016-05-25 10:17 网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160525.1017.001.html中以微粒状态分散,分散度大,对胃肠道的刺激小,能被胃肠道迅速吸收,有利于提高生物利用度[5],可进一步提高患者对药物剂型的顺应性,改善病人的服药顺应性。本文通过对干混悬剂辅料的考察,采用正交试验设计筛选氯诺昔康干混悬剂的处方,以HPLC法对氯诺昔康的质量分数及溶出度进行测定,并通过影响因素试验及加速试验考察其稳定性,为氯诺昔康的临床应用提供依据。
1 仪器与试药
1.1 仪器
BT214D分析电子天平(德国赛多利斯公司);WD-2A药物稳定性检查仪(天津精拓仪器科技有限公司);YNG-9245A高温干燥箱(上海姚氏仪器设备厂);DK-24S电热恒温水浴锅(艾斯派克公司);Agilent 1100型高效液相色谱仪(美国 Agilent公司);ZRS-8G型智能溶出试验仪(天津市天大天发科技有限公司)。
1.2 试药
氯诺昔康原料药(武汉市东康源科技有限公司,批号20140125,质量分数>99.8%);乳糖(武汉市长福源医药辅料有限公司,批号20140309);羧甲基纤维素钠(CMC-Na,济南天胜化工有限公司,批号20150103);黄原胶(上海恒生化工有限公司,批号20141108);滑石粉(宜兴凯利达化学有限公司,批号20150201);聚乙烯吡咯烷酮K30(PVP K30,大连美仑生物技术有限公司,批号20141112);醋酸钠(常熟南湖化工有限责任公司);甲醇(色谱纯,Tedia company);羟丙基甲基纤维素 (HPMCK15M和HPMCK100M)、乙醇、微晶纤维素(MCC)均为国药集团化学试剂有限公司提供;水为实验室自制纯化水。
2 方法与结果
2.1 原辅料相容性试验
以乳糖、MCC、各型号的 HPMC、黄原胶、CMC-Na作为辅料,考察原辅料之间的相容性。按照100∶200∶1∶1∶1∶1∶1(质量比)称取氯诺昔康、乳糖、MCC、HPMCK15M、HPMCK100M、黄原胶、CMC-Na,分别过80目筛后混合均匀。将混合物分别在高湿(RH75%)、强光[(4 500±500)lx]和高温(60℃)的条件下放置10 d,考察原料药与原辅料混粉的性状、干燥失重及含量的变化情况。结果表明,湿度对原料药及原辅料混粉有一定的影响,高温跟强光则没有显著影响。因此,在制备氯诺昔康干混悬剂时应
控制环境湿度,注意防潮。
2.2 填充剂、黏合剂、崩解剂的选择
通过预试验,选择乳糖、10%(质量分数,下同)PVP(溶于体积分数50%乙醇溶液中)和MCC分别作为填充剂、黏合剂和崩解剂,制备得到的干混悬剂外观美观,不易吸湿,性质稳定,分散性较好,溶出度在规定范围内。
2.3 助悬剂种类的选择
通过等量递加法分别将黄原胶、HPMCK15M、HPMCK100M、CMC-Na和混粉(黄原胶+CMC-Na)5种助悬剂各1.3 g,加入到5份处方中(处方中其他成分的量固定:氯诺昔康0.32 g,乳糖6.88 g,MCC 1.5 g,滑石粉0.1 g),混合均匀,依法制备干混悬剂。依据《中国药典》[6]附录混悬剂项下的要求,对沉降体积比及再分散性进行考察:将适量所制备的5种干混悬剂分别置于50 mL具塞量筒中,加水至刻度,密塞,用力振摇1 min,观察溶解及分散情况,并记下此时混悬物的初始高度(H0),然后静置3 h,记下此时混悬物的最终高度(H),沉降体积比=H/H0;将混悬液继续沉降1 d,将具塞量筒倒转180°,倒转1次停留5 s,记为振摇1次。重复上述振摇过程,直至干混悬剂再次均匀分散,记下混悬液振摇的次数。振摇次数越少,说明该干混悬剂的分散性越好。
分别记录各处方中干混悬剂的沉淀状况、溶解情况、沉降体积比及再分散性,以无沉淀、易溶解、沉降体积比>0.9、再分散性好作为筛选助悬剂的标准,结果见表1。可见,黄原胶和CMC-Na的混粉作为助悬剂时,所制备的干混悬剂无沉淀产生,溶解性好,沉降体积比符合要求,再分散性好。

表1 不同助悬剂的考察结果Table 1 The result of the different suspending agent
2.4 正交试验优化氯诺昔康干混悬剂的处方
通过对单因素试验的考察,确定MCC的用量、黄原胶的用量、CMC-Na的用量、PVP K30的质量浓度作为影响干混悬剂的4种主要因素,每个因素设置3个水平,以沉降体积比为考察指标,采用L9(34)正交试验筛选最优处方。因素与水平见表2,正交试验结果见表3,方差分析结果见表4。
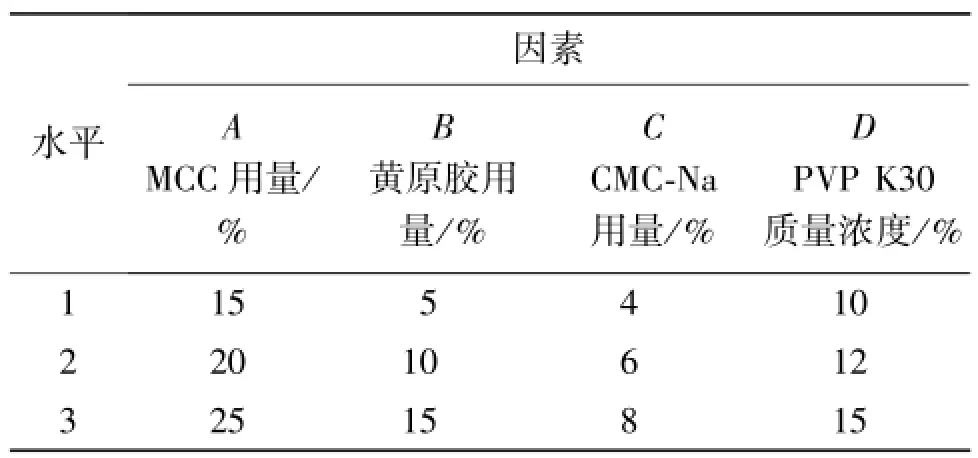
表2 正交试验因素水平表Table 2 The factor and levels of orthogonal test
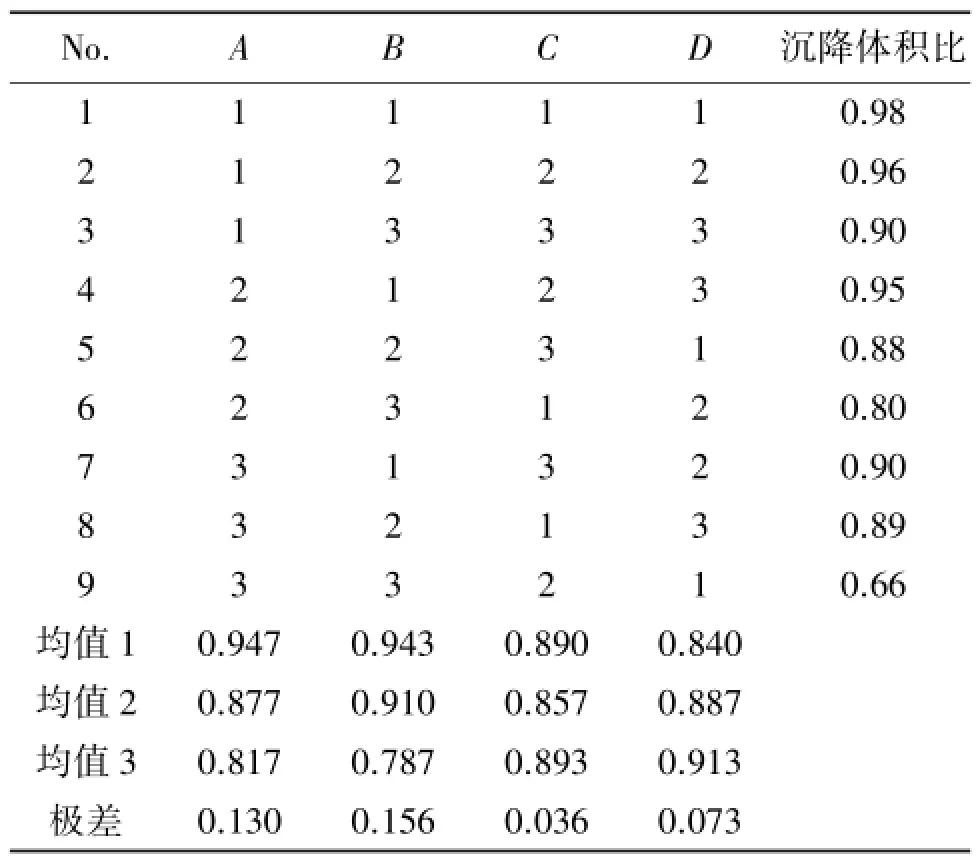
表3 正交试验设计与结果Table 3 The results of orthogonal test

表4 正交试验结果方差分析表Table 4 Analysis of variance
可见,各因素对沉降体积比的影响大小顺序为B>A>D>C,各因素水平的优劣顺序分别为:A因素1>2>3,B因素1>2>3,C因素3>1>2,D因素3>2>1。方差分析结果表明,4个因素对助悬剂沉降体积比的影响均无统计学意义。根据以上结果,确定A1B1C3D3为该干混悬剂的最佳处方,即MCC用量为15%,黄原胶用量为5%,CMC-Na用量为8%,PVP质量浓度为15%。
2.5 验证试验
按正交试验优化的处方,称取处方量的氟诺昔康及辅料,粉碎后分别过80目筛,按等量递加稀释法将药物与辅料混合均匀,加入适量10%PVP(50%乙醇溶液)的黏合剂制软材,过25目筛制粒,在60℃烘箱中干燥1 h,过20目筛整粒,再向干燥颗粒中加入适量滑石粉,混匀,即得氯诺昔康干混悬剂。同法制备 3批样品 (批号:2015061502、2015061506、2015061508),分别测定沉降体积比,结果测得3批样品的沉降体积比分别为0.98、0.99、0.98,均符合要求,表明正交试验优化的处方工艺的重复性较好。
2.6 氯诺昔康干混悬剂的质量分数测定
2.6.1 色谱条件 色谱柱:Diamonmsil C18(4.6 mm× 200 mm,5 μm);流动相:pH 5.8的0.05 mol/L醋酸钠-甲醇(体积比10∶90);流速:1.0 mL/min;检测波长:384 nm;柱温:30℃;进样量:20 μL。
2.6.2 对照品溶液的制备 精密称取氯诺昔康对照品10 mg,置于50 mL量瓶中,用流动相溶解并稀释至刻度,精密量取4 mL置于10 mL量瓶中,用流动相溶解并稀释至刻度,摇匀,即得。
2.6.3 供试品溶液的制备 精密称取本品适量(批号:2015061502,相当于氯诺昔康约 8 mg),置于100 mL容量瓶中,加适量流动相,超声(温度控制在60℃)振摇使溶解,用流动相稀释至刻度,并用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.6.4 阴性对照品溶液的制备 根据处方制备不含氯诺昔康的样品,按“2.6.3”项下制备供试品溶液的方法制备阴性对照品溶液。
2.6.5 专属性试验 分别取供试品、对照品、阴性对照品溶液各5 mL,置于10 mL容量瓶中,用流动相稀释至刻度,摇匀,分别精密量取20 μL,注入液相色谱仪中进行测定,结果见图1。可见,氯诺昔康的保留时间为7.9 min,阴性对照品在氯诺昔康对照品色谱峰相应的保留时间处没有峰出现,表明辅料对供试品中氯诺昔康的测定无干扰。
2.6.6 线性关系考察 分别量取氯诺昔康对照品溶液2、5、10、15、20、25 mL,置于25 mL容量瓶中,加流动相稀释至刻度,摇匀,用0.45 μm微孔滤膜滤过,分别精密吸取上述对照品溶液20 μL,注入液相色谱仪中,以质量浓度为横坐标,峰面积为纵坐标进行线性回归,得回归方程A=29.562ρ+496.32(r= 0.999 7),表明氯诺昔康质量浓度在6.4~80 μg/mL范围内与峰面积线性关系良好。

A.对照品;B.供试品;C.阴性对照。图1 氯诺昔康干混悬剂的HPLC色谱图Figure 1 HPLC chromatograms of lornoxicam dry suspension
2.6.7 精密度试验 取对照品溶液(80 μg/mL),分别在同一日内连续进样6次,及在6日内连续进样6次,测定氯诺昔康的峰面积,测得日内精密度RSD值为1.26%,日间精密度RSD值为1.12%,表明仪器精密度良好。
2.6.8 加样回收率试验 精密称取已知质量分数的同一批供试品(批号:2015061502)9份,每3份为一组,置于50 mL容量瓶中,分别加入相当于80%、100%、120%的氯诺昔康对照品溶液,加流动相定容,配制成高、中、低3个质量浓度各3份,摇匀,滤过,进样,计算回收率。结果测得氯诺昔康的平均回收率为99.89%,RSD为1.02%。
2.6.9 样品质量分数的测定 取不同批号的氯诺昔康干混悬剂按“2.6.3”项下方法制成供试品溶液,并按“2.6.1”项下色谱条件进样测定。结果测得3批样品的质量分数分别为99.2%、98.6%、98.3%,均大于95%,符合测定要求。
2.7 氯诺昔康干混悬剂溶出度的测定
采用浆法,分别选择水、HCl(0.1 mol/L)、磷酸盐缓冲液(pH=7.4)作为溶出介质,转速设定在50 r/min,分别在5、10、15、20、30、45、60 min时间点取样分析,同时加入同体积同温度的溶出介质。氯诺昔康干混悬剂在以上3种介质中的溶出度曲线见图2。可见,以水和HCl作为溶出介质时,氯诺昔康干混悬剂在20 min内均未完全溶出;在磷酸盐缓冲液中溶出较快且平缓,且在25 min内能够基本全部溶出。

图2 氯诺昔康干混悬剂溶出度曲线Figure 2 Dissolution curves of lornoxicam dry suspension
2.8 氯诺昔康干混悬剂稳定性研究
取3 批 样 品 (2015061502、2015061506、2015061508)按照市售复合铝箔袋包装,于25℃、60%湿度条件下放置6个月,分别于0、1、2、3、6月末取样检测平均沉降体积比、再分散性、质量分数和20 min时的溶出度,结果见表5。可见,氯诺昔康干混悬剂在上述条件下放置6个月后,各项指标无明显变化,稳定性较好。

表5 3批样品稳定性考察结果Table 5 The stability results of three batches of samples(n=3)
3 讨论
干混悬剂是将药物用适宜方法制成颗粒或粉末状的制剂,使用时加水即迅速分散成混悬剂,增加了难溶性药物在体内吸收和利用的速度和程度,提高了生物利用度[7]。干混悬剂的制备过程中选择合适的助悬剂是关键的一步,达到合格的沉降体积比是制备干混悬剂的技术难点[8]。本文在选择助悬剂时,对HPMC、黄原胶、CMC-Na进行考察,结果表明使用黄原胶和CMC-Na共同做为助悬剂时,所制得的混悬剂没有沉淀,溶解性好,沉降体积比符合要求,再分散性好。
参照文献[9]建立了测定氯诺昔康干混悬剂含量及溶出度的HPLC法,结果表明方法专属性强、灵敏、快速,结果准确、重复性好。长期(6个月)稳定性试验表明本文制备的氯诺昔康干混悬剂稳定性较好,更长时间的稳定性仍需进一步考察。
本研究结果为氯诺昔康干混悬剂的进一步研发提供了理论参考。
参考文献:
[1]瞿浩,夏玮.氯诺昔康的药理及临床应用[J].山东医药,2011,51(29):112-113.
[2]徐伟,陆军.富马酸氯马斯丁干混悬剂的制备及稳定性研究[J].天津药学,2004,16(2):27-29.
[3]周舍典,王莉,徐峰,等.55例患者应用氯诺昔康镇痛效果及其不良反应回顾性调查[J].中国药房,2005,16 (5):376-377.
[4]王忠云,黄亚辉,钱燕宁.氯诺昔康对胃癌患者术后曲马多镇痛的影响[J].临床麻醉学杂志,2003,19(10):604-606.
[5]杨戒骄,向莉,李双梅,等.头孢克肟干混悬剂制备工艺及沉降体积比影响因素研究[J].中国药房,2008,19(10):765-767.
[6]国家药典委员会.中华人民共和国药典:2015年版二部[M].北京:中国医药科技出版社,2015:附录16.
[7]宋金春,陈杏.复方阿莫西林干混悬剂的制备与含量测定[J].中国药师,2012,15(11):1606-1609.
[8]胡瑞标.头孢克洛干混悬剂的研究[D].广州:广州中医药大学,2011.
[9]张建军,高缘,樊伟明,等.高效液相色谱法测定氯诺昔康薄膜衣片的溶出度[J].中国医院药学杂志,2005,25 (5):447-448.
(责任编辑:陈翔)
中图分类号:R944.3
文献标志码:A
文章编号:1006-8783(2016)03-0275-04
DOI:10.16809/j.cnki.1006-8783.2015120404
收稿日期:2015-12-04
基金项目:湖北省自然科学基金项目(2015CKB757)
作者简介:沙峥(1989—),女,2014级硕士研究生,Email:384642983@qq.com;通信作者:张洪(1962—),男,教授,硕士生导师,从事消化系疾病治疗药物的药剂学与药理学研究,电话:027-88041911-88382,Email:zhanghongwhu@163.com。
Study on the preparation methodology and quality of lornoxicam dry suspension
SHA Zheng,ZHANG Hong,PENG Rui,ZHANG Ying,WEI Danyun
(Department of Pharmacy,Renmin Hospital of Wuhan University,Wuhan 430060,China)
AbstractObjective To study the preparation and quality of lornoxicam dry suspension.Methods The sedimentation rate and dispersion of lornoxicam dry suspension were investigated by single factor study.The prescription methodology was optimized by orthogonal design.HPLC method was used for determining the content of lornoxicam dry suspension.The dissolution behavior and stability of lornoxicam dry suspension were also been investigated.Results The optimal prescription methodology for lornoxicam dry suspension was as follows CMC-Na 8% and xanthan gun 5% as the suspending agents MCC 15% as the disintegrant and 15%PVP in 50%ethanol solution as the adhesive.The average labeled content of 3 batches of samples was 98.7%.The pH 7.4 phosphate buffer was the optimal dissolution media with fast dissolution rate and relatively smooth.The each index of suspension displayed no significant change by the stability test.Conclusion The optimized formulation process is simple feasible stable and repeatable.The preparation is in accordance with the quality requirements of dry suspension.
Key wordslornoxica dry suspension preparation methodology HPLC stability

