布鲁氏菌S2菌壳的安全性和免疫学特性研究
苗玉强,刘 军,孙 洋,纪 雪,祝令伟,周 伟,郭学军,刘 爽,陈 萍,冯书章
布鲁氏菌S2菌壳的安全性和免疫学特性研究
苗玉强1,2,刘军2,孙洋2,纪雪2,祝令伟2,周伟2,郭学军2,刘爽2,陈萍1,冯书章2
1.吉林农业大学食品科学与工程学院,长春130118;2.解放军军事医学科学院军事兽医研究所,长春130122
摘要:目的利用小鼠模型对布鲁氏菌菌壳、布鲁氏菌S2活菌和福尔马林灭活菌的安全性和免疫学特性进行比较研究。方法利用猪布鲁氏菌S2株和重组裂解质粒制备出布鲁氏菌菌壳,将布鲁氏菌菌壳、布鲁氏菌S2活菌和福尔马林灭活菌通过腹腔注射免疫小鼠,进行安全性比较分析。监测免疫后小鼠的血清抗体水平、脾脏T淋巴细胞分型,并进行免疫攻毒实验。结果与布鲁氏菌弱毒疫苗菌株S2比较,布鲁氏菌菌壳具有更好的安全性,免疫小鼠后能产生与弱毒菌株相似的血清抗体水平、脾CD3+和CD4+ T淋巴细胞反应,并具有与之相当的免疫保护作用。结论布鲁氏菌菌壳具有良好的安全性,能刺激机体产生体液免疫和细胞免疫反应,可作为预防布鲁氏菌病的新型候选疫苗。
关键词:布鲁氏菌;菌壳;安全性;免疫原性
Funded by the Scientific and Technological Development Projects of Jilin Province (No. 20100231) and the Special Fund for Agro-scientific Research in the Public Interest of China (No. 201303042)
布鲁氏菌(Brucella)是一种危害严重的人兽共患胞内寄生病原菌。布鲁氏菌可引起人、家畜、野生动物、甚至海洋哺乳动物的布鲁氏菌病[1],主要症状为发热、流产、不育、慢性关节炎及神经损伤等。布鲁氏菌病流行范围广、传染性强,严重危害人类健康和畜牧业发展,导致世界范围内的严重经济损失和公共卫生问题[2]。我国从1995年起,人布鲁氏菌病病例逐年增加[3],2010年有35 000人布鲁氏菌病病例[4]。据统计,大约有85%人布病是由于接触了布鲁氏菌感染的羊所引起[5]。
目前临床上预防布鲁氏菌病的疫苗均是弱毒活疫苗,具有一定的毒副作用,全球许多实验室正在致力于开发布鲁氏菌病新型疫苗[6]。菌壳(Bacterial ghosts)是近年来颇受关注的一种新型细菌灭活方法。菌壳一般通过噬菌体PhiX174的裂解酶E基因在细菌内表达制备而成。菌壳保留了原始细菌的脂多糖、脂质A和肽聚糖等天然的外膜结构和表面抗原,具有很好的免疫原性,因此,菌壳是一种具有良好应用前景的灭活疫苗[7]。本实验室利用广宿主穿梭质粒和裂解基因E成功制备了猪布鲁氏菌S2菌壳[8]和粗糙型羊布鲁氏菌菌壳[9],在此基础上,本研究利用小鼠模型进一步对猪布鲁氏菌S2菌壳的安全性和免疫学特性进行研究,评价其安全性、免疫原性和对小鼠模型的免疫保护作用,为将来研制布鲁氏菌菌壳疫苗提供数据。
1材料和方法
1.1菌株猪布鲁氏菌S2株、重组布鲁氏菌S2(pBBR1MCS-E)均由本实验室保存或构建[8]。
1.2实验动物6-8周龄雌性BALB/c小鼠(清洁级),体重约18~20 g/只,购自长春市生物制品研究所。
1.3主要试剂辣根过氧化物酶标记山羊抗小鼠IgG由Sigma-Aldrich公司生产;羊抗鼠CD3e PerCP-Cy5.5、CD4 FITC和CD8a PE为eBioscience公司产品;TSB培养基购自青岛海博生物技术有限公司。
1.4布鲁氏菌S2菌液、布鲁氏菌菌壳和布鲁氏菌甲醛灭活液的制备
1.4.1布鲁氏菌S2菌液的制备将1mL新鲜培养的布鲁氏菌S2接种到100 mL TSB液体培养基,37 ℃振荡培养24 h。然后于4℃,6 000r/min离心10 min。沉淀用生理盐水洗涤沉淀2次,用原始菌液等量的生理盐水重悬待用。
1.4.2布鲁氏菌S2菌壳(BrucellasuisS2 ghosts,BSG)的制备将1 mL新鲜培养的布鲁氏菌S2(pBBR1MCS-E)接种到100 mL TSB液体培养基(Kan 100 μg/mL),28℃振荡培养24h,转移至42 ℃继续振荡培养48 h。然后于4 ℃,60 00 r/min离心10 min。沉淀用5% NaCl溶液冻融2次,用生理盐水洗涤2次,然后用原始菌液等量的生理盐水重悬,分装后于-80 ℃超低温冰箱保存备用。
1.4.3布鲁氏菌S2甲醛灭活液(formalin-killedBrucella,FKB)的制备将1 mL新鲜培养的布鲁氏菌S2接种到100 mL TSB液体培养基,37 ℃振荡培养24 h后,加入甲醛溶液至终浓度为0.4%,37 ℃继续振荡培养48 h。然后于4 ℃,60 00 r/min离心10 min。沉淀用生理盐水洗涤2次,用原始菌液等量的生理盐水重悬,分装后于-80 ℃超低温冰箱保存备用。
1.4.4布鲁氏菌菌壳和甲醛灭活液中的细胞计数按文献[10]进行,具体方法:将制备的布鲁氏菌菌壳和布鲁氏菌甲醛灭活液进行10倍梯度稀释后,取清洁的Neubauer计数板,在计数区上盖上一块盖玻片,将稀释后的液体加入计数室,用光学显微镜进行计数,计算每毫升液体中的细胞数。
1.5布鲁氏菌S2菌壳的安全性实验将BABL/c小鼠,随机分为7组,每组10只。其中6组小鼠分别腹腔注射布鲁氏菌S2菌液、布鲁氏菌S2菌壳(BSG)和布鲁氏菌S2甲醛灭活液(FKB),每个样品注射2组。第7组小鼠腹腔注射生理盐水作为阴性对照,注射总体积均为200 μL/只小鼠。分组和注射剂量见表1所示。观察小鼠临床症状,记录小鼠体重变化。注射2周以后,将小鼠断颈处死,摘取小鼠的脾脏,称重。
1.6布鲁氏菌S2菌壳的免疫原性实验
1.6.1免疫小鼠6-8周龄雌性BALB/c小鼠,随机分为4组,每组10只。其中3组小鼠分别腹腔注射布鲁氏菌S2、BSG和FKB,第4组小鼠腹腔注射生理盐水作为阴性对照。S2菌注射免疫剂量为106CFU/只小鼠,BSG和FKB注射免疫剂量相当于原活菌量为107CFU/只小鼠。每组小鼠均注射免疫2次,注射间隔为4周。
1.6.2小鼠血清抗体水平的检测每组免疫小鼠取5只,初次免疫后,每隔1周对小鼠断尾采血,分离血清,以生理盐水注射组小鼠血清为阴性对照,用ELISA方法测定血清中IgG抗体效价。将布鲁氏菌S2培养液离心后用包被液洗涤、重悬、稀释后,加入到ELISA板包被,二抗为辣根过氧化物酶标记山羊抗小鼠IgG,检测血清IgG抗体效价。
1.6.3小鼠脾脏T淋巴细胞亚型分析每组免疫小鼠取5只,末次免疫后第14 d,将小鼠断颈处死,无菌摘取小鼠脾脏进行T淋巴细胞亚型分析。用200目的尼龙网筛分离脾淋巴细胞,Tris-NH4C1室温作用5 min破碎红细胞,用预冷的PBS重悬细胞。用台盼蓝染色计算活细胞数,并调整细胞浓度为2×106cells/mL。试验组和对照组小鼠脾淋巴细胞各取100 μL细胞悬液,分别加入3种标记抗体(羊抗鼠CD3e PE-Cy5、CD4 FITC和CD8a PE)各5 μL,室温孵育20 min。用预冷的PBS洗涤后,加入0.5 mL PBS重悬细胞,用流式细胞仪(FCM)进行检测。每个样品检测10 000个细胞,分析T淋巴细胞亚型比例。
1.7布鲁氏菌S2菌壳的免疫攻毒实验6-8周龄雌性BALB/c小鼠,随机分为3组,每组5只。3组小鼠分别腹腔注射布鲁氏菌S2(阳性对照)、BSG和PBS(阴性对照)。S2菌注射免疫剂量为106CFU/只小鼠,BSG注射免疫剂量相当于原活菌量为107CFU/只小鼠。每组小鼠均注射免疫2次,注射间隔为4周。注射免疫2周后,用马尔他布鲁氏菌16M(B.melitensis16M)腹泻注射攻毒,攻毒剂量为105CFU/只小鼠。攻毒2周后,将所有小鼠断颈处死,无菌摘取脾脏,按文献[11]方法统计比较不同组小鼠脾脏载菌量。
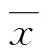
2结果
2.1布鲁氏菌S2菌壳对小鼠的安全性实验注射布鲁氏菌S2、布鲁氏菌菌壳(BSG)和福尔马林灭活菌(FKB)后,小鼠的临床症状见表1所示,各组小鼠体重变化曲线见图1所示。结果表明,注射S2组小鼠出现体重急剧下降、精神沉郁、耸毛、颤抖、死亡等临床表现,其中108CFU剂量组小鼠全部死亡。而
注射BSG和FKB组小鼠与阴性对照组小鼠相似,均未出现明显临床症状,体重变化曲线一致。说明布鲁氏菌S2菌壳对小鼠具有良好的安全性。

图1注射布鲁氏菌小鼠S2、布鲁氏菌菌壳(BSG)和福尔马林灭活菌(FKB)小鼠平均体重变化曲线
Fig.1Mean weights of mice following injection ofB.suisS2,B.suisghosts (BSG) and formalin-killedB.suis(KFB)
实验小鼠平均脾脏重量见表1所示,S2组小鼠脾脏表现极度肿大,平均脾脏重量约为0.406 g,与其它组差异显著;FKB组和BSG小鼠脾脏无肿大现象,平均脾脏重量与阴性对照组相似,无显著差异。

表1 不同剂量猪布鲁氏菌S2、布鲁氏菌菌壳(BSG)和福尔马林灭活菌(FKB)对小鼠的致病性
a Dosages of BSG and FKB are presented as the number of corresponding dead bacteria.
b A: Depression; B: ruffled hair; C: trembling; D: death (all death happened in 4 days after injection.); None: no clinical symptoms.
2.2小鼠血清抗体水平检测从S2、BSG和FKB免疫组小鼠血清中均能检测到特异性抗体,BSG组小鼠免疫后第6~7周血清抗体效价达到最高(图2)。BSG免疫组小鼠抗体效价略高于布鲁氏菌S2免疫组小鼠,二者之间差异无统计学意义。BSG免疫组小鼠和S2免疫组小鼠的血清抗体效价显著高于FKB组小鼠的血清抗体效价。结果表明布鲁氏菌菌壳可刺激机体产生与活疫苗S2相似的体液免疫水平。
2.3小鼠T淋巴细胞亚群分析各组小鼠脾脏T淋巴细胞经处理后经流式细胞仪检测,结果T淋巴细胞亚群比例见表2所示。与FKB免疫组小鼠和阴性对照组比较,BSG免疫组和S2免疫组小鼠脾脏T淋巴细胞中CD3+和CD4+细胞比例显著升高,而BSG免疫组与S2免疫组的CD3+和CD4+细胞差异无统计学意义。

图2 腹腔注射组小鼠血清抗体水平
Fig.2Induction of specific IgG antibodies by different vaccine preparation
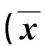
表2 实验小鼠脾脏T淋巴细胞亚群分析结果(%) ±s)
Note:*Compared with the control saline group,P<0.05.
2.4免疫攻毒实验用布鲁氏菌16M株攻毒后,各组小鼠的脾脏载菌量如表3所示。其中BSG组和S2免疫组小鼠的脾脏载菌量显著低于PBS对照组。BSG组和S2组的保护单位(Units of protection)分别为1.54和1.74,两组小鼠的脾脏载菌量无显著差异,说明布鲁氏菌菌壳具有与活疫苗S2相似的免疫保护效果。
表3小鼠免疫攻毒实验结果
Tab.3Protection against B. melitensis 16M provided to BALB/c mice by vaccination with B. suis S2 ghosts

Treatmentgroup(n=5)Log10CFUofB.melitensis/spleenaUnitsofprotectionbBrucellaghosts(BSG)3.54±0.0251.54cBrucellavaccineS23.34±0.1711.74cPBScontrol5.08±0.121-
Note:aThe number of bacteria in spleens (CFU/spleen) is represented as the mean logCFU SD per group.
bUnits of protection were obtained by subtracting the mean log CFU/spleen of the vaccinated group from the mean log CFU/spleen of the control (PBS) group.
cSignificantly different compared to PBS controls group (P< 0.05).
3讨论
免疫预防是防控布病疫情的最佳方法之一,当前临床使用的疫苗均为弱毒活疫苗,普遍存在着一定毒副作用,尤其对于孕畜及幼龄动物更是如此。
猪布鲁氏菌S2株是在我国广泛使用的活疫苗菌株,2011年已完成了该菌株的全基因组测序[12]。由于布鲁氏菌S2株属于弱毒活疫苗,仍然具有一定的毒力,在临床使用上还存在安全隐患。本实验室利用重组穿梭裂解质粒成功制备出了布鲁氏菌S2菌壳[8]。布鲁氏菌菌壳属于灭活疫苗,理论上其安全性应优于弱毒活疫苗,本研究对布鲁氏菌菌壳与活疫苗S2安全性的比较研究也证实,布鲁氏菌菌壳的安全性显著高于活疫苗S2菌株,即使菌壳的接种剂量高于S2剂量的100倍以上,其对小鼠的影响仍然显著小于S2。布鲁氏菌菌壳的安全性与甲醛灭活菌的安全性相当。
国内外对于评价布鲁氏菌病疫苗的常用方法为计算脾脏载菌量[13-14],本研究也采用攻毒后计算小鼠脾脏载菌量的方法评价布鲁氏菌菌壳的免疫保护效果,并检测免疫小鼠的血清抗体水平和脾脏T淋巴细胞分型。小鼠血清抗体IgG检测结果表明,布鲁氏菌菌壳与S2活菌刺激小鼠产生的抗体水平相当,均显著高于FKB免疫组和阴性对照组。说明腹腔注射后布鲁氏菌菌壳可刺激机体产生与活疫苗S2水平相似的体液免疫反应。小鼠脾脏T淋巴细胞亚型分析表明,布鲁氏菌菌壳与活疫苗S2都能有效激活小鼠的细胞免疫反应,而且这者之间的细胞免疫水平并无显著差异。
用布鲁氏菌16M株攻毒后,布鲁氏菌菌壳免疫组和活疫苗S2免疫组小鼠的脾脏载菌量显著低于对照组,两组小鼠的脾脏载菌量无显著差异,其免疫保护单位(Units of protection)分别为1.54和1.74,说明布鲁氏菌菌壳具有与活疫苗S2相当的免疫保护作用。
综合本研究结果,与布鲁氏菌S2活疫苗菌株比较,布鲁氏菌菌壳具有更好的安全性和与之相当的免疫保护效果,可以作为预防布鲁氏菌病的新型候选疫苗,但布鲁氏菌菌壳作为疫苗的有效性和特异性免疫机制还有待深入研究。
参考文献:
[1]Cutler SJ, Whatmore AM, Commander NJ. Brucellosis--new aspects of an old disease[J]. J Appl Microbiol, 2005, 98(6): 1270-1281. DOI:10.1111/j.1365-2672.2005.02622.x
[2]Perkins SD, Smither SJ, Atkins HS. Towards aBrucellavaccine for humans[J]. FEMS Microbiol Rev, 2010, 34(3): 379-394. DOI: 10.1111/j.1574-6976.2010.00211.x
[3]Deqiu S, Donglou X, Jiming Y. Epidemiology and control of brucellosis in China[J]. Vet Microbiol, 2002, 90(1-4): 165-182. DOI: 10.1016/S0378-1135(02)00252-3
[4]Qiu J, Wang W, Wu J, et al. Characterization of periplasmic protein BP26 epitopes ofBrucellamelitensisreacting with murine monoclonal and sheep antibodies[J]. PLoS One, 2012, 7(3): e34246. DOI: 10.1371/journal.pone.0034246
[5]Zhang WY, Guo WD, Sun SH, et al. Human brucellosis, Inner Mongolia, China[J]. Emerg Infect Dis, 2010, 16(12): 2001-2003. DOI: 10.3201/eid1612.091081
[6]Tabynov K, Sansyzbay A, Kydyrbayev Z, et al. Influenza viral vectors expressing theBrucellaOMP16 or L7/L12 proteins as vaccines againstB.abortusinfection[J]. Virol J, 2014, 11: 69. DOI:10.1186/1743-422X-11-69
[7]Lubitz P, Mayr UB, Lubitz W. Applications of bacterial ghosts in biomedicine[J]. Adv Exp Med Biol, 2009, 655: 159-170. DOI: 10.1007/978-1-4419-1132-2_12
[8]Liu S, Liu J, He Y, et al. Generation and characterization ofBrucellasuisS2 ghosts[J]. Chin J Zoonoses, 2012, 28(7): 679-682. (in Chinese)
刘爽, 刘军, 何永聚, 等. 布鲁氏菌S2株菌壳的制备研究[J]. 中国人兽共患病学报, 2012,28(7):679-682.
[9]Zhang RA, Liu J, Jiang DW, et al. Preparation and characterization ofBrucellamelitensisrough vaccine strain M111 ghosts[J]. Chin J Vet Sci, 2014, 34(1): 66-69. (in Chinese)
张瑞安, 刘军, 蒋大伟, 等. 粗糙型布鲁菌M111菌壳的制备[J]. 中国兽医学报, 2014,34(1):66-69.
[10]Tu FP, Chu WH, Zhuang XY, et al. Effect of oral immunization withAeromonashydrophilaghosts on protection against experimental fish infection[J]. Lett Appl Microbiol, 2010, 50(1): 13-17. DOI: 10.1111/j.1472-765X.2009.02746.x
[11]Adone R, Ciuchini F, Marianelli C, et al. Protective properties of rifampin-resistant rough mutants ofBrucellamelitensis[J]. Infect Immun, 2005, 73(7): 4198-4204. DOI: 10.1128/IAI.73.7.4198-4204.2005
[12]Ding J, Pan Y, Jiang H, et al. Whole genome sequences of fourBrucellastrains[J]. J Bacteriol, 2011, 193(14): 3674-3675. DOI: 10.1128/JB.05155-11
[13]Jain S, Afley P, Dohre SK, et al. Evaluation of immunogenicity and protective efficacy of a plasmid DNA vaccine encoding ribosomal protein L9 ofBrucellaabortusin BALB/c mice[J]. Vaccine, 2014, 32(35): 4537-4542. DOI: 10.1016/j.vaccine.2014.06.012
[14]Zhang J, Guo F, Chen C, et al.Brucellamelitensis16MΔhfq attenuation confers protection against wild-type challenge in BALB/c mice[J]. Microbiol Immunol, 2013, 57(7): 502-510. DOI: 10.1111/1348-0421.12065
DOI:10.3969/j.issn.1002-2694.2016.03.008
通讯作者:冯书章,Email: shuzhangf@yahoo.com;
中图分类号:R378.5
文献标识码:A
文章编号:1002-2694(2016)03-0251-05
Corresponding author:Liu Jun, Email: liujunbio@yahoo.com
收稿日期:2015-04-15;修回日期:2016-01-28
Safety and immunogenicity of Brucella suis strain S2 ghosts
MIAO Yu-qiang1,LIU Jun2,SUN Yang2,JI Xue2,ZHU Ling-wei2,ZHOU Wei2,GUO Xue-jun2,LIU Shuang2,CHEN Ping1,FENG Shu-zhang2
(1.FoodScienceandEngineering,JilinAgriculturalUniversity,Changchun130118,China;2.InstituteofMilitaryVeterinaryScience,theAcademyofMilitaryMedicalScienceofPLA,Changchun130122,China)
Abstract:With the purpose of investigating the safety and immunogenicity of Brucella suis strain S2 bacterial ghosts as a vaccine candidate, the recombinant strain S2(pBBR1MCS-E) was used for production of B. suis ghosts (BSG). The safety and immunogenicity of BSG were evaluated by using a murine model. The results suggested that BSG was as safe as formalin-killed B. suis. Compared with the B. suis strain S2, BSG demonstrated similar capacity of inducing pathogen-specific serum IgG antibody response, spleen CD3+ and CD4+ T cell responses, as the attenuated B. suis live vaccine. The results of mice immunization and infection showed that BSG could significantly reduce the number of bacteria in the spleens. These data suggest that Brucella ghosts could confer protection against Brucella infection and may be developed as a new vaccine candidate against Brucella infection.
Keywords:Brucella; bacterial ghosts; safety; immunogenicity
吉林省科技发展计划资助项目(20100231);公益性行业(农业)科研专项(201303042)
刘军,Email: liujunbio@yahoo.com

