动物类鼻疽的流行病学、诊断及其防治
王治才,赵俊亮1,2,赵华林,董 林(1.海南省热带草食家畜生物工程技术研究中心,海南 三亚 572000;2.新疆呼图壁奶牛场,新疆 呼图壁 831200;3.海南省农业科技110三亚畜牧兽医服务站,海南 三亚 572000)
动物类鼻疽的流行病学、诊断及其防治
王治才1,3,赵俊亮1,2,赵华林1,3,董林1,3
(1.海南省热带草食家畜生物工程技术研究中心,海南三亚572000;
2.新疆呼图壁奶牛场,新疆呼图壁831200;
3.海南省农业科技110三亚畜牧兽医服务站,海南三亚572000)
摘要:类鼻疽是一种主要分布在热带和亚热带地区的人畜共患新发传染病。该病以败血症和感染动物实质脏器以及皮肤等器官形成化脓性结节为特征。本文根据国内外相关文献资料,结合作者对家畜类鼻疽临床病例的诊断与治疗,对该病的流行病学、生态学、病原学以及动物感染后的临床症状、诊断和防治进行了介绍,以期为相关技术人员提供该病诊断和治疗方面的新信息。
关键词:动物类鼻疽;流行病学;临床症状;治疗与预防
10.16863/j.cnki.1003-6377.2016.03.001
类鼻疽 (Melioidosis)是由假单胞杆菌属 (Pseudomonas)的类鼻疽伯克霍尔德菌 (Burkholderia pseudomallei,即B.pseudomallei)感染引起的一种主要分布在热带和亚热带地区的地方性人畜共患新发传染病。该病以败血症和感染动物的脾、肺、肝、肾、脑、睾丸、关节以及皮肤等组织器官形成化脓性结节为特征。类鼻疽伯克霍尔德菌对多种常用抗生素有很强耐药性,目前尚无针对该病的有效疫苗。世界卫生组织(WHO)已将其列为B类生物恐怖战剂。我国广东、广西、福建、海南、香港、台湾、等地区为人畜类鼻疽重要的流行区域。我国对于动物类鼻疽的研究和报道资料较少。本文根据国内外相关文献资料,结合作者临床病例的诊断与防治,对该病进行介绍,以期为相关技术人员提供该病诊断和治疗方面的新信息。
1 类鼻疽的生态学与流行病学
类鼻疽最初于1911年由法国科学家Whitmore和Krishnaswami在缅甸鉴定和确认。该菌主要分布于南、北纬20°之间的热带和亚热带地区。其中,以东南亚和澳大利亚北部报道较多,我国广东、广西、福建、海南、台湾、香港也有报道。早期的研究还认为,类鼻疽是一种人畜共患病,啮齿类动物是主要宿主。此后的研究进一步发现,消化道是主要感染渠道,这种感染主要是摄入了带菌啮齿类排泄物污染的食物所致。法国研究人员在印度支那对类鼻疽的生态学研究发现,感染总是发生于接触泥土和池塘水后;野生啮齿类带菌但基本不被感染;利用人工培养基可从热带地区的泥土、池塘水以及稻田泥土中可分离出类鼻疽假单胞杆菌(B.Pseudomallei)。由此认为,类鼻疽杆菌是一种环境腐生菌,人和动物如果接触了土壤和浅表水中的菌均可能被感染。近年的研究表明,该菌广泛存在于热带和亚热带地区的腐生环境。类鼻疽疫区主要分布在澳大利亚北部、东南亚以及我国华南沿海的一些地区。其它地区,如欧洲、北美也有零散病例报道,但多为热带和亚热带地区感染动物的引入病例。目前,该病流行的严峻性并不为人们所警觉。
类鼻疽杆菌在流行疫区并非均匀分布。许多可变因素如:气象因素(温度、降雨量、光照)、土壤成分(物理、化学、生物特性)等影响其分布。类鼻疽主要是一种热带和亚热带疫病,温度和降雨对该病的传播和疫病流行影响很大。研究表明,该菌对环境因素有很强的适宜性或抵抗力,可在非常不利的环境下存活。最适宜生长温度为37℃~42℃,体外存活的最适温度24℃~32℃,在土壤中可生存36个月。降雨和类鼻疽流行有明显关联性。降雨量少的国家和地区环境中的类鼻疽杆菌和类鼻疽病例稀少。像泰国这样的疫区,75%的病例均发生于雨季。在澳大利亚季风暴雨时节类鼻疽病例猛增。雨季地表水和土壤中的类鼻疽杆菌分离率明显提高。
土壤类型以及PH对类鼻疽杆菌分布也有较大影响。研究发现该菌多存在于在沙壤土和黏土中,该菌生长最适PH为6.8。同时也发现在实验条件下,PH5.0和8.0也生长很好。感染动物以及病人的痰、脓液、尿液、粪便均携带有类鼻疽杆菌,且以此污染环境。人类也可不经意的从热带植物园引入污染土壤或带水热带鱼而造成环境污染和疫情传播。
多种动物物种包括骆驼、马、羊、牛、山羊、猪、袋鼠、考拉、羊驼、鹿、猫、狗和圈养海洋动物对类鼻疽易感。其中,山羊的易感性较高。鸟类虽然有类鼻疽病例报告,但相对有抵抗力。在流行区有进口动物爆发流行性疫情的报告。在荷兰的Aruba岛,类鼻疽杆菌曾经引发了绵羊、山羊、猪的群发性的疫情。在海南也有山羊群发性类鼻疽疫情。1970年巴黎动物园爆发的一次疫情传播到了全法国其它动物园和马术俱乐部,导致2个人和许多动物死亡。这次疫情被认为是由异国进口带菌马匹和观赏动物引起。
人群对类鼻疽杆菌普遍易感。本病潜伏期一般为(4~5)d,但也有感染后数月、数年甚至有长达20年后发病,即所谓“潜伏型类鼻疽”。此类病例也常因外伤或其它疾病而诱发。不同家畜类鼻疽感染的潜伏期则有待进一步研究。人或动物感染类鼻疽杆菌后会产生多种不同的临床结果:没有反应,或仅出现血清学阳性,或产生明显的临床症状。感染后所出现的结果由感染量、感染菌株的毒力、机体的易感性、动物的品种以及动物已经存在的基础疾病决定。其中,最重要的决定因子是宿主的易感性。
2 类鼻疽的病原学与致病机理
类鼻疽病原体为假单胞菌属(Pseudomonas)的类鼻疽伯克霍尔德菌。假单胞菌属细菌目前已超过200种,与人类关系较大的有铜绿假单胞菌、荧光假单胞菌、鼻疽假单胞菌、类鼻疽伯克霍尔德菌等。类鼻疽伯克霍尔德菌因其形态和培养特性与鼻疽假单胞菌相似,血清学上又有明显交叉反应而将其命名为类鼻疽假单胞菌或伪鼻疽杆菌。类鼻疽杆菌为革兰阴性球杆菌,长(1~2)μm,宽(0.5~0.8)μm,多单在,偶成对或丛集,无芽胞,有鞭毛和菌毛,氧化酶、触酶均阳性。普通染色常见两极浓染,感染脏器样品抹片染色可见菌体周围有不着色的白圈,即所谓伪荚膜。该菌为需氧菌,在加甘油的普通培养基上生长良好。用含有多黏菌素的改良ASA培养基培养(24~48)h形成紫色、干燥、具有皱摺的菌落。有学者设计出了一种可用于该菌鉴别培养的选择培养基BPSA,不仅对肠球菌、埃希菌属、链球菌属和葡萄球菌属细菌有抑制作用,而且所形成的菌落形态很容易区别于铜绿假单胞菌、洋葱伯克霍尔德菌和其它伯克霍尔德菌。
自1992年Yabuuchi等正式对假单胞属菌进行描述以来,基于16S rRNA基因的序列鉴定确定该属菌有15种以上的生物型。除了类鼻疽和马鼻疽外,绝大多数属于土壤腐生性菌和植物病原菌。泰国的研究发现,该国存在2种可以通过生物化学方法行鉴别(对阿拉伯糖同化作用的差异)的伯克霍尔德菌生物型即Ara-型和Ara+型。进一步的研究表明,两种生物型在疫区土壤中均有分布,但在不同地区,其中一种生物型占优势,且在动物模型的毒力上也有明显差异。这种差异表现在蛋白酶,脂肪酶,卵磷脂和其它酶与脂多糖组合物中的分泌上。
类鼻疽伯克霍尔德菌可以产生多种具有不同生物学活性的物质,引起组织坏死、溶血、细胞溶解和死亡。已经确定的与毒力相关的基因有36-KD的金属蛋白酶基因、脂酶基因、碱性磷酸酶C基因、脂酶基因、溶血素基因等,所分泌的产物如:蛋白酶、脂肪酶、卵磷脂、各种毒素以及铁载体均与细菌毒力相关。但不同毒力因子对疾病发展的作用还不清楚。
人或动物感染了类鼻疽杆菌后的结果因动物种类与个体的不同,临床表现差异很大,从仅仅血清学转阳(最常见形式)到暴发性脓毒症和死亡。最终的归宿取决于感染的途径、感染量、细菌毒力、感染个体对感染菌的相互反应。类鼻疽菌在细胞内生长繁殖和在肉芽肿内新陈代谢停止但保持活力的特性是该菌感染的顽固性和持续性的重要原因。在宿主方面,先天性的免疫机制、巨噬细胞和嗜中性细胞功能、体液免疫和细胞免疫均在抗类鼻疽杆菌中发挥作用。各种导致宿主体液免疫和细胞免疫功能减低的基础性疾病均可诱发该病的急性发作。
3 动物类鼻疽的临床症状与病理变化
该病临床表现可分为急性、慢性和隐性三种形式,不同动物以及同种动物不同品种对该菌感染敏感性差异也很大。根据澳大利亚研究人员对10种动物类鼻疽病例的观察发现,山羊对该病最敏感,其次是绵羊、猪(表1);感染最常见的形式是在不同器官或组织形成单个或多个大小不同的化脓性结节或脓肿。在动物中,最常见感染器官是脾、肺、睾丸、肝以及相关淋巴结、关节(表2)。

表1 自1992年以来对澳大利亚北部10种动物类鼻疽敏感性的检测
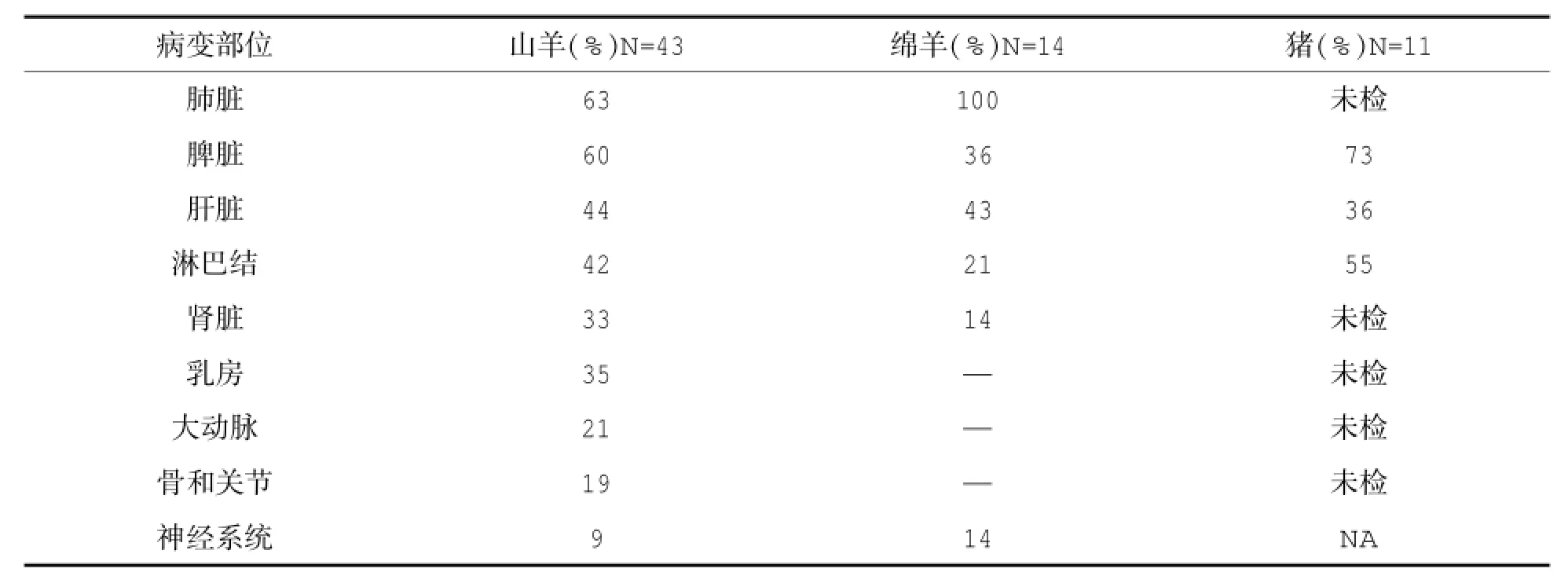
表2 1992-1997年间澳大利亚北部动物类鼻疽病变分布情况
在澳大利亚,多种动物出现类鼻疽性中枢神经系统疾病。在北澳地区,12%(5/43)的山羊、14%(2/14)的绵羊发现有中枢神经系统病变,病理学检查显示绝大多数病变属微小脓肿或淋巴细胞浸润。在类鼻疽感染羊中,35%(15/43)的山羊出现乳房炎。曾有报道,人类鼻疽感染后出现类鼻疽性主动脉瘤;北澳的研究表明,山羊更多发类鼻疽性主动脉瘤。对类鼻疽羊解剖发现,21%(9/43)的山羊有主动脉损伤,其中9只羊因主动脉瘤死亡。有报道称,该病可以通过胎盘传播。猪的感染常见无症状器官脓肿,但牛类鼻疽感染非常罕见。
我们对我国热带地区百余例山羊类鼻疽病例的观察发现,这些地区山羊类鼻疽的临床症状与解剖病变与国外文献报道有所不同。该病在一个疫点流行时,初期的病例多表现为最急性,无明显临床症状即死亡,剖解也无明显肉眼可见脏器病变。随后转为急性,羊只体温升高至41.5℃以上,精神沉郁,食欲减退,常用抗生素治疗无效,发病48 h左右即死亡;剖解可见肺部充血性炎症和化脓性病灶,脾脏有多个黄豆或花生粒大小的化脓性结节,脑膜表明血管充血。亚急性病例的的病程一般在(3~5)d,临床多出现败血症的多种综合性症状,超过30%的病例出现跛行甚至不能站立,腕关节肿大;部分种公羊睾丸肿大,怀孕母羊流产;剖解可见脾脏、肺脏、肾脏、肝脏有数个花生米大小甚至更大的化脓性结节,肺部充血、化脓性炎症。个别死亡羊只剖解可见胸腔大量积血,疑似主动脉类鼻疽结节导致主动脉破裂。慢性病例主要表现为消瘦、跛行、精神沉郁,部分病例2~3周后死亡。该病疫群发病率超过30%,发病死亡率约在70%以上。对发病地区疫群的观察分析发现,同样为山羊,不同品种山羊对类鼻疽的易感性有很大差异。从病羊的解剖病变看,急性、亚急性病例甚至外表健康的隐形病例脾脏出现化脓性结节的概率几乎达100%,肺脏出现肉眼可见化脓性结节的概率约70%以上,其次为肾脏、睾丸,肝脏出现化脓性结节的比率较低。
4 类鼻疽的诊断与检测
由于家畜感染类鼻疽后无特征性临床症状,仅凭对发病家畜的临床观察很难作出诊断。一般可通过疫群所处的特定生态环境—热带、亚热带地区以及病死畜的特征性解剖病变—实质性脏器化脓性结节进行初步诊断。确诊必须进行病例血液或组织样品中类鼻疽杆菌的分离培养和鉴定。
用添加一定量甘油、结晶紫、庆大霉素的胰蛋白酶大豆琼脂(TSA)制备的Ashdown's选择琼脂,可用于样品中鼻疽伯克霍尔德菌的分离培养。37℃培养(24~48)h生长出紫色、干燥、具有皱摺的菌落即可推测类鼻疽伯克霍尔德菌的感染。对分离出的菌株进行生化或分子生物学的鉴定可进一步与假单胞杆菌属的其它细菌区别。
目前,还没有家畜类鼻疽感染的标准化血清学检测方法。在疫区,应用最广的是用粗制抗原制备的间接血凝试验(IHA)进行该菌感染的筛选。尽管目前已经有许多新的检测方法在不断的建立,但大多数检测方法的敏感性和特异性不尽人意,特别是在流行背景不清的地区,那里人与动物的血清学阳性率可能较高。在非疫区,当检测血清样品的IHA≧1:40就可判定为类鼻疽阳性。在疫区,只有当血清抗体效价明显升高或效价很高并伴有相应临床症状,则可怀疑为类鼻疽。
类鼻疽伯克霍尔德菌抗原检测方法有多种,如标本或血培养物的直接抗原检测、对培养物进行鉴定的胶乳凝集试验和对样品的直接免疫荧光检测等。检测培养液中的外毒素和40kDa分泌蛋白的酶联免疫吸附试验(ELISA),以及利用单克隆抗体检测细胞壁成分(包括脂多糖、30kDa蛋白和外多糖)的抗原检测等均具有较高的敏感性和特异性,但这些试剂尚无商品供应,很少在临床实际中应用。针对类鼻疽伯克霍尔德菌曾建立了一系列分子生物学检测方法,但几乎都未经田间试验检验。小规模临床应用检测表明,使用针对该菌16S RNA设计的引物进行PCR检测敏感性达100%,但特异性较低。针对类鼻疽伯克霍尔德菌bimA(Bm)基因设计特异性引物,采用实时聚合酶链反应(PCR)方法可用该菌与马鼻疽伯克菌鉴别。
5 家畜类鼻疽的防治
由于类鼻疽伯克霍尔德菌具有细胞内寄生和广泛耐药的特性,家畜一旦被感染并表现出临床症状,很难治愈。畜群类鼻疽的感染往往是预防,而不是治疗。对于该病的免疫预防,国外已进行了多年研究,但目前还没有临床应用的报道。
根据英国牛津大学热带医学中心对人类鼻疽25年的研究和治疗实践,总结出了一套治疗规程。他们的研究和治疗表明,头孢他定对类鼻疽伯克霍尔德菌的敏感性达99.1%,对亚胺培南 (泰能)敏感性达100%,疗效最好。此外,氯霉素类、强力霉素、磺胺类、四环素类对该菌也有一定的抑制作用。对于人类鼻疽急性病例,首选头孢他定或亚胺培南(泰能)静脉滴注(10~14)d,同时给予复方新诺明(甲氧苄胺嘧啶-新诺明)维持治疗(10~12)周,可明显降低死亡率。此外还可以用β丙酰胺或β丙酰胺酶抑制剂,如阿莫西林-克拉维酸甲(增效剂)和头孢氧哌羟苯唑-舒巴坦纳(增效剂)并口服氯霉素(8周)+强力霉素和复方新诺明(20周),三药联合使用疗效优于单一药物治疗。即使经过20周维持治疗,仍有10%的复发率。如果按该规程治疗家畜类鼻疽,不仅治疗费用昂贵,而且所用的主要药物也不允许用于动物。作者参考人类鼻疽治疗方案,采用头孢噻呋钠肌肉注射和复方新诺明+盐酸多西环素拌料对发病初期的山羊进行治疗,连续(7~10)d投药具有一定的疗效。对于疫点受威胁羊只,仅采用复方新诺明+盐酸多西环素拌料对发病初期的山羊进行治疗,连续(7~10)d投药也具有一定的预防效果。对处于急性期的病例或临床症状明显病例则不主张治疗,应迫杀并进行无害化处理。
家畜类鼻疽平时的预防措施主要包括把家畜从有传染源的地方移开;在热带和亚热带地区,家畜应养殖在水泥或其它材料铺设的圈舍,将家畜从地面隔开。家畜饮用水应进行氯化消毒。养殖场一定要做好灭鼠工作,以防啮齿类动物通过粪便污染饲草料和饮水而造成家畜感染。此外,作好家畜基础疫病如巴氏杆菌、支原体等的感染预防,以防诱发类鼻疽的爆发和流行。
致谢:对中国农科院哈尔滨兽医研究所余力研究员和中国农科院兰州兽医研究所储岳峰博士在临床病例类鼻疽伯克霍尔德菌的微生物学和分子生物学方面的鉴定以及防治指导表示感谢。
参考文献:
[1]任春艳,李倩.类鼻疽伯克霍尔德致死因子[J].微生物学免疫学进展,2015(3):47-50.
[2]毛旭虎.加强类鼻疽的研究[J].第三军医大学学报,2011,33(13):1315-1317.
[3]刘青芹,段雄波,李金钟.类鼻疽伯克霍尔德菌分离鉴定进展[J].中国人兽共患病学报,2008,24(10):270-273.
[4]David A.B.Dance.Ecology of Burkholderia pseudomallei and the interactions between environmental Burkholderia spp.And human—animal hosts[J].Acta Tropica 2000,(74):159-168.
[5]Stanton,A.T,Fletcher,W.Melioidosis[M].Studies from the Institute of Medical Research,Federated Malay States,21,1932,Bale and Danielson Ltd.
[6]David A.B.Dance.Melioidosis,Manson's Tropical Infectious Diseases[M].(Twenty-Third Edition),2014, 410-415.
[7]Tararaj Dharakul and Sirirurg Songsivilai.The many facets of melioidosis[J].Trends in Microbiology, 1999,7(4):138-139.
[8]Jodie Low Choya,Mark Mayoa,Anton Janmaatb,et al.Animal melioidosis in Australia[J].Acta Tropica, 2000(74):153-158.
[9]Donald E.Woods,David DeShazer,Richard A et al.Current studies on the pathogenesis of melioidosis[J]. Microbes and Infection,1999,(2):157-162.
[10]Allen C.Cheng,Bart J.Currie.Melioidosis:Epidemiology,Pathophysiology,and Management[J].Clin Microbiol Rev[J].2005,18(2):383-416.
[11]Peacock SJ,Chieng G,Cheng AC,et al.Comparison of Ashdown's medium,Burkholderia cepacia medium, and Burkholderia pseudomallei selective agar for clinical isolation of Burkholderia pseudomallei[J].J Clin Microbiol,2005,43(10):5359-5361.
[12]David A.B.Dance,Melioidosis as an emerging global problem[J].Acta Tropica,2000,(74):115-119.
[13]Mitali Sarkar-Tyson,Richard W.Titball,Progress Toward Development of Vaccines Against Melioidosis: A Review[J].Clinical Therapeutics,2010,32(8):1437-1444.
[14]David Dancea,Treatment and prophylaxis of melioidosis[J].International Journal of Antimicrobial Agents,2014,(43):310-318.
中图分类号:S852
文献标识码:A
文章编号:1003-6377(2016)03-0001-06
基金项目:海南省重大科技计划项目“海南黑山羊规模化健康养殖关键技术研究与集成运用”。
作者简介:王治才(1955-),男,甘肃高台人,研究员,主要从事动物传染病的诊断与防治研究。
收稿日期:2016-01-20,修回日期:2016-02-02
Epidemioloy,Diagnosis and Prophylaxis of Animal Melioidosis
WANG Zhi-cai1,3,ZHAO Jun-liang1,2,ZHAO Hua-lin1,3,DONG Lin1,3
(1.Hainan Bioengineering Technology Researcher Center of Tropical Herbivorous Animal,Sanya 572000, China;2.Xinjiang Hutubi Dairy Farm,Hutubi Xinjiang 831200,China;3.Sanya Animal Husbandry and Veterinary Service Station of Hainan Agricultural Science 110,Sanya 572000, China)
Abstract:Melioidosis is an emerging infectious zoonotic disease mainly distributed in tropical and subtropical regions.It is characterized by sepsis and formation of purulent nodules in parenthetical organs and skin of infected animals.In this paper,the progresses of epidemiology,diagnosis,treatment and prophylaxis of animal melioidosis are introduced according to the author's clinic experiment and relevant documentations both home and abroad to provide reference for related technicians.
Key words:animal melioidosis;epidemioloy;clinical symptoms;treatment and prophylaxis

