饲料污染物呕吐毒素对单胃动物家禽和猪肠道的影响(续)
张 江 译自J. Appl. Toxicol,2015,35:327~337何 闪 制图表
饲料污染物呕吐毒素对单胃动物家禽和猪肠道的影响(续)
张 江 译自J. Appl. Toxicol,2015,35:327~337
何 闪 制图表
上期回顾:上一期介绍了猪禽对呕吐毒素毒性的易感性,呕吐毒素对肠道上皮细胞的细胞毒性作用,对生理黏膜防御的影响,对肠道形态完整性的影响。
2.4 呕吐毒素对营养素肠道吸收的影响
在饲喂呕吐毒素污染饲料的鸡中首次观察到D-葡萄糖等多种关键营养素的肠道转运和摄取受到影响,这种影响也与动物生长速度较差有关。不过,呕吐毒素对体内营养素吸收的影响知之甚少。我们是首个建立体外方法以研究呕吐毒素对营养素转运和摄取的影响以及利用尤斯灌流室技术研究分离的鸡肠道黏膜电生理特性的团队之一。我们通过测定摄入不同剂量的呕吐毒素或不同暴露时间的鸡分离的肠道组织的短路电流(Isc)、跨上皮离子电导(Gt)或跨膜电阻(TEER)对离子转运、肠道屏障完整性和功能来进行评估。总体而言,该研究表明,加入D-葡萄糖或L-脯氨酸后提高了Isc,而在摄入呕吐毒素的家禽中该指标降低(表1),这表明呕吐毒素改变了葡萄糖或L-脯氨酸诱导的Isc,进而使得肠道中Na+共转运系统受到抑制。这些研究结果以及后续研究结果表明,抑制Na+转运和Na+-D-葡萄糖协同转运是呕吐毒素对家禽肠道细胞毒性的一部分。
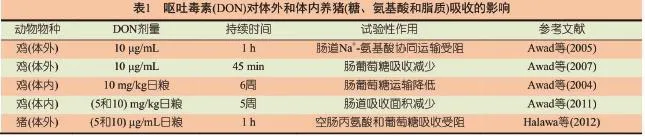
使用相同的体外技术,我们还发现用呕吐毒素对黏膜部位进行处理(10 μg/mL),可降低葡萄糖的摄取,其效果几乎与钠依赖性葡萄糖协同转运载体(SGLT-1)的特异性抑制剂——根皮苷相当。后来有研究也报告猪摄入呕吐毒素(4 μg/mL和8 μg/mL)后,空肠黏膜对葡萄糖和丙氨酸的吸收受到抑制。鸡体内呕吐毒素暴露试验结果确认,人体肠道细胞株HT-29-D4暴露于呕吐毒素下后,对葡萄糖和L-丝氨酸的吸收下降。
文献提出的呕吐毒素可减少肠道对营养素吸收的主要假设,是其能够下调肠细胞关键营养素转运蛋白表达的能力。越来越多的证据表明,呕吐毒素可改变多种参与鸡关键营养素吸收的转运蛋白系统,如十二指肠和空肠组织中葡萄糖钠转运蛋白1(SGLT-1)以及十二指肠组织中葡萄糖转运蛋白2(GLUT-2,表2)。使用定量基因表达方法也发现,饲喂污染呕吐毒素的日粮(每千克饲料含呕吐毒素1 mg、2.5 mg或5 mg,23 d),可以下调编码多种营养素转运的关键基因。例如,负责糖(葡萄糖和果糖)、多种氨基酸(D-丝氨酸和其他中性氨基酸)、棕榈酸(主要的饲料长链脂肪酸)和单羧酸盐(短链脂肪酸)摄入和运输的SLC2A5、SLC7A10、SLC27A4 和SLC16A1基因表达分别出现下降。即使在利用肠上皮细胞株HT-29-D4进行的人体研究中,摄入呕吐毒素会抑制D-葡萄糖/D-半乳糖SGLT-1转运蛋白、D-果糖被动转运蛋白GLUT-5和主动及被动L-丝氨酸转运蛋白等肠道转运蛋白的表达。作者推测,由呕吐毒素引发的SGLT-1抑制主要是因为呕吐毒素能够抑制蛋白质的合成。这一假设在一项由Awad和Zentek (2014)利用鸡进行的最新研究中得到了证实。这些作者评估了在尤斯室条件下作为蛋白质合成抑制剂——放线酮(CHX)及呕吐毒素对肠道营养素吸收的影响。有意思的是,研究发现在用呕吐毒素或CHX处理的肠道组织中,葡萄糖和谷氨酰胺的转运抑制差不多,这显示它们抑制鸡肠道细胞中各自蛋白质合成的能力相当。
综上所述,现有研究数据表明,呕吐毒素能够通过改变负责相应转运蛋白合成的营养素转运基因的表达来影响营养素的吸收(表2)。从临床来看,呕吐毒素暴露引起的糖和氨基酸转运蛋白受抑制可能不仅会导致小肠对能量和营养素摄取的下降,而且更为重要的是,这种影响可能由于大量未消化的糖和氨基酸在后肠大量发酵而造成肠道功能失调。后肠内此类底物供应的增加可能会破坏肠道微生物的生态平衡,造成菌群失调及后续的发酵性腹泻、肠病、脱水和食欲不振。


2.5 呕吐毒素对肠道通透性的影响
跨上皮离子电导(Transepithelial Ion Conductance,Gt)或跨膜电阻(Transepithelial Electrical Resistance,TEER)的改变是肠道屏障功能、肠内离子细胞间转运调节以及猪和鸡肠道细胞完整性受到破坏的标志。利用猪肠道表皮细胞株IPEC-1和IPEC-J2进行的研究也表明,接触呕吐毒素后TEER发生了变化(表3)。同样,呕吐毒素亦可降低鸡空肠和十二指肠的TEER。在猪肠道中也观察到呕吐毒素以剂量依赖型方式对TEER产生类似的降低效果,表明肠道屏障遭到破坏,细胞旁通透性增加。
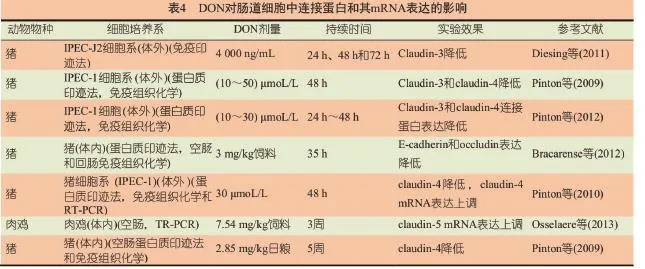
此外,一项离体和体外研究发现,呕吐毒素可提高猪肠道FITC-葡聚糖的细胞旁通路,表明肠道屏障功能受到重大损伤以及机体健康出现严重的后果。实际上,由呕吐毒素引发的猪肠道通透性提高,使猪肠细胞系(即IPEC-J2)中的共生菌以及典型的革兰氏阴性致病菌(GNB)——鼠伤寒沙门氏菌——跨上皮通过成为可能。研究发现,以每千克饲料含2.85 mg呕吐毒素的剂量喂猪5周,可导致猪空肠claudin-4表达下降。Claudins是一种重要的细胞与细胞间的紧密连接蛋白,在肠道上皮完整性方面起着重要的作用,这是首次在猪中直接证明呕吐毒素对紧密连接蛋白的影响。
2.6 呕吐毒素对紧密连接蛋白表达及其mRNA转录的影响
体外(30 μmoL/L,24 h) 及体内研究(2.85 mg/kg,5 周)首次发现,呕吐毒素可改变猪肠道紧密连接蛋白的表达(表4)。Diesing等(2011)使用免疫印迹测定法观察到,在IPEC-J2细胞株(4 000 ng/mL, 24 h、48 h和72 h)中紧密连接蛋白claudin-3显著减少。这些发现在最近利用猪进行的体内研究中得到了证实:饲喂呕吐毒素(3 mg/kg饲料)35 d,能使粘附型连接蛋白E-cadherin和肠道中另一种紧密连接蛋白如封闭蛋白的表达下降。在暴露于呕吐毒素中的Caco-2细胞中也观察到claudin-4蛋白的生物合成下降。表4汇总了连接蛋白表达对呕吐毒素暴露的应答情况。然而,尽管该研究结果均支持呕吐毒素具有降低紧密连接蛋白的效果,但在鸡中进行的一项研究中观察到呕吐毒素暴露对紧密连接蛋白完全相反的作用。在该研究中,呕吐毒素饲喂3周,发现呕吐毒素与鸡空肠组织中claudin-5紧密连接蛋白的mRNA表达上调相关,而对claudin-1、闭合蛋白带1(zona occludens-1) 和2的mRNA的表达无显著影响。这些结果表明,鸡饲料中的呕吐毒素(7.54 mg/kg饲料)会选择性作用于肠细胞紧密连接复合体的不同部位。这是迄今为止首个也是唯一的鸡体内研究文献。作者认为claudin-5 mRNA上调与TLR4 mRNA上调有关,表明是GNB引起的肠道上皮炎症。此外,呕吐毒素改变了肠道壁的形态,并上调了氧化应激蛋白mRNAs水平。
有关呕吐毒素调节肠道紧密连接蛋白及其肠道mRNA的分子作用机制的文献仍然极少。大量证据表明,claudin等紧密连接蛋白可能受参与MAPKs信号传递通路级联活化作用的信号传递分子调节。在一项新的研究中,Pinton等(2012)发现,由于暴露于10 μM 15-ADON(即呕吐毒素的乙酰化形式) 下48 h,猪肠道细胞株(即IPEC-1)对claudin-3 和claudin-4的表达下降。此外,同一研究结果表明,呕吐毒素及其乙酰化衍生物如3-ADON和15-ADON,可提高肠道细胞中MAPKs信号传递通路如p38、c-Jun-N-末端激酶(JNK)以及细胞外信号调节激酶(ERK)1/2的表达,因此直接意味着呕吐毒素是肠细胞中这种重要细胞信号传递通路的刺激剂。在此方面,Pinton等(2010)早先发现,呕吐毒素暴露会激活并诱导ERK1/2,并与claudin表达下降有关,导致肠道屏障功能下降,这可通过TEER和细胞旁通透性的测定结果得到证明。此外,静脉输入100 μg/kg体重的呕吐毒素后,猪空肠中段闭合蛋白带-1的顶膜表达下调。有意思的是,研究表明,呕吐毒素衍生物的毒性与MAPKs激活水平和claudin蛋白表达抑制之间存在直接正相关。显而易见,在出现毒性最强的乙酰化呕吐毒素形式(即15-ADON)的情况下,信号传递通路级联的激活与肠道屏障功能严重在研相关。这些观察结果表明,呕吐毒素暴露后的肠道屏障功能遭到破坏是一个协调一致的过程,它起初以磷酸化MAPKs表达增加开始,然后是紧密连接蛋白如claudins的表达下降。
(未完,待续)
原题名:Impacts of the feed contaminant deoxynivalenol on the intestine of monogastric animals: poultry和swine(英文)
原作者:Khaled Ghareeb和Wageha A.等
中图分类号:S852
文献标识码:C
文章编号:1001-0769(2016)04-0091-03
*译者简介:张江,男,上海农林职业技术学院教授。

