绵羊精原干细胞的分离纯化与鉴定
谢静静,姚晓磊,宋瑞高,吕小康,张瑞鑫,王莉宏,石 磊
(山西农业大学 动物科技学院,山西 太谷 030801)
绵羊精原干细胞的分离纯化与鉴定
谢静静,姚晓磊,宋瑞高,吕小康,张瑞鑫,王莉宏,石磊
(山西农业大学 动物科技学院,山西 太谷 030801)
摘要:旨在探究一种简便高效的绵羊精原干细胞(SSCs)分离纯化方法,为后续研究SSCs奠定基础。本实验采用两步酶消化法对4月龄的绵羊睾丸进行消化处理,获得单细胞悬液。将睾丸细胞接种于0.2%的明胶预处理培养皿中,根据各细胞贴壁能力和速度的不同将SSCs纯化,并在纯化后用SSCs特异标记分子PLZF进行免疫荧光鉴定。结果表明,经免疫荧光染色得出存在PLZF阳性信号。这说明采用两步酶消化和差异贴壁法可以得到纯度较高的SSCs。
关键词:绵羊;精原干细胞;分离;纯化
精原干细胞(Spermatogonial stem cells,SSCs)是指位于曲细精管基膜上,不仅能维持自身数量恒定,又能定向分化产生精母细胞的成体干细胞,是雄性成体内唯一能进行有丝分裂将遗传物质传递到下一代的永生细胞[1]。一般将SSCs分为A、B两型,A型又分为单个A型(A-single,As)、成对A型(A-paired,Apr)和链状A型(A-aligned,Aal)。一般认为As细胞是精子发生过程中的干细胞,可以自我更新成新的干细胞,也可以由细胞间桥连接定向分化形成Apr细胞,进一步分裂形成4链、8链、16链细胞组成的Aal细胞,继续分裂形成A1、A2、A3、A4、In和B型细胞,B型细胞经数次分裂形成精子[2]。SSCs在体外也可诱导分化为精子,是恢复生育能力和保种的一种先进手段[3]。鉴于其在细胞生物学、医学、转基因等领域广阔应用前景,对SSCs生理生化特性、体外培养等实际应用研究,急需建立一种能够有效分离纯化SSCs的方法,得到较高纯度有活力的SSCs。目前,小鼠中己建立了较成熟的SSCs技术体系,而大动物的SSCs研究还处在探索阶段。孔群芳[4]等采用三步酶消化和差异贴壁法对山羊睾丸组织进行了分离纯化。张卫艺[5]等采用两步酶消化法并创新地将DMEM-高糖和DMEM-F12结合使用,有效地对犊牛睾丸组织进行了分离纯化。陈庭锋[6]等采用两步酶消化法成功分离了猪的SSCs。
绵羊具有繁殖率高、产毛量大、性情温顺、易管理等特点,然而目前关于绵羊SSCs的研究还处于初步分离和短期培养阶段,分离纯化体系尚未成熟。如果取得足够且较高纯度的SSCs将对于绵羊SSCs生理生化特性的研究是一个很大的突破,然而,目前国内外关于绵羊SSCs分离纯化的研究报道很少。本研究借鉴较为成熟的小鼠和山羊精原干细胞的分离纯化鉴定,采用两步酶消化法对绵羊睾丸进行处理,制备单细胞悬液,将细胞接种于0.2%的明胶涂层培养皿中,经差异贴壁法进行纯化,用SSCs特异标记分子PLZF对分离纯化的细胞进行免疫荧光鉴定,以探讨一种绵羊SSCs分离纯化的方法,为后续实验奠定基础。
1材料与方法
1.1材料
1.1.1试验动物取自晋中市太谷县屠宰场的绵羊睾丸。
1.1.2主要试剂胰蛋白酶,胶原酶Ⅰ,DMEM/F12,胎牛血清(FBS),PBS缓冲液,4%多聚甲醇溶液,Mouse Anti-PLZF多克隆一抗,HRP标记的Goat Anti-Mouse二抗,浓缩型SABC-Cy3免疫荧光试剂盒均购于武汉博士德生物公司。
1.2方法
1.2.1绵羊睾丸组织的处理将绵羊睾丸用DPBS溶液反复洗涤数次,再用酒精棉球消毒。除去脂肪垫、附睾以及白膜等,剪切后去除睾丸网和血管,充分暴露出线团状生精小管,将生精小管组织用剪刀剪碎。
1.2.2绵羊睾丸组织单细胞悬液的制备取部分组织加入15 mL离心管,加入10倍组织体积的1%胶原酶Ⅰ,37℃消化45 min后离心,弃上清,再用DPBS清洗3次。加入0.25%胰蛋白酶消化,在37℃条件下作用5 min。吹打多次后,用含10% FBS的DMEM/F12终止消化,200目细胞筛过滤细胞悬液。滤液于1 200 r/min离心5 min,弃上清,进行活率测定。
1.2.3绵羊精原干细胞纯化绵羊睾丸SSCs的纯化选用差异贴壁纯化法,将得到的细胞悬液接种在0.2%的明胶培养皿中,在32.5℃、5.5%CO2的细胞培养箱中培养3 d,取未贴附的细胞做细胞涂片,用于SSCs检测。
1.2.4细胞免疫荧光染色对未贴附的细胞进行免疫荧光染色。用DPBS洗3次,4%的多聚甲醇固定15 min,DPBS洗3次,用绵羊血清白蛋白封闭30 min,加入稀释的Mouse Anti-PLZF多克隆一抗(1∶100稀释),孵育过夜,DPBS洗3次,再加入稀释的HRP标记的Goat Anti-Mouse二抗(1∶100稀释),孵育2 h,用DPBS洗涤4次终止反应,加入SABC-Cy3(1∶100稀释),封片、观察。同时设置对照组。
2结果与分析
2.1绵羊精原干细胞的分离和纯化
经组合酶的消化处理获得了绵羊睾丸组织单细胞悬液(图1A),该细胞悬液中包含SSCs、其他生精细胞或体细胞以及红细胞。经明胶涂层的培养皿贴壁分离后,获得了纯度较高的SSCs(图1B),该法可有效得到一定数量和纯度的SSCs。
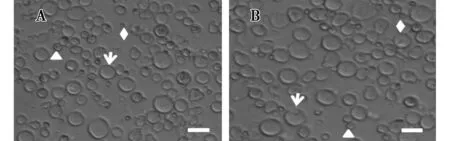
A.单细胞悬浮液(400×);B.纯化后细胞(400×)。箭头代表SSCs,三角形代表其它生精细胞或体细胞,菱形代表红细胞。图1 分离纯化的绵羊精原干细胞(标尺=20 μm)
2.2绵羊精原干细胞免疫荧光标记染色鉴定
对分离纯化后的SSCs进行免疫荧光染色,由图2可看出存在PLZF阳性信号。因此,揭示采用此分离方法可得到一定浓度的绵羊SSCs。
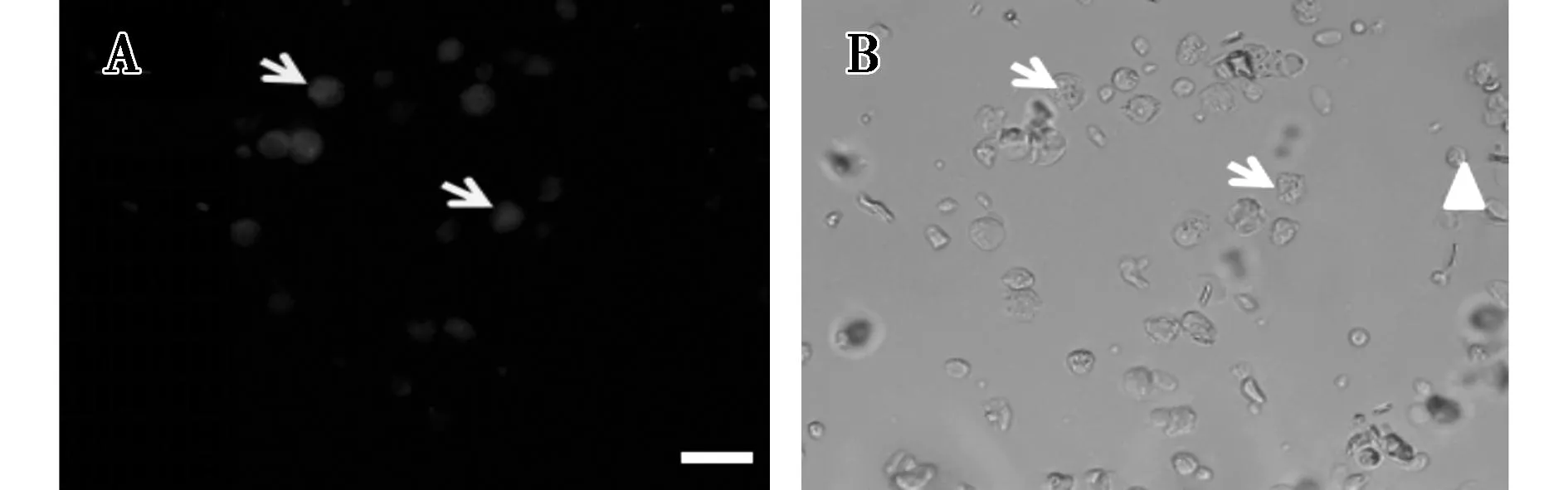
A.PLZF鉴定结果(400×);B.精原干细胞光镜下形态(400×)。箭头代表SSCs,三角形代表其它生精细胞或体细胞,菱形代表红细胞。图2 绵羊SSCs的免疫荧光标记染色鉴定(标尺=20 μm)
3讨论
精子发生是SSCs严格调控的细胞增殖和分化,产生大量精子的复杂过程,SSCs作为精子形成源头,一方面其可通过不断地增殖以维持其数量,另一方面可通过数次分裂和分化产生精子[7]。鉴于SSCs所具有的重要作用,探究一套稳定的分离、纯化以及原代培养的方法对于开展精原细胞相关功能的研究具有重要意义。SSCs的细胞学特性、分离纯化方法、基因修饰以及探索SSCs的体外长期培养系统等都必需有足够数量和较高纯度的SSCs。
随着出生后时间的增长,SSCs逐步分化形成各级生精细胞,其数量及所占比例都会越来越少,这样使得SSCs的分离纯化极为困难[8],故动物的年龄是分离纯化效果的关键。日龄较小的动物其生精上皮内基本只有A型精原细胞和支持细胞,其他各级生精细胞尚未发育形成,理论上可获得大量的SSCs。孔群芳等[4]选用4月龄的山羊睾丸进行分离纯化SSCs。毕聪明等[9]选用5月龄的牛睾丸进行分离纯化SSCs。王永彬等[10]选用出生后7~8日龄的小鼠睾丸进行分离纯化,都得到了较高浓度的SSCs。本研究通过采集4月龄的绵羊睾丸,经酶消化和差异贴壁对其进行纯化,也得到了一定浓度的SSCs。
毕聪明等[9]在牛的SSCs分离试验中首先采用两步酶消化法,结果显示每克睾丸组织可获得3.18×106个细胞。张卫艺等[5]在犊牛SSCs分离试验中也采用两步酶消化法,都取得了较好的分离效果。本试验先采用胶原酶对组织小块进行消化,离心去除大部分游离的间质细胞和管周肌样细胞,再用胰蛋白酶将曲细精管的基底膜消化解离,最后制得睾丸细胞悬液。
一般情况下,对SSCs的纯化方法可选用的有差异贴壁法、免疫磁珠分离技术、不连续Percoll密度梯度离心法、流式细胞分选术和形态筛选法中的一种或多种[11~17]。本研究根据睾丸不同细胞之间在形态学、贴壁能力等方面存在的差异,采用差异贴壁法对其进行纯化。根据SSCs直径的大小,初步得到一定浓度的SSCs。孔群芳等[4]在明胶涂层培养皿中,运用体细胞贴壁速度远大于SSCs,培养后的体细胞大多数已经贴壁,而精原细胞贴壁不牢,吹打即脱落的原理,对山羊SSCs进行纯化,结果显示高于前人通过Percoll密度梯度离心法富集水牛SSCs(71.86%±2.34%)[18]和绵羊SSCs(65.3%±3.2%)[19]的纯化效率。
PLZF是SSCs特异性抗原的分子标记,PLZF仅在早期未分化的精原细胞中表达,M.Bahadorani等[20]对绵羊睾丸组织的PLZF抗体免疫组化显示PLZF在未分化的精原细胞中均有表达。本研究对分离纯化的细胞进一步采用免疫荧光染色对其进行鉴定,结果显示存在PLZF阳性信号,说明采用两步酶和差异贴壁法可得到一定纯度的SSCs。孔群芳等[4]同样也采用与本研究类似的方法,也得到较高浓度的山羊SSCs。但是值得注意的是,前人在山羊[4]上采用此方法得到的纯度较本研究高,这可能是由于物种之间的差异所造成的。因此,要得到更高纯度的绵羊SSCs,还需要进一步研究。
4参考文献
[1]Schlatt S.Spermatogonial stem cell preservation and transplantation[J].Molecular & Cellular Endocrinology,2002,187(2):107-111.
[2]Singh S R,Burnicka-Turek O,Chauhan C,et al.Spermatogonial stem cells,infertility and testicular cancer[J].Journal of Cellular & Molecular Medicine,2011,15(3):468-483.
[3]Smith Z D,Meissner A.The simplest explanation:passive DNA demethylation in PGCs [J].Embo Journal,2013,32(3):318-321.
[4]孔群芳,罗奋华,萨初拉,等.山羊精原干细胞的分离纯化及鉴定[J].畜牧兽医学报,2013,44(10):1554-1560.
[5]张卫艺,洪洁赟,吕妍,等.犊牛精原干细胞的分离纯化与鉴定[J].中国畜牧杂志,2015,51(17):23-26.
[6]陈庭锋,王霄燕,李东,等.猪精原干细胞体外分离培养及诱导分化的研究[D].扬州大学,2014.
[7]杨炜蓉,汪勇,张姣姣,等.精原干细胞研究进展[J].中国畜牧杂志,2013,49(5):76-80.
[8]Muren H,Davey R J,Hill J R.Characterization of germ cells from pre-pubertal bull calves in preparation for germ cell transplantation [J].Cell & Tissue Research,2007,330(2):321-329.
[9]毕聪明,张仕强,彭树英,等.牛精原干细胞的分离和纯化及体外培养的一般特性[J].畜牧兽医学报,2006,37(10):977-981.
[10]王永彬,刘凤美,张军令,等.小鼠精原干细胞的分离纯化及初步鉴定[J].黑龙江动物繁殖,2014,22(4):19-22.
[11]Shen F,Zhang C,Zheng H,et al.Long-term culture and transplantion of spermatogonial stem cells from BALB/cmice [J].Cells tissues Organs,2010,191(5):372-381.
[12]Hamra F K,Chapman K M,Nguyen DM,et al.Self renewal,expansion,and transfection of rat spermatogonial stem cells in culture[J].Proc Natl Acad Sci USA,2005,102(48):17430-17435.
[13]Kanatsu-Shinohara M,Ogonuki N,Inoue K,et al.Long-term proliferation in culture and germline transmission of mouse male germline stem cells[J].Biol Reprod,2003,69(2):612-616.
[14]Van Pelt A M,Morena AR van Dissel-Emiliani FM.Isolation of the synchronized A spermatogonia from adult vitamin A-deficient rat testes[J].Biol Reprod,1996,55(2):439-444.
[15]毕罡,李彦锋,李黔生,等.人睾丸精原细胞的分离和纯化[J].第三军医大学学报,2005,27(11):1142-1144.
[16]采克俊,周国庆,李连茅,等.禽类胚胎干细胞的研究进展[J].上海畜牧兽医通讯,2008,(2):5-7.
[17]Kubota H,Avarbock M R,Brinster R L.Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells[J].Proc Natl Acad Sci USA,2004,101(47):16489-16494.
[18]Rafeeqi T,Kaul G.Isolation and enrichment of type A spermatogonia from pre-pubertal buffalo(Bubalus bubalis)testis[J].Andrologia,2013,45(3):195-203.
[19]Rodriguez-Sosa J R,Dobson H,Hahnel A.Isolation and transplantation of spermatogonial in sheep [J].Theriogenology,2006,66(9):2091-2103.
[20]Bahadorani M,Hosseini S M,Abedi P,et al.Comparative Immunohistochemical analysis of VASA,PLZF and THY1 in goats and sheep suggests that these markers are also conserved in these species[J].J Cytol Histol,2011,2:126.http://www.omicsonline.Org/2157-7099/2157-7099-2-126.php.
Enrichment and Identification of Spermatogonial Stem Cells from Sheep Testis
XIE Jing-jing,YAO Xiao-lei,SONG Rui-gao,LV Xiao-kang,ZHANG Rui-xin,WANG Li-hong,SHI-Lei*
(Shanxi agricultural university,college of animal science and veterinary medicine,Taigu 030801,China)
Abstract:The study was aimed to explore a method that can efficiently isolate and purify spermatogonial stem cells(SSCs)from sheep testis,and lay the foundation of the follow-up study of SSCs.Single cell suspension was prepared from testis of 4-month old sheep by two-step enzymatic digestion.The SSCs were purified from the suspended cells via differential attachment in 0.2% gelatin coated dishes,according to the differential adherence capability in different kinds of cells.Immunofluorescence staining by using SSCs molecular marker PLZF was performed after cells were purified.The result shows that the positive signal of PLZF was obtained in the cells after purification.It is indicated that adopting two-step enzymatic digestion and differential attachment can get high purity of SSCs.
Key words:sheep;spermatogonial stem cells;isolation;purification
收稿日期:2016-04-27
作者简介:谢静静(1994-),女,陕西宝鸡人,本科。E-mail:1440674628@qq.com 通信作者:石磊(1980-),男,博士,副教授。主要从事动物生殖生理和繁殖营养调控等方面的研究。E-mail:sxausl@gmail.com
中图分类号:S826.3
文献标识码:A
文章编号:1005-2739(2016)04-0012-04
资助项目:由“山西农业大学第十三批大学生科技创新项目(13-005)”资助。

