吡蚜酮和百菌清对绿萝生长的Hormesis效应
余月书++李翠兰++姜晓雯++金雪梅
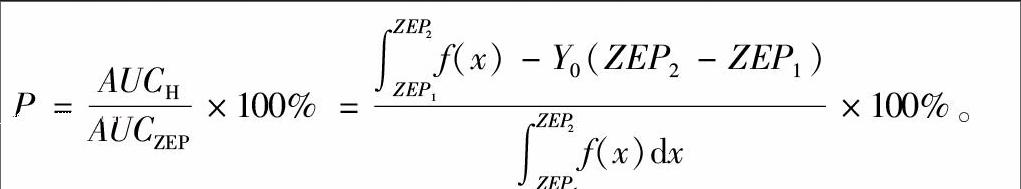


摘要:以绿萝为试验材料,研究低剂量农药对绿萝根生长及对钾、磷吸收功能的影响。结果表明:0.4 mg/kg吡蚜酮与百菌清混合对绿萝根长、生根数量不存在明显影响,对绿萝根干物质积累产生显著抑制作用;吡蚜酮与百菌清单独处理对绿萝钾、磷吸收功能无明显影响;0.4 mg/kg吡蚜酮与百菌清混合使用能显著促进绿萝对磷的吸收;2种农药混合处理下,绿萝磷含量随百菌清浓度上升呈现出先上升后下降的变化趋势,具有Hormesis效应的典型特征,其刺激效应为52.81%,最大刺激效应为8.725。
关键词:吡蚜酮;百菌清;绿萝;钾;磷;Hormesis效应
中图分类号: S682.36文献标志码: A文章编号:1002-1302(2016)06-0301-03
收稿日期:2015-04-16
基金项目:上海市联盟计划(编号:LM2014069)。
作者简介:余月书(1970—),男,江苏阜宁人,博士,副教授,主要从事昆虫生态学及农药对环境生物影响研究。Tel:(021)60873128;E-mail:yuyueshu@sit.edu.cn。农药的作用是控制农田有害生物生长。研究发现,农药能引起植物光合作用、可溶性糖含量、丙二醛含量、叶绿素含量及植物对化学元素的吸收等生理生化过程发生变化[1-5]。同时,低剂量农药还具有促进靶标生物种群增长等有益作用[6-7]。本研究选择生产上常用的农药吡蚜酮与百菌清为试剂,研究低剂量农药对绿萝根生长及其吸收功能的影响,旨在为生产上合理使用吡蚜酮、百菌清提供依据。
1材料与方法
1.1材料
绿萝由上海应用技术学院温室培育,试验时剪取长 10 cm、带1张叶、不带根的茎待用。25%吡蚜酮可湿性粉剂、75%百菌清可湿性粉剂由上海市园林科学研究所提供。
1.2试验设计
1.2.1吡蚜酮与百菌清混合对绿萝根生长的影响将 0.4 mg/kg 吡蚜酮溶液与0(CK)、4、8、16、32、64 mg/kg百菌清溶液等体积混合后放入500 mL锥形瓶中。每瓶插入并固定1株绿萝待用。每个处理重复5次。处理60 d后测定绿萝根长、根数量及根鲜质量。
1.2.2农药对绿萝吸收功能的影响
1.2.2.1吡蚜酮与百菌清单独处理对绿萝吸收功能的影响将0、4、8、16、32、64 mg/kg百菌清溶液与0.001、0.01、0.1、0.2、0.4 mg/kg吡蚜酮溶液分别放入500 mL锥形瓶中。每瓶中插入并固定1株绿萝待用。以清水处理作为对照。每个处理重复3次。处理60 d后测定整株绿萝钾、磷含量。
1.2.2.2吡蚜酮与百菌清混合处理对绿萝吸收功能的影响将0.4 mg/kg吡蚜酮溶液与0(CK)、4、8、16、32、64 mg/kg百菌清溶液混合后放入500 mL锥形瓶中。每瓶中插入1株待用的绿萝,并固定。每个处理重复3次。处理60 d后测定整株绿萝钾、磷含量。
1.3方法
用直尺直接测量绿萝根长。通过目测计数绿萝根数。用剪刀将根剪下,用清水冲洗干净,再用吸水纸吸干水分,用万分之一天平测量绿萝根鲜质量。将整株绿萝从培养液中取出,用清水洗净,自然风干,研磨,称取0.2 g,用1 mol/L盐酸浸提,用国产6400型火焰光度计测定K+含量。根据陈正行的方法[8] 并进行改进,测定绿萝磷元素含量。根据Bunning等的方法[9-10],Hormesis效应计算公式如下:
P=AUCHAUCZEP×100%=∫ZEP2ZEP1f(x)-Y0(ZEP2-ZEP1)∫ZEP2ZEP1f(x)dx×100%。
1.4数据处理
采用SPSS 12.0统计软件分析数据。
2结果与分析
2.1吡蚜酮与百菌清混合对绿萝根长的影响
由表1可知,与对照相比,0.4 mg/kg吡蚜酮与百菌清混合农药对绿萝平均根长均不产生明显影响。0.4 mg/kg吡蚜酮与8 mg/kg百菌清混合能够促进绿萝根生长,其他浓度百菌清与吡蚜酮混合液均抑制绿萝根的生长。
2.2吡蚜酮与百菌清混合对绿萝根数的影响
表2表明,吡蚜酮与百菌清混合农药对绿萝生根数量表现出抑制效应,各处理绿萝根数与对照差异均不明显。
2.3吡蚜酮与百菌清混合对绿萝根鲜质量的影响
表3表明,与对照相比,0.4 mg/kg吡蚜酮与16、32 mg/kg 百菌清混合农药能够显著抑制绿萝根鲜质量。
2.4吡蚜酮与百菌清对绿萝根吸收功能的影响
表4、表5表明,与对照相比,吡蚜酮与百菌清单独处理对绿萝根吸收功能不产生明显影响。表6表明,0.4 mg/kg吡蚜酮与百菌清混合能够促进绿萝根对钾的吸收。与对照相比,0.4 mg/kg吡蚜酮与16、32 mg/kg百菌清混合溶液能够显著增加绿萝根对磷的吸收量。
2.5吡蚜酮与百菌清混合溶液对绿萝磷含量的Hormesis效应
以百菌清浓度(X)(0、4、8、16、32、64 mg/kg)为横坐标,以P含量(Y)为纵坐标,对不同浓度百菌清与绿萝磷含量之间的关系进行拟合,得出Y与X之间存在显著的相关性(df=3,r=0.957>r0.05=0.878)(图1)。两者回归关系为:
Y=-0.003X2+0.27X+2.65。
曲线Y与直线ZEP1、ZEP2所围成的区域面积AUCZEP=589.54。Y0=3.25与ZEP1、ZEP2所围成的区域面积为27768。则曲线Y与Y0直线围成的区域面积AUCH=589.54-277.68=311.86。农药混合对绿萝磷含量的 Hormesis 效应值为:P=100%×311.86/589.54=52.81%,最大效应值是Y导数为0时的X值所对应的Y值,即8.725。
3结论与讨论
研究发现,逆境胁迫对生物生长发育具有促进或抑制作用[4,11-12]。低剂量有毒物质对生物生长的促进作用在近年来多见报道[6]。低剂量百菌清处理能显著促进彩叶草的生长,其根部干物质积累显著增加[13]。绿萝在低浓度氨气处理下,其叶片净光合速率、蒸腾速率、气孔导度整体提高,但气孔长宽比降低;在高浓度氨气胁迫下,绿萝叶片净光合速率、蒸腾速率、气孔导度整体降低,但气孔长宽比升高[12]。植物的根是植物主要的功能组织,担负着固定植物、吸收水分和矿质元素及改善环境等功能。低剂量农药对绿萝根生长作用未见报道。本研究表明,与对照相比,低剂量吡蚜酮与百菌清混合处理下,绿萝根长及根数不存在显著变化。0.4 mg/kg吡蚜酮与百菌清混合处理对绿萝根干物质积累产生了显著的抑制作用,表明农药混合使用不利于绿萝根生长。
钾等矿质元素是植物生长的必需元素,缺钾等化学元素对植物光合作用、叶绿素含量及蛋白质合成、气孔开放、酶系统等都会产生影响[14-19]。本研究表明,低剂量吡蚜酮与百菌清单独处理对绿萝钾、磷含量不产生显著影响,也即对绿萝根吸收功能不产生显著影响。然而,低剂量吡蚜酮与百菌清混合处理后,绿萝体内磷含量显著上升,表明2种农药对绿萝根吸收功能产生了协同增效作用,导致绿萝根吸收功能在农药的混合处理下显著增强。
Hormesis效应是有毒物质一种低促高抑现象,即有毒物质在低浓度状态下对生物生长具有促进作用,高浓度下则具有抑制作用[20]。低剂量农药引起生物Hormesis效应研究目前主要集中在农药对害虫的生殖刺激作用[6,11,21]。本研究采用AUCH/AUCZEP比率来证明农药对植物的Hormesis效应及其幅度。结果表明,低剂量吡蚜酮与百菌清协同胁迫下,绿萝体内磷含量随百菌清浓度上升呈现出明显的倒“U”形曲线,具有典型的Hormesis效应特征,Hormesis效应为52.81%,最大刺激效应为8.725[22]。低剂量有毒物质引起的Hormesis效应是否是一个普遍现象仍存争议[23-24],但低剂量农药诱导生物的Hormesis效应是一个不争的事实[6]。本研究结果表明,低剂量吡蚜酮与百菌清联合作用诱导了绿萝根吸收功能的Hormesis效应。
参考文献:
[1]吴进才,许俊峰,冯绪猛,等. 稻田常用农药对水稻3个品种生理生化的影响[J]. 中国农业科学,2003,36(5):536-541.
[2]Nemoto H. Mechanism of resurjingce of the diamondback moth,Plutella xylostella (L.) (Lepidotera:Yponomeutidae)[J]. JARQ,1993,1:27-32.
[3]Btter N S,Kular J S. Resurjingce of whitefly in cotton and its management[J]. Indian Journal of Entomology,1999,61(1):85-90.
[4]吴进才,董波,李冬虎,等. 4种农药对水稻籽粒生长模型参数的影响[J]. 中国农业科学,2004,37(3):376-381.
[5]余月书,吴进才,王芳,等. 吡虫啉胁迫对水稻可溶性糖、游离氨基酸及钾等矿物元素含量的影响[J]. 扬州大学学报:农业与生命科学版,2008,29(1):85-89.
[6]Yu Y,Shen G,Zhu H,et al.Imidacloprid-induced hormesis on the fecundity and juvenile hormone levels of the green peach aphid Myzus persicae (Sulzer)[J]. Pesticide Biochemistry and Physiology,2010,98(2):238-242.
[7]余月书,沈国清,陆贻通.吡虫啉对桃蚜生殖力的Hormesis效应及对天敌控害效能的影响[J]. 科技通报,2010,26(6):879-883.
[8]陈正行.植物和食物中磷测定方法的改进[J]. 化学世界,1996(1):41-43.
[9]Buning H,Kossler W. Power of some tests for umbrella alternatives in the multisample location problem[ J]. Biomater,1997,39:481-494.
[10]Deng C,Graham R,Shukla R. Detecting and estimating Hormesis using a model-based approach[J]. Human & Ecological Risk Assessment,2001,7(4):849-866.
[11]吴进才,王爱华,许俊峰,等. 两种选择性农药的使用对刺激三化螟产卵及水稻生化影响的研究[J]. 中国农业科学,2003,36(10):1163-1170.
[12]于洋,刘晓东,何淼. 氨气胁迫对绿萝叶片光合日变化特性的影响[J]. 湖北农业科学,2009,48(10):2417-2419.
[13]余月书,黄志莲,徐聘,等. 百菌清对彩叶草生长发育的影响[J]. 北方园艺,2014(17):124-126.
[14]刘建祥,杨肖娥,吴良欢,等. 低钾胁迫对水稻叶片光合功能的影响及其基因型差异[J]. 作物学报,2001,27(6):1000-1006.
[15]Gupta A S,Berkowitz G A. Development and use of chlorotetracycline fluorescence as a measurement assay of chloroplast envelope-bound mg[J]. Plant Physiology,1989,89(3):753-761.
[16]Cakmak I,Hengeler C,Marschner H. Changes in phliem export of sucrose in leaves in response to phosphorous,potassium and magnesium deficiency in bean plant[J]. Journal of Experimental Botany,1994,45:1251-1257.
[17]刘峰,张军,丁秀英,等. 不同含钙化合物的土壤处理对水稻旱育秧苗素质、生理特性及超微结构的影响[J]. 作物学报,2003,29(1):8-12.
[18]赵方华,姜波. 钾肥对加工番茄产量和品质性状的影响[J]. 江苏农业科学,2015,43(9):188-190.
[19]吴巧玉,夏锦慧,何天久. 不同氮钾水平对马铃薯干物质积累和产量的影响[J]. 江苏农业科学,2015,43(11):116-l18.
[20]Chapman P M. The implications of hormesis to ecotoxicology and ecological risk assessment[J]. Human & Experimental Toxicology,2001,20(10):499-505.
[21]James D G,Price T S. Fecundity in twospotted spider mite (Acari:Tetranychidae) is increased by direct and systemic exposure to imidacloprid[J]. Journal of Economic Entomology,2002,95(4):729-732.
[22]Sone S,Tsuboi S,Otsu Y,et al. Mechanisms of low susceptibility to imidacloprid in a laboratory strain of the small brown planthopper,Laodelphaz striatellus Fallen[J]. J Pestic Sci,1997,22(3):236-237.
[23]Calabrese E J. Hormesis:from marginalization to main stream.A case for hormesis as the default dose-response model in risk assessment[J]. Toxicol Appl Pharmacol,2004,197(2):125-136.
[24]Roberts S M. Another view of the scientific foundations of hormesis[J]. Critical Reviews in Toxicology,2001,31(4/5):631-635.

