硫酸软骨素抑制实验性骨关节炎软骨细胞凋亡的体内研究
魏庆宏
(阳煤集团第三医院 骨科,山西 阳泉 045000)
硫酸软骨素抑制实验性骨关节炎软骨细胞凋亡的体内研究
魏庆宏Δ
(阳煤集团第三医院 骨科,山西 阳泉 045000)
目的 探讨硫酸软骨素对骨关节炎软骨细胞凋亡的影响,并研究其可能的作用机制。方法 均采用改良Hulth造模法对20只新西兰兔进行造模实验,每组10只,给药组从第4周开始每天2次用5 g/mL硫酸软骨素灌胃,模型组给予等量0.9%NaCl溶液。给药结束后取兔膝关节软骨组织切片后HE染色,观察组织形态学变化。用Propidium Iodide染色法检测2组兔软骨细胞凋亡情况,Ki67染色法检测细胞增殖。RT-qPCR检测mRNA水平上凋亡因子Caspases-3和凋亡抑制因子Bcl-2的表达变化。结果 形态学观察及HE染色结果显示,给药组的病理变化程度较模型组轻。给药组股骨髁、胫骨平台软骨评分显著优于模型组(P<0.01)。给药组凋亡指数明显低于模型组凋亡指数(P<0.01)。给药组细胞的Ki67阳性率明显高于模型组(P<0.001)。给药组中Caspase-3的mRNA水平明显低于模型组(P<0.001)(图3A);而与此相对的,Bcl-2 mRNA水平明显高于模型组(P<0.001)。结论 硫酸软骨素能够抑制骨关节炎软骨细胞过度凋亡,并减少凋亡基因Caspase-3的表达和增加凋亡抑制基因Bcl-2的表达。
硫酸软骨素;骨关节炎;动物模型;软骨细胞;凋亡
骨关节炎(osteoarthritis,OA)是一种慢性进行性骨关节疾病,常见于中老年人群,其主要病理特征是关节软骨退行性变,其中膝骨关节炎是临床上最常见的关节炎症状[1]。近年来OA成为临床医生的重点研究疾病,并发现OA的发病涉及多方面的因素,因此其具体发病机制目前仍不明了。目前有关OA的研究尚未完全揭示其发病机制,完全治愈OA尚十分困难。目前观点认为开发能有效延缓关节软骨退变的药物是当前治疗OA的关键[2-3]。
硫酸软骨素(chondroitin sulfate,CS)属于酸性黏多糖,广泛存在于人和动物软骨组织中[4],是结缔组织的重要组成成分,具有多重药理作用,除了具有抗炎作用外,还具有保护心脑血管、抗氧化和神经保护作用,硫酸软骨素还参与免疫调节,并具有抗肿瘤作用等[5]。临床上硫酸软骨素主要用于预防和治疗骨关节炎、眼科疾病和心脑血管疾病等。其中CS是骨关节炎治疗的重要辅助药物,使用硫酸软骨素治疗骨关节炎不但疗效显著,而且作用温和,不良反应小,可以长期服用。本实验旨在研究硫酸软骨素对OA软骨细胞凋亡的影响,为硫酸软骨素治疗骨关节炎应用于临床治疗提供可靠的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:选取健康6~8月龄新西兰大耳白兔20只(中南大学湘雅二院实验动物室提供),合格证号:SCXK(湘)2003-0003,雌雄各半,体质量2.5~2.8 kg。本研究遵循《实验动物保护条例》相关规定。
1.1.2 主要仪器:iQ5实时荧光定量PCR仪,美国Bio-Rad公司;BX53倒置显微镜,日本Olympus公司。
1.1.3 主要试剂:硫酸软骨素(唐山市福乐药业有限公司,国食健字G20040025);荧光染料Propidium iodide,Sigma公司;荧光染料DAPI,Sigma公司;RNA抽提试剂盒,Omega公司;SYBR荧光定量PCR试剂盒,TAKARA公司;反转录试剂盒,TAKARA公司;β-actin引物、Caspase-3引物及Bcl-2引物,生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 动物模型建立:采用改良Hulth造模法建立OA模型[6],X线检测显示兔骨关节炎OA模型表明造模成功。取20只新西兰兔,用0.5%水合氯醛按4 mL/kg腹腔注射麻醉兔,固定四肢后剃毛和术区消毒。切断前交叉韧带及内侧半月板,关节冲洗,缝合,行抽屉试验验证造模是否成功。造模成功后,将全部兔子随机分为模型组和给药组,每组10只。
1.2.2 给药:根据Meeh-Rubner公式[7]确定硫酸软骨素给药剂量。给药组每天2次用5 g/mL的硫酸软骨素灌胃 (具体剂量为1 mg/kg)。模型组每天2次用等体积0.9%NaCl溶液灌胃,给药6周后处死动物取材并进行形态学观察。从细胞形态学、基质染色、表面规则性、软骨厚度和与边缘结合度对软骨行组织进行评分比较。
1.2.3 取材与切片:处死动物后立即解剖兔的右侧膝关节,取大小股骨内髁全层软骨,用4%多聚甲醛固定后过夜,石蜡包埋后切片,行常规HE染色。取全部动物股骨内髁组织,用4%多聚甲醛固定过夜,余下的软骨和胫骨平台的软骨切取后,用RNA抽提试剂盒抽提总RNA,反转录成cDNA后供PCR检测用。
1.2.4 软骨细胞凋亡检测:用Propidium Iodide染色通过红色荧光标记全部10只兔子凋亡细胞。DAPI染色计数总体细胞数(放大倍数400),每张切片取至少10个视野拍照并统计数据,凋亡指数=凋亡细胞/细胞总数×100%。
1.2.5 细胞增殖检测:采用增殖指标Ki67检测全部10只兔子软骨细胞增殖情况,有红色荧光的细胞即Ki67阳性细胞,DAPI染全部细胞的细胞核。增殖指数PI=Ki67阳性细胞/细胞总数×100%。
1.2.6 荧光定量PCR检测:RT-qPCR的反应程序为:95 ℃ 30 s预变性, 95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,循环40次,根据溶解曲线丰度确认PCR扩增过程的特异性。每个样品重复3个孔,每组实验重复3次,取Ct值进行分析。β-actin mRNA为内参照,依据公式ΔCt=Ct靶基因-Ctβ-actin分别计算各给药组和模型组中靶基因的ΔCt。引物序列如下,Caspase-3-F:5’-TTCATTATTC-AGGCCTGCCG-3’,Caspase-3-R:5’-GCAAAGTGA-CTGGATGAACC-3’; Bcl-2-F:5’-AAGCTGTCACAGAGGGGCTA-3’,Bcl-2-R:5’-GACG-GTAGCGACGAGAGAAG-3’; β-actin-F:5’-CCGCGCTCGTCGTCG-ACAAC-3’,β-actin-R:5’-AGGGTGAGGATGCCTCTCTT-3’。

2 结果
2.1 形态学观察 形态学观察发现,模型组关节软骨变软且边缘有骨赘形成,关节液量增多;软骨逐渐失去光泽,呈灰黄色;关节表面粗糙,并伴有裂纹、糜烂及溃疡形成,有的较深可达骨质,软骨下出现骨板暴露。给药组的病理变化程度明显较轻,软骨色泽明亮,无裂纹及软化;只有部分标本表面有裂纹或者细小溃疡,并且无明显裂纹、糜烂及溃疡形成。见图1。

图1 股骨髁和胫骨平台的大体形态学观察Fig.1 Gross morphological observation of femoral condyle and tibial plateau

组别 只数股骨髁胫骨平台模型组62.00±0.672.30±0.67给药组60.70±0.48**1.20±0.42**
**P<0.01,与模型组比较,compared with model group
2.2 HE染色 模型组软骨结构遭到破坏,表层出现缺损,软骨细胞排列紊乱,整体细胞数目减少,关节深层着色较深,细胞多有聚集。给药组的关节软骨表层光滑,结构完整,细胞整体分布均匀,排列规则。见图2。
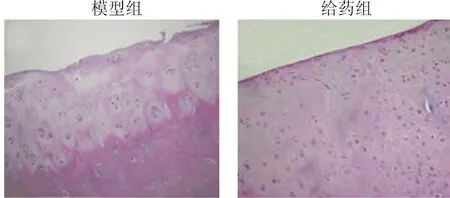
图2 HE染色(×100)Fig.2 Histological evaluation of tibial plateau (×100 )
2.3 软骨细胞凋亡 凋亡软骨细胞主要分布在软骨的中浅层。模型组软骨凋亡阳性细胞较多(图3A)。硫酸软骨素给药组凋亡指数(7.0±2.2)%明显低于模型组凋亡指数(20.2±2.8)%(P<0.01)(图3B)。
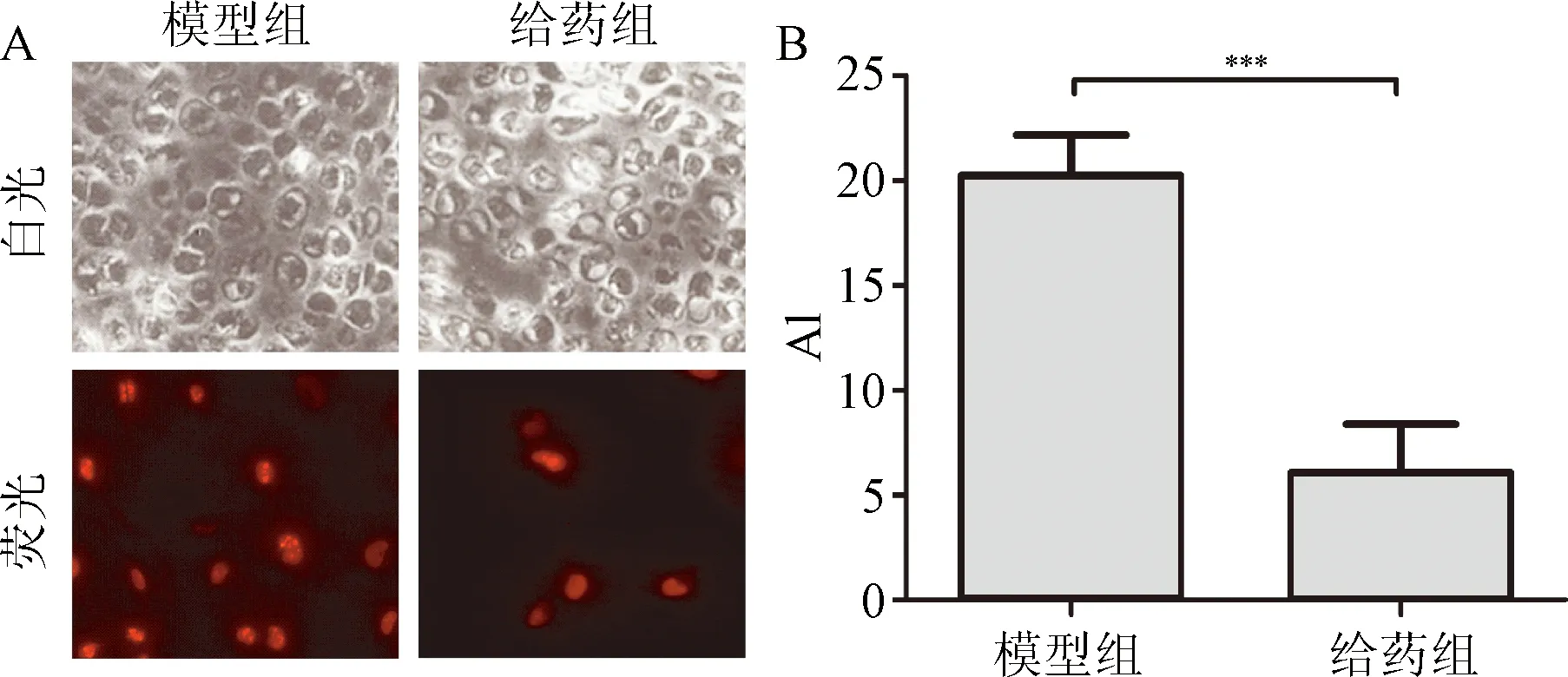
图3 Propidium iodide染色检测细胞凋亡A:细胞凋亡(×400 );B:PI阳性细胞***P<0.001,与模型组比较Fig.3 Cell apoptosis detection by propidium iodide stainingA:apoptosis; B:PI positive cells(n=10,±s)***P<0.001,compared with model group
2.4 Ki67增殖指标检测 通过对模型组和给药组Ki67表达水平分析发现,硫酸软骨素给药组细胞的Ki67阳性率(9.0 ± 1.2)%明显高于模型组(3.1 ± 1.1)%(P<0.001)。见图4。
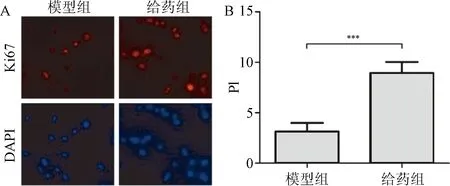
图4 Ki67染色检测细胞增殖A:Ki67染色图片(×400);B:Ki67阳性细胞比例***P<0.001,与模型组比较 Fig.4 Cells proliferation detection by Ki67 dyeing A:Ki67 dyeing(×400); B:percentage of Ki67 ***P<0.001,compared with model group
2.5 硫酸软骨素对Caspase-3和Bcl-2表达的影响 利用荧光定量PCR分别检测模型组和给药组组织中Caspase-3和Bcl-2的表达水平,结果显示,硫酸软骨素给药组中Caspase-3的mRNA水平明显低于模型组(24.0±5.8 vs 7.2±3.5)(P<0.001)(图5A);而与此相对的,Bcl-2 mRNA水平明显高于模型组(3.8±1.4 vs 9.2±2.8)(P<0.001)(图5B)。

图5 硫酸软骨素对Caspase-3和Bcl-2 mRNA表达的影响A:Caspase-3 mRNA表达的变化;B:Bcl-2 mRNA表达的变化***P<0.001,与模型组比较Fig.5 The influence of chondroitin sulfate on mRNA expression levels of Caspase-3 and Bcl-2 (n=10,±s)A:Caspase-3 mRNA expression; B:Bcl-2 mRNA expression***P<0.001,compared with model group
3 讨论
OA是一种常见的关节软骨退行性变,其主要病理特征是关节软骨降解。关节软骨主要由软骨细胞和软骨基质组成,属透明软骨,是一种无血管及淋巴分布的结缔组织。有研究表明,OA患者的软骨细胞凋亡程度明显高于正常软骨组织[8]。也有研究表明,实验性兔与人的OA原位杂交及TUNEL结果相似,并且关节软骨细胞的凋亡程度均明显高于正常软骨组织,这些结果说明软骨细胞过度凋亡是OA发生的重要机制[9]。
Bcl-2家族蛋白是细胞凋亡过程的最重要的调节因素之一[10]。Bcl-2常作为凋亡拮抗蛋白存在,其表达水平与肿瘤的发生、临床治疗及预后等过程均密切相关,通过调控Bcl-2的表达水平并诱导细胞发生凋亡已经成为肿瘤治疗的重要策略之一[11-13]。Caspases蛋白几乎调控所有凋亡相关的信号通路,Caspase-3在其中起核心作用。正常情况下,Caspases蛋白以无活性的酶原存在,Caspases水解成活性Caspases,并进一步激活Caspases活化的核酸内切酶CAD切割DNA,最终导致细胞凋亡的发生。已有多种肿瘤细胞的凋亡发生被证明均与Caspase-3活性变化有关,并且多数药物所诱导的肿瘤细胞凋亡都是通过激活 Caspases引起[14]。
硫酸软骨素是构成软骨组织的重要组成成分,属于糖胺聚糖的一种[15],硫酸软骨素由D-葡糖醛酸和N-乙酰氨基半乳糖以β-1,4-糖苷键连接而成的重复二糖单位组成。硫酸软骨素改善血液循环、加速新陈代谢、促进渗透液的吸收及炎症的消除等多种重要功能,其作为改善关节病的补充品经过多年的应用,已经证明对改善老年退行性关节病和风湿性关节炎有显著效果[16]。
本文通过建立兔骨关节炎模型,研究硫酸软骨素对实验性骨关节炎软骨细胞凋亡的影响。本研究利用Propidium iodide染色检测细胞的凋亡,硫酸软骨素给药组凋亡指数明显低于模型组凋亡指数(P<0.01),可见硫酸软骨素可以明显降低软骨细胞的凋亡指数。之后利用Ki67的表达水平用来检测软骨细胞的增殖能力,硫酸软骨素给药组细胞的Ki67阳性率明显高于模型组(P<0.001),表明硫酸软骨素处理能够增强软骨细胞的增殖能力。可以增加细胞的增殖指数。Caspase-3是凋亡蛋白,而Bcl-2一般作为凋亡拮抗蛋白存在,本研究荧光定量PCR检测结果显示,硫酸软骨素给药组中Caspase-3 mRNA水平明显低于模型组(P<0.001),Bcl-2 mRNA水平明显高于模型组(P<0.001)(图5B)。
综上所述,硫酸软骨素可以抑制实验性骨关节炎软骨细胞的凋亡,这种抑制可能是通过下调Caspases-3和上调Bcl-2实现。
[1] 黄胜, 李雄峰, 管国华,等.实验性骨关节炎MMP-3与软骨细胞凋亡[J].中医正骨, 2010, 22(11): 19-20.
[2] 杨雨果, 杨金锁.化痰除湿法对早期实验性骨关节炎软骨细胞凋亡的影响[J].中国中医基础医学杂志, 2015, 21(6): 665-667.
[3] 舒谦, 曹亚飞, 卿茂盛,等.六味地黄汤对实验性骨关节炎兔软骨细胞凋亡与增殖的体内实验[J].中医药学刊, 2006, 24(7): 1261-1263.
[4] 徐传屯, 关瑞章, 郑江.硫酸软骨素测定方法的研究进展[J].2008, 13(1): 53-56.
[5] 肖玉良, 李平利, 程艳娜.硫酸软骨素的药理作用及应用研究进展[J].中国药学杂志, 2014, 49(13): 1093-1098.
[6] 舒谦, 曹亚飞, 卿茂盛,等.六味地黄汤对实验性骨关节炎兔软骨细胞凋亡与增殖的体内实验[J].中医药学刊, 2006, 24(7): 1260-1263.
[7] 吴琪, 吴倩, 罗勋.徐长卿丹皮酚对兔膝骨性关节炎软骨细胞凋亡的影响[J].中国药科大学学报, 2015, 46(3): 359-363.
[8] Blanco FJ, Gutitian R, Vazquez-Martul E, et al.Osteoarthritis chondrocyte die by apoptosis.A possible pathhway for Osteoarthritis pathology[J].Arthritis Rheum, 1998, 41(2): 1632-1638.
[9] Hashimoto S,Takahashi K, Amid D, et al.Chondrocyte apopotosis and nitrixoxide production during experimentally induced osteoarthritis[J].Arthritis Rheum, 1999, 41(7): 1266-1274.
[10] Heiser D, Labi V, Erlacher M, et al.The Bcl-2 protein family and its role in the development of neoplastic disease[J].Exp Gerontol, 2004, 39(10): 1125-1135.
[11] Capitani N, Baldari CT.The Bcl-2 family as a rational target for the treatment of B-cell chronic lymphocytic leukaemia[J].Curr Med Chem, 2010, 17(9): 801-811.
[12] 王三龙, 蔡兵, 崔承彬,等.吉九里香碱诱导 K562 细胞凋亡的研究[J].中草药, 2007, 38(11): 1677-1681.
[13] 杨靖宇.沉默PPAR-γ通过上调bcl-2表达抑制A549细胞凋亡[J].中国肺癌杂志, 2013, 16(3): 125-129.
[14] Papadaki I, Mylona E, Giannopoulou I, et al.PPARγ expression in breast cancer: clinical value and correlation with ERβ[J].Histopathology, 2005, 46(1): 37-42.
[15] 韩晶, 郭雄, 吴翠,等.硫酸软骨素纳米硒可抑制T-2毒素诱导的大骨节病软骨细胞凋亡[J].南方医科大学学报, 2013, 33(2): 225-229.
[16] Barnhill JG, Fye CL, Williams DW, et al.Chondroitin product selection for the glucosamine/chondroitin arthritis intervention trial[J].J Am Pharm Assoc, 2006, 46(1): 14-24.
(编校:王俨俨)
Inhibition of chondroitin sulfate on apoptosis of chondrocyte in experimental osteoarthritisinvivo
WEI Qing-hongΔ
(Department of Orthopedic, The Third Affiliated Hospital of Yangquan Coal Industry(Group)Co.,Ltd, Yangquan 045000, China)
ObjectiveTo explore the inhibitory effect of chondroitin sulfate on apoptosis of chondrocyte in experimental osteoarthritisinvivoand its mechanism.Methods20 New Zealand white rabbits were established osteoarthritis model by improved Hulth modeling method with 10 rabbits in each group, the treatment group
5 g/mL chondroitin sulfate by gavage from the 4thweek, twice daily, and the model group received 0.9%NaCl solution.After treatment, the cartilage tissue of keen was taken out and histomorphology was observed by HE dyeing.The apoptosis of cartilage cells was observed by Propidium Iodide method, and cell proliferation was detected by Ki67 dyeing.The related apoptosis factor of Caspases-3 and Bcl-2 mRNA were detected by RT-qPCR.ResultsThe morphological observation and HE results showed that the pathological change in treatment group was slighter than mondel group.The cartilage scores of condyles of femur and tibial plateau were better than model group(P<0.01).The apoptosis index in treatment group was lower than model group(P<0.01).The Ki67 positive rate in treatment group was higher than model group(P<0.001).The levels of Caspase-3 mRNA was lower and Bcl-2 mRNA was higher in treatment group than model group(P<0.001).ConclusionThe chondroitin sulfate could inhibit the excessive osteoarthritis chondrocytes apoptosis , and reduce the expression of apoptosis gene caspase-3, while increase the expression of apoptosis inhibiting gene Bcl-2.
chondroitin sulfate; osteoarthritis; animal model; cartilage cells; apoptosis
魏庆宏,通信作者,男,本科,副主任医师,研究方向:骨关节炎,E-mail:woshiweiqinghong@tom.com。
R33
A
10.3969/j.issn.1005-1678.2016.05.13

