sFas和sFasL在乳腺癌新辅助化疗过程中的表达及意义
宋洋,胡燕萍,王锐
(杭州市肿瘤医院 外科,浙江 杭州 310000)
sFas和sFasL在乳腺癌新辅助化疗过程中的表达及意义
宋洋Δ,胡燕萍,王锐
(杭州市肿瘤医院 外科,浙江 杭州 310000)
目的 研究脂肪酸合成酶配体(sFas)和可溶性脂肪酸合成酶受体(sFasL)在乳腺癌新辅助化疗过程中的表达及意义。方法 选取2015年1月~2016年1月在杭州市肿瘤医院接受新辅助化疗的乳腺癌患者84例,为乳腺癌组,取同期84例健康体检者为对照组,分别检测2组人员sFas、sFasL阳性率。同时,分别于新辅助化疗前后检测乳腺癌组患者血清sFas和sFasL水平。并根据临床疗效分为有效组及无效组,对比2组血清sFas、sFasL水平。结果 乳腺癌组sFas和sFasL阳性率分别为58.33%(49/84)和100.00%(84/84),均显著高于正常对照组的38.10%(32/84)和0.00%(0/84);新辅助化疗前患者sFas水平显著低于新辅助化疗后;新辅助化疗有效组sFas水平显著高于无效组,差异均有统计学意义(P<0.05)。结论 在乳腺癌新辅助化疗过程中,通过检测患者血清sFas水平,可有效对新辅助化疗疗效进行早期预测,sFasL在乳腺癌新辅助化疗过程中无显著变化。
脂肪酸合成酶配体;可溶性脂肪酸合成酶受体;乳腺癌;新辅助化疗
乳腺癌是临床最为常见的女性肿瘤疾病之一,具有较高的病死率[1]。该病主要是恶性转化乳腺细胞与其间质之间多种复杂因素及多环节相互作用导致的结果,同时也是伴有局部明显病灶的系统性疾病[2]。近年来,有研究表明,新辅助化疗应用于局晚期可手术乳腺癌患者,可有效提升乳腺癌手术效果。其中寻找一种新的可直接反映治疗疗效的肿瘤凋亡标志物,可对新辅助化疗进行有效监测,进一步实时了解患者情况,有利于预后[3]。因此,本文通过选取84例乳腺癌患者,研究sFas和sFasL在乳腺癌新辅助化疗过程中的表达及其意义,现报道如下。
1 资料与方法
1.1 一般资料 选取2015年1月~2016年1月在杭州市肿瘤医院接受新辅助化疗的乳腺癌患者84例为乳腺癌组,年龄30~68岁,平均(47.5±3.5)岁;另选取同期84例健康体检者为对照组,年龄31~70岁,平均(47.3±3.6)岁。2组基本资料比较差异无统计学意义。本研究患者均已签署知情同意书,经本院医学伦理委员会审核批准。
乳腺癌组入选标准:患者为Ⅱ、Ⅲ期乳腺癌患;浸润性导管癌;体力状况评分(KPS)>60分;能耐受化疗,同时满足白细胞(WBC)>3 000/mm3;符合前辅助化疗适应症。乳腺癌组排除标准:合并高血压、糖尿病等慢性疾病;合并血液疾病病史或其他恶性肿瘤患者。
1.2 方法
1.2.1 治疗方法:新辅助化疗方案:采用多西他赛(浙江海正药业股份有限公司,国药准字:H20084188)75 mg/m2,1次/3 w;蒽环类药物:吡柔阿霉素(浙江海正药业股份有限公司,国药准字:H20045983)50 mg/m2,1次/3 w,环磷酰胺(浙江海正药业股份有限公司,国药准字:H20093092):600 mg/m2,1次/3 w。共化疗6 w。
1.2.2 观察指标:所有研究对象均取空腹肘静脉血3 mL,3 000 r/min 离心10 min分离血清,并置于-70 ℃冰箱保存待测。采用酶联免疫吸附法检测血清中sFas、sFasL水平,采用Multiskan MK 3板式酶标仪(上海雷博分析仪器有限公司)进行检测,试剂盒均来自武汉博士德生物有限公司。此外,采用免疫组化法检测2组患者组织中sFas、sFasL表达,并用抑制阳性结肠癌切片作阳性对照组。比较对照组与乳腺癌组sFas、sFasL阳性率,新辅助化疗前后乳腺癌组患者sFas、sFasL水平变化情况。
1.2.3 疗效判断标准[4]:完全缓解(CR)指肿瘤完全消失,包括腋窝淋巴结;部分缓解(PR)指最长的肿瘤直径减少30%;疾病进展(PD)指最长的肿瘤增长20%或新的肿瘤转移灶的外观直径;无变化(NC)指所有情况无变化。其中有效组=CR+PR,无效组=PD+NC。比较治疗有效与无效患者的sFas、sFasL水平。

2 结果
2.1 对照组与乳腺癌组sFas、sFasL表达阳性率比较 乳腺癌组sFas、sFasL阳性率均显著高于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 2组sFas、sFasL表达阳性率比较[n(%)]Tab.1 Comparison of sFas, sFasL positive expression rate between two groups[n(%)]
*P<0.05,与对照组比较,compared with control group
2.2 新辅助化疗前后乳腺癌组sFas、sFasL水平比较 新辅助化疗后,乳腺癌组患者sFas水平显著高于新辅助化疗前,差异有统计学意义(P<0.05)。见表2。
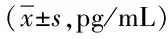
表2 新辅助化疗前后患者sFas、sFasL水平比较Tab.2 Comparison of sFas,sFasL levels before and after neoadjuvant chemotherapy (±s,pg/mL)
*P<0.05,与同组治疗前比较,comparedwiththesamegrouppre-treatment
2.3 新辅助化疗有效组与无效组患者sFas、sFasL水平比较 新辅助化疗有效组sFas水平显著高于无效组,差异有统计学意义(P<0.05)。见表3。
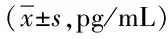
表3 新辅助化疗有效组和无效组患者sFas、sFasL水平比较Tab.3 Comparison of sFas,sFasL levels before and after neoadjuvant chemotherapy in effective and ineffective group(±s,pg/mL)
*P<0.05,与无效组比较,comparedwithineffectivegroup
3 讨论
新辅助化疗是主要应用于局部晚期乳腺癌患者的一种新型治疗手段,其主要作用机制是通过减少肿瘤的大小和降低肿瘤等级,达到提高腺癌患者手术治疗的机会及长期生存率,并可提前了解肿瘤细胞对化疗反应的相关信息[5]。反义lncRNA(AntisenseRNA)是一类基因序列与宿主基因mRNA互补,转录方向与其相反的lncRNA分子[6-8]。FAS-ASl是一个位于Fas基因1号内,含子反义链上的反义lncRNA,其可在正常人类心脏、胎盘、肝脏、肌肉和胰腺等成体组织中表达,在肾脏中表达量极低,而在脑和肺组织中则不表达。细胞凋亡在肿瘤的发展中具有关键作用,而化疗药物可在一定程度上增加细胞凋亡率及肿瘤细胞的数量。目前临床上所使用的抗肿瘤药物主要是通过对肿瘤细胞的抑制,减少肿瘤生长分离与增殖,同时诱导肿瘤细胞死亡[9]。临床上常规评估治疗效果手段包括X线、超声及钼靶等,但上述检查方法的阳性表现均出现较晚,无法对化疗效果进行早期预测,也难以监测肿瘤生物化学变化[10-11]。因此,寻找一种新的预测标志物提前有效提示肿瘤细胞的变化情况,有利于临床上及时指导化疗方案的改变及药物治疗剂量的调整,进一步避免药物过度使用情况发生的不良反应。
本研究结果发现,乳腺癌组sFas、sFasL阳性率分别均显著高于对照组,提示sFas、sFasL在乳腺癌患者血清表达异常,可能成为诊断的新指标。Fas/FasL系统会致使肿瘤细胞从免疫系统逃离,而sFas具有抑制Fas与FasL结合诱导的凋亡介导作用,主要机制是通过与FasL或抗Fas抗体进行结合,同时可与膜mFas形成不同组合的异源三聚体,从而使其无法介导细胞凋亡[12]。与此同时,新辅助化疗后患者sFas水平显著高于新辅助化疗前,说明新辅助化疗会对患者血清sFas水平造成影响,其可作为临床上评估化疗治疗效果的指标之一。究其原因,笔者认为sFas在患者体内的作用是通过和mFas形成异源三聚体,从而降低mFas表达,或是抑制功能性的mFas同源三聚体形成的方式,进一步减少细胞凋亡,最终导致肿瘤细胞逃离免疫监控而出现异常增殖[13]。此外,新辅助化疗有效组sFas水平显著低于无效组,说明在化疗过程中患者血清sFas水平会随之变化,且化疗临床效果越好,sFas水平越高。其中造成sFas水平异常增高的原因主要包括FasmRNA以多种方式进行间接加工后翻译和蛋白酶作用下脱落产生[14-15]。Sehgal等[16]研究证实在B淋巴细胞瘤中,FAS-ASl可与RBM5结合,与之相互作用,影响Fas基因6号外显子的转录,进而抑制sFas表达。B细胞淋巴瘤中FAS-ASlmRNA的低表达与其宿主基因Fas的可溶性受体(sFas)mRNA表达呈负相关[15]。sFas的动态变化可能与乳腺癌细胞发生、发展的病理生理过程有关。通过与临床病理特征进行相关性分析发现FAS-ASl的表达和肿瘤组织的大小和淋巴结显著相关[13]。后续我们在细胞学水平通过构建过表达质粒内源性上调乳腺癌细胞系中FAS-ASl表达水平,检测其对肿瘤细胞增殖能力的影响,发现过表达FAS-ASl可以显著抑制乳腺癌细胞MCF-7的增殖能力,这进一步提示FAS-ASl是一个乳腺癌相关的重要调控因子。
综上所述,在乳腺癌新辅助化疗过程中,通过检测患者血清sFas水平,可有效对新辅助化疗疗效进行早期预测,且血清sFas水平明显增高意味着新辅助化疗疗效显著,反之,血清sFas水平在新辅助化疗前后差别不明显则说明疗效较差。
[1] 郑莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-569.
[2] 孟令新,丁兆军,孟芹,等.AC联合与FAC联合在乳腺癌新辅助化疗中的疗效比较[J].中华临床医师杂志(电子版),2016,10(11):1645-1647.
[3]MitrofanovaI,ZavyalovaM,TeleginaN,etal.Tumor-associatedmacrophagesinhumanbreastcancerparenchymanegativelycorrelatewithlymphaticmetastasisafterneoadjuvantchemotherapy[J].Immunobiology,2016,2985(16):30342-30344.
[4]CadooKA,TrainaTA,KingTA.Advancesinmolecularandclinicalsubtypingofbreastcancerandtheirimplicationsfortherapy[J].SurgicalOncologyClinicsofNorthAmerica,2013,1(22):823-840.
[5]RedanaS,SharpA,LoteH,etal.Ratesofmajorcomplicationsduringneoadjuvantandadjuvantchemotherapyforearlybreastcancer:Anoffstudypopulation[J].Breast,2016,30(1):13-18.
[6]LiangJC,BloomRJ.SmolkeCD.EngineeringbiologicalsystemswithsyntheticITtamolecules[J].MolCell,2011,43(6):915-926.
[7]MercerTR,MattickJS,Structureandfunctionoflongnoncodingmilsinepigeneticregulation[J].NatStructMolBiol,2013,20 (3):300-307.
[8]LiJT,WangLF,ZhaoYL,eta1.Nuclearfactorofactivatedtcells5maintainedbyhotairsuppressionofmir-568upregulatess100calciumbindingproteina4topromotebreastcancermetastasis[J].BreastCancerRes,2014,16(5):454.
[9] 杨晓婧,王法,娜迪热·铁列吾汗,等.超声造影在乳腺癌新辅助化疗疗效评价中的价值[J].中华实用诊断与治疗杂志,2016,30(4):396-398.
[10] 朱坤兵,徐灿,李晓霞,等.乳腺癌分子分型与新辅助化疗效果的关系[J].中华乳腺病杂志(电子版),2016,10(3):166-169.
[11]MaX,WangX,HuangJ,etal.BevacizumabadditioninneoadjuvanttreatmentincreasesthepathologicalcompleteresponseratesinpatientswithHER-2negativebreastcancerespeciallytriplenegativebreastcancer:AMeta-Analysis[J].PLoSOne,2016,11(8):148-149.
[12] 周丰,周光华,陈璇,等.Fas基因启动子区多态性与乳腺癌发病风险的相关性研究[J].湖南师范大学学报(医学版),2015,12(2):4-7.
[13] 任凭,李焕斌,张琦,等.89Sr照射对乳腺癌MCF-7细胞分泌sFas、sFasL的影响[J].山东医药,2013,53(33):15-16.
[14] 谢国强,肖华龙,邵耀明,等.乳腺癌患者手术前后血清IL-2、MMP-9、TK1和sFas测定的临床价值[J].放射免疫学杂志,2013,26(4):396-399.
[15] 周树伟,苏蓓蓓,周勇,等.FAS-AS1在乳腺癌组织中的表达及其对宿主基因sFas表达的影响[J].中华医学杂志,2016,96(12):949-953.
[16]SehgalL,MathurR,BraunFK,eta1.Fas—antisense1lncmaandproductionofsolubleversusmembranefasinb-celllymphoma[J].Leukemia,2014,28(12):2376-2387.
(编校:苗加会)
The significance of sFas and sFasL expression on neoadjuvant chemotherapy of breast cancer
SONG YangΔ, HU Yan-ping, WANG Rui
(Department of Surgery, Zhejiang Cancer Hospital, Hangzhou 310000, China)
ObjectiveTo study the expression and significance of fatty acid synthase ligand (sFas) and soluble fatty acid synthase receptor (sFasL) on the neoadjuvant chemotherapy of breast cancer.Methods84 cases of patients with breast cancer neoadjuvant chemotherapy were recorded from January 2015 to January 2016 in our hospital as breast cancer group,another 84 cases of healthy subjects as control group,the two groups were measured sFas,the positive rate of sFasL.At the same time,respectively before and after neoadjuvant chemotherapy, detection of patients serum sFas, sFasL levels and breast cancer.According to the clinical curative effect were divided into effective group and ineffective group, compared two groups of serum sFas, sFasL levels.ResultsBreast cancer group called sFas and sFasL positive rate was 58.33% (49/84) and 100.00%(84/84),were significantly higher than that of control group 38.10%(32/84) and 0.00% (0/84);The level of sFas in patients with neoadjuvant chemotherapy was significantly lower than that of neoadjuvant chemotherapy, and the level of sFas in neoadjuvant chemotherapy group was significantly higher than that in ineffective group, the difference was statistically significant (P<0.05).ConclusionIn the course of neoadjuvant chemotherapy for breast cancer,the efficacy of neoadjuvant chemotherapy can be effectively detected by detecting the level of serum sFas in patients with breast cancer, while sFasL has no significant change in the neoadjuvant chemotherapy of breast cancer.
fatty acid synthase ligand; soluble fatty acid synthase receptor;breast cancer;neoadjuvant chemotherapy
10.3969/j.issn.1005-1678.2016.12.053
宋洋,通信作者,男,硕士,主治医师,研究方向:甲状腺及肝胆胃肠外科,E-mail:yezhuxials@163.com。
R737.9
A

