灵芝多糖对荷膀胱癌T24细胞小鼠T细胞亚群及AQP1、AQP3表达的影响
王成财,梁文波
(1. 大连大学附属新华医院 肿瘤科,辽宁 大连 116000;2.锦州医科大学附属第一医院 泌尿外科,辽宁 锦州 121000)
灵芝多糖对荷膀胱癌T24细胞小鼠T细胞亚群及AQP1、AQP3表达的影响
王成财1,2,梁文波1Δ
(1. 大连大学附属新华医院 肿瘤科,辽宁 大连 116000;2.锦州医科大学附属第一医院 泌尿外科,辽宁 锦州 121000)
目的 研究灵芝多糖对荷膀胱癌T24细胞小鼠T细胞亚群及AQP1、AQP3表达的影响。方法 选择BALB/c裸鼠30只作为实验动物,皮下注射膀胱癌T24细胞建立荷膀胱癌动物模型,随机分为对照组、顺铂组、灵芝多糖+顺铂组各10只,顺铂组给予顺铂25 mg/kg腹腔注射,顺铂+灵芝多糖组小鼠给予灵芝多糖200 mg/kg灌胃,顺铂25 mg/kg腹腔注射,对照组给予相当体积的生理盐水灌胃。测定肿瘤组织的体积和质量、外周血中T细胞亚群的含量以及肿瘤组织中AQP1、AQP3、Caspase-3、Bax的mRNA含量。结果 顺铂组、顺铂+灵芝多糖组小鼠肿瘤组织的体积、肿瘤组织质量明显低于对照组(P<0.05),顺铂+灵芝多糖组小鼠肿瘤组织体积、肿瘤组织质量明显低于顺铂组(P<0.05);顺铂组、顺铂+灵芝多糖组CD4+T细胞、CD8+T细胞、CD4+/CD8+均明显高于对照组(P<0.05),顺铂+灵芝多糖组CD4+T细胞、CD4+/CD8+均明显高于顺铂组(P<0.05);顺铂组、顺铂+灵芝多糖组小鼠肿瘤组织中Bax、Caspase-3的mRNA含量明显低于对照组(P<0.05),顺铂+灵芝多糖组鼠肿瘤组织中Bax、Caspase-3的mRNA含量明显低于顺铂组(P<0.05);顺铂组、顺铂+灵芝多糖组小鼠肿瘤组织中AQP1、AQP3的mRNA含量明显低于对照组(P<0.05);顺铂+灵芝多糖组小鼠肿瘤组织中AQP1、AQP3的mRNA含量明显低于顺铂组(P<0.05)。结论 灵芝多糖干预能够抑制荷膀胱癌T24细胞小鼠的肿瘤生长,增强细胞免疫功能,调节凋亡基因、AQP1、AQP3的表达水平。
膀胱癌;灵芝多糖;T细胞亚群;水通道蛋白;凋亡
膀胱癌是泌尿系统最常见的恶性肿瘤,其中超过70%为浅表性膀胱癌,多数能够通过手术切除,但是术后的复发率较高。有研究表明,浅表性膀胱癌(superficial bladder cancer,SBC)往往术后容易复发,术后需要进行膀胱灌注化疗[1]。因此,膀胱癌术后继续进行药物辅助治疗以预防肿瘤的复发有助于改善患者的预后情况。膀胱癌的复发与免疫逃逸、细胞凋亡异常有关,选用具有免疫调节功能和促凋亡效应的药物能够预防肿瘤复发[2]。灵芝多糖是具有抗肿瘤效应的中药材,能够通过调节免疫功能、减少血管新生来抑制肿瘤的发展[3]。本研究分析了灵芝多糖对荷膀胱癌T24细胞小鼠T细胞亚群及AQP1、AQP3表达的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物:BALB/c裸鼠30只,雌性,6~8周,体重15~25 g,购买于康生物科技股份有限公司(合格证号:SCXK(京)2014-0005),购回后适应性饲养周,饲养条件:室温18~27 ℃,相对湿度40~70%。本次研究报经医院动物伦理委员会批准,同时严格遵守《实验动物管理条例》。
1.1.2 药物与试剂:人膀胱癌细胞株T24购买于中科院上海细胞库;细胞培养用液体、消化酶购买于Hyclone公司;灵芝多糖购买于杭州众芝康菇生物技术有限公司;CD3、CD4、CD8抗体购买于上海鑫乐生物科技有限公司(美国Biolegend原装);Trizol提取液、M-MLV反转录酶购买于Invitrogen公司,荧光定量PCR试剂购买于Promega公司。
1.1.3 主要实验仪器:CO2细胞培养箱(美国ITienno公司);PCR扩增仪(Eppendorf公司);凝胶成像系统(法国VILBERLOURMAT公司);电泳仪(北京六一仪器厂);电子天平(德国Sartorius公司);流式细胞仪(CyFlow Cube,CyFlow Ploidy Analyser)(德国PARTEC公司)。
1.2 方法
1.2.1 荷膀胱癌T24细胞小鼠模型的建立[3]:复苏膀胱癌细胞株T24,培养后进行消化和传代,取对数期生长的细胞并调节密度至1.0×107/L,将200 μL肿瘤细胞悬液接种在小鼠右侧腋窝的皮下组织。待肿瘤组织生长至纵径4~5 mm后表示荷瘤模型建立成功。采用随机数字表法将30只小鼠分为空白对照组、顺铂组、顺铂+灵芝多糖组各10只。
1.2.2 药物干预方法:顺铂组给予生理盐水灌胃,1次/d,连续干预18 d,给予顺铂25 mg/kg腹腔注射,1次/d,连续干预5 d;顺铂+灵芝多糖组小鼠给予灵芝多糖200 mg/kg灌胃,1次/d,连续干预18 d,顺铂25 mg/kg腹腔注射,1次/d,连续干预5 d;对照组给予相当体积的生理盐水灌胃,1次/d,连续干预18 d,生理盐水腹腔注射,1次/d,连续干预5 d。
1.2.3 肿瘤体积和质量:于实验第19天在SPF实验室操作台按动物福利学将小鼠脱颈断头处死, 处死小鼠后解剖得到肿瘤组织,用电子天平对肿瘤组织进行称重,用游标卡尺测量肿瘤组织的体积。
1.2.4 外周血T淋巴细胞亚群含量:处死小鼠后取外周血组织,分别孵育CD3、CD4、CD8的荧光抗体,缓冲液洗涤后1 500 r/min离心5 min,PBS重悬并用流式细胞仪测定CD3+、CD4+、CD8+的比例,计算CD4+/CD8+的比例。
1.2.5 肿瘤组织中基因的表达量:取肿瘤组织置于匀浆器,用Trizol法提取总RNA,反转录为cDNA后采用Promega公司的qPCR Master MI型进行荧光定量PCR扩增,(AQP)AQP1上游引物序列:5’-GCTCACCCGCAACTTCTCA-3’,下游:5’-TCCTCTATTTGGGCTTCATCTC-3’(212bp);AQP3上游引物序列 :5′-TGGTGGCTTCCTCACCATCAA-3′, 下游:5′-CGAGCCCAAAA-ACAATCCCAGC-3′(209 bp);caspase-3 上游引物序列:5′-GACTAGCTTCTTCAGAGGCGA-3′;下游:5′-ATTCCGTTGCCAC-CTTCCTG-3′(322bp);Bax上游引物序列 :F 5’-GGCGAATT-GGAGATGAAC-3’,下游:5’-CCGAAGTAGGAGAGGAGG-3’(307 bp),(94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火1s,72 ℃延伸1 min,共34循环;72 ℃延伸10 min,94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸10 min,共32循环;72 ℃继续延伸10 min),反应体系为cDNA 1 μL、Master mix 10 μL、上下游引物各0.4 μL、ddH2O8.2 μL。得到扩增曲线后,以GAPDH为内参计算目的基因水通道蛋白(AQP)AQP1、AQP3、Caspase-3、Bax的mRNA含量。

2 结果
2.1 肿瘤体积和质量 顺铂组、顺铂+灵芝多糖组小鼠肿瘤组织的体积、肿瘤组织质量明显低于对照组(P<0.05);顺铂+灵芝多糖组小鼠肿瘤组织体积、肿瘤组织质量明显低于顺铂组(P<0.05)。见表1。

表1 3组小鼠的肿瘤体积和质量比较Tab.1 Comparison of tumor volume and mass between three groups(±s)
*P<0.05,与对照组比较comparedwithcontrolgroup;#P<0.05,与顺铂组比较comparedwithcisplatingroup
2.2 外周血T细胞亚群含量 顺铂组、顺铂+灵芝多糖组CD4+T细胞、CD8+T细胞、CD4+/CD8+均明显高于对照组(P<0.05);顺铂+灵芝多糖组CD4+T细胞、CD4+/CD8+均明显高于顺铂组(P<0.05)。见表2及图1。

表2 3组小鼠外周血T细胞亚群的含量比较Tab 2 Comparison of T lymphocyte subsets in peripheral blood between three groups(±s)
*P<0.05,与对照组比较comparedwithcontrolgroup;#P<0.05,与顺铂组比较comparedwithcisplatingroup
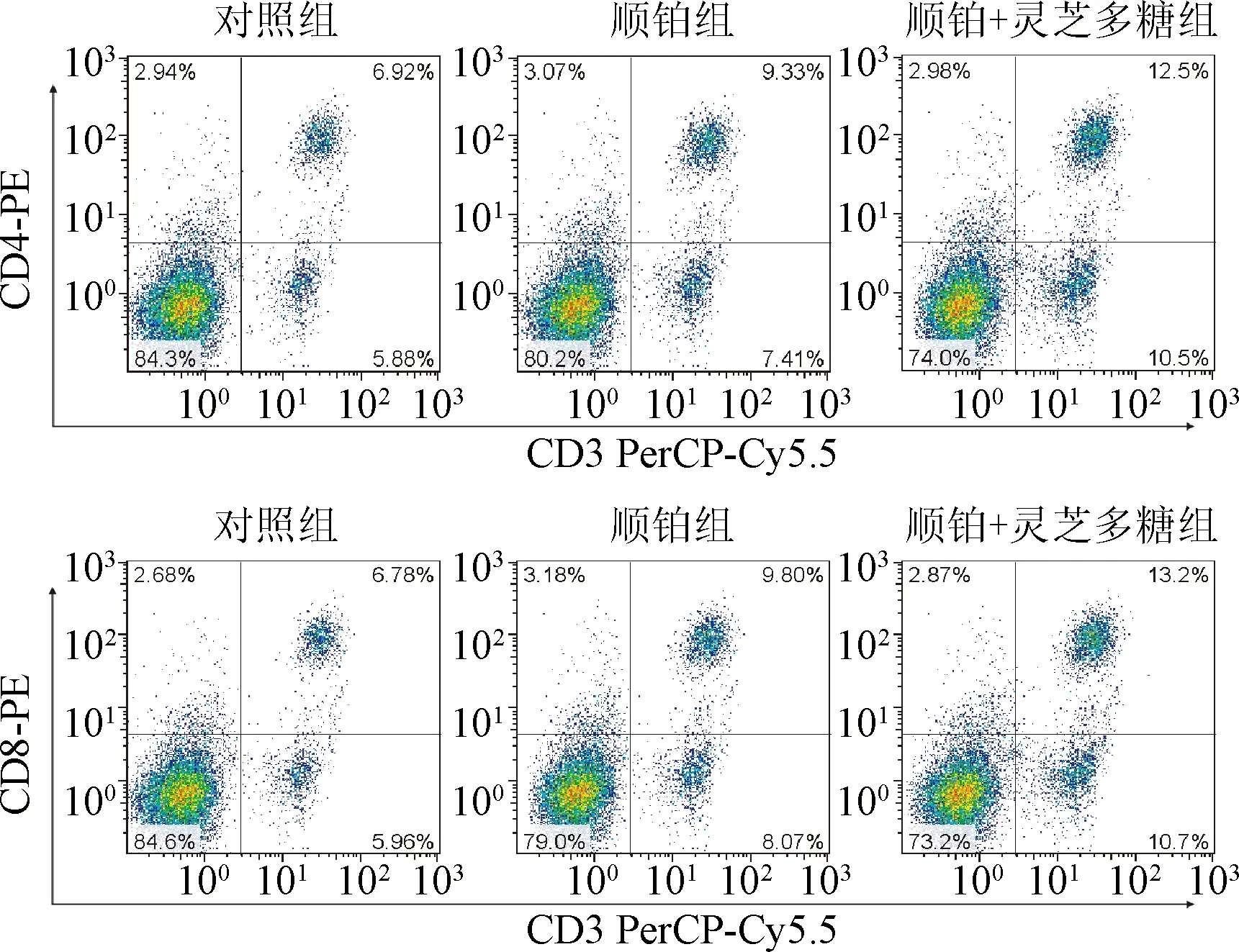
图1 3组小鼠外周血T细胞亚群的含量比较(n=10)Fig.1 Comparison of T lymphocyte subsets in peripheral blood between three groups(n=10)
2.3 肿瘤组织中Bax、Caspase-3的mRNA顺铂组、顺铂+灵芝多糖组小鼠肿瘤组织中Bax、Caspase-3的mRNA含量明显低于对照组(P<0.05);顺铂+灵芝多糖组鼠肿瘤组织中Bax、Caspase-3的mRNA含量明显低于顺铂组(P<0.05)。见表3及图2。

表3 3组小鼠肿瘤组织中Bax、Caspase-3的mRNA含量比较Tab.3 Comparison of mRNA of Caspase-3 and bax in tumor tissues between three groups(±s)
*P<0.05,与对照组比较comparedwithcontrolgroup;#P<0.05,与顺铂组比较comparedwithcisplatingroup

图2 3组小鼠肿瘤组织中Bax、Caspase-3的mRNA含量比较,M:Marker;C:对照组;S:顺铂组;L:顺铂+灵芝多糖组。Fig.2 Comparison of mRNA in Caspase-3 and Bax of tumor tissues betweem three groupsM:Marker, C:Control group;S:Cisplatin group; L:Cisplatin combined ganoderma lucidum polysaccharide group
2.4 肿瘤组织中AQP1、AQP3的mRNA含量 顺铂组、顺铂+灵芝多糖组小鼠肿瘤组织中AQP1、AQP3的mRNA含量明显低于对照组(P<0.05);顺铂+灵芝多糖组小鼠肿瘤组织中AQP1、AQP3的mRNA含量明显低于顺铂组(P<0.05)。见表4及图3。

表4 3组小鼠肿瘤组织中AQP1、AQP3的mRNA含量Tab.4 Comparison of mRNA in AQP1 and AQP3 of tumor tissues betweem three groups(±s)
*P<0.05,与对照组比较comparedwithcontrolgroup;#P<0.05,与顺铂组比较comparedwithcisplatingroup
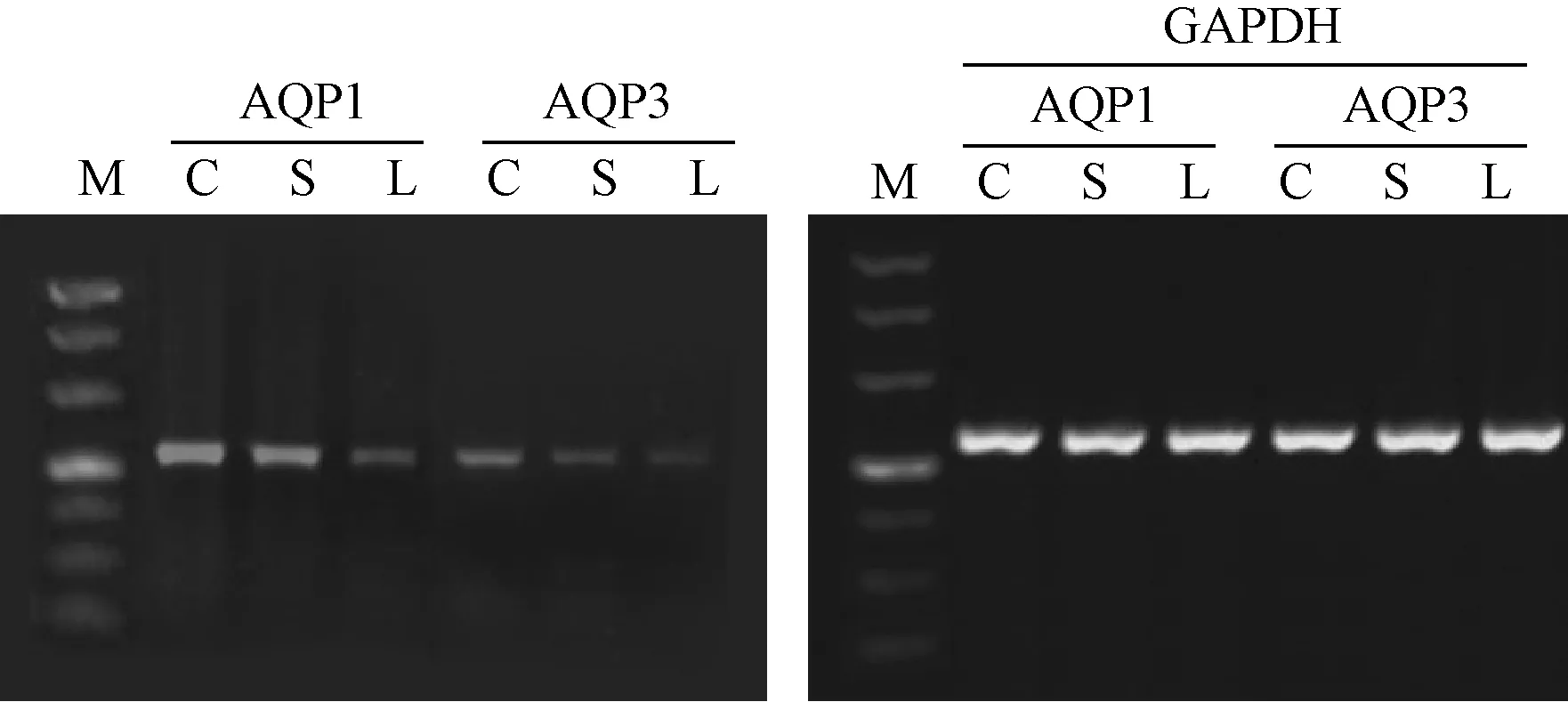
图3 3组小鼠肿瘤组织中AQP1、AQP3的mRNA含量比较,M:Marker;C:对照组;S:顺铂组;L:顺铂+灵芝多糖组。Fig.3 Comparison of mRNA in AQP1 and AQP3 of tumor tissues between 3 groups M:Marker, C: Control group; S: Cisplatin group; L: Cisplatin combined ganoderma lucidum polysaccharide group
3 讨论
膀胱癌是泌尿生殖系统常见的恶性肿瘤之一,目前主要的治疗方法是手术切除,辅助以术后放疗和化疗。但是,放疗和化疗的不良反应多、患者耐受性较差,且在长期放疗和化疗过程中,会出现药物和放射线耐受的情况,影响整体治疗效果。如何通过有效的药物辅助治疗来预防膀胱癌复发是临床的重要课题。
灵芝多糖为灵芝属真菌丝体次生代谢产物,由三股单糖链构成的大分子化合物,是从灵芝孢子粉中提取的水溶性多糖成分。灵芝多糖是灵芝的主要活性成分,具有广泛的药理活性,其抗肿瘤作用备受关注[4]。最早关于灵芝多糖的研究证实,该药物对S180肉瘤的生长具有抑制作用。近年来的研究发现,灵芝多糖能够通过抑制血管新生、调节免疫功能的途径来发挥抗肿瘤效应[5-6]。本实验研究结果表明,与对照组、顺铂组比较,顺铂+灵芝多糖组小鼠肿瘤组织的体积显著缩小、肿瘤组织的质量显著减轻。提示灵芝多糖能够抑制荷膀胱癌T24细胞小鼠的肿瘤生长。已有研究报道,灵芝多糖具有明确的免疫调节作用[7-10]。CD4+细胞可协助B细胞分泌抗体和调节其他T细胞的免疫应答,CD8+细胞常表现细胞毒活性,是主要的细胞毒效应细胞[11]。本实验研究中,本文研究中,顺铂+灵芝多糖组CD4+T细胞、CD4+/CD8+均明显高于顺铂组,提示灵芝多糖能够增强荷膀胱癌T24细胞小鼠的细胞免疫功能和体液免疫功能。
目前关于灵芝多糖与膀胱癌细胞凋亡的关系尚缺乏研究。Bax和Caspase-3是已知的促凋亡基因,Bax能够促进线粒体内的细胞色素C释放进入胞浆,进而激活Caspase所介导的级联放大反应并引起细胞凋亡[12-13]。我们对膀胱癌组织中促凋亡基因表达量的分析证实,与顺铂组比较,顺铂+灵芝多糖组小鼠肿瘤组织中Bax、Caspase-3的mRNA含量明显降低。说明灵芝多糖干预能够下调荷膀胱癌T24细胞小鼠肿瘤组织中凋亡基因的表达。水通道蛋白(AQP)是近年来新发现的增殖相关分子,包括AQP0-AQP12共13名成员,参与不同组织和器官水通透性的调节。已有研究报道,AQP1、AQP3高表达与膀胱癌的发生、复发密切相关[14]。AQP1主要参与肿瘤血管通透性的调节,能够促进肿瘤血管新生以及细胞增殖,同时也有利于肿瘤的迁移和侵袭[15];AQP3的主要生物学效应是促进细胞的迁移,既有利于肿瘤细胞穿过微血管屏障并向远处迁移,也能够促进内皮细胞迁移、增加新生血管形成[16]。本实验研究中,顺铂+灵芝多糖组小鼠肿瘤组织中AQP1、AQP3的mRNA含量明显低于对照组与顺铂组,Huang等[17]也有类似的文献报道,提示灵芝多糖有助于下调小鼠肿瘤组织中AQP1、AQP3表达水平。
本文研究表明,灵芝多糖干预能够抑制荷膀胱癌T24细胞小鼠的肿瘤生长、增强细胞免疫功能,调节促凋亡基因、AQP1、AQP3的表达,可作为膀胱瘤化疗辅助用药,其可能作用机制还有待于更多的基础研究与临床研究去证实。
[1] 李美凤,周小庆,曾菁,等.膀胱内灌注丝裂霉素与表柔比星预防膀胱癌术后复发的临床研究[J]. 中国临床药理学杂志,2014,30(6):500-502.
[2]HuangHN,RajanbabuV,PanCY,etal.EnhancedControlofBladder-AssociatedTumorsUsingShrimpAnti-LipopolysaccharideFactor(SALF)AntimicrobialPeptideasaCancerVaccineAdjuvantinMice[J].MarDrugs,2015,13(5): 3241-3258.
[3] 刘奔,郭鹏荣,盛玉文,等.灵芝多糖对荷膀胱癌T24细胞小鼠化疗后腹腔巨噬细胞的影响及相关免疫机制研究[J].中国全科医学,2015,18(24):2971-2975.
[4] 梁曾恩妮,易有金,郭雨桐,等.灵芝多糖联合5-氟尿嘧啶对LoVo细胞增殖及凋亡的影响[J].中成药,2012,34(11):2068-2072.
[5] 郭鹏荣,盛玉文,刘奔,等.灵芝多糖对顺铂抑制荷膀胱癌T24细胞裸鼠肿瘤生长及血管生成作用的影响[J].解放军医学杂志,2014,39(6):470-474.
[6]BohB.ganoderma lucidum:apotentialforbiotechnologicalproductionofanti-cancerandimmunomodulatorydrugs[J].RecentPatAnticancerDrugDiscov,2013,8(3):255-287.
[7] 汤新慧.灵芝水煎剂对小鼠免疫功能的影响[J].中医研究,2000,13(6):8-10.
[8] 徐新,潘继存,曹容华,等.灵芝多糖对人脐血LAK细胞增殖活性的影响[J].中国实验临床免疫学杂志,1996,8(1):19-21.
[9] 雷林生,王庆彪,孙莉莎,等.灵芝多糖对小鼠脾细胞白细胞介素1、肿瘤坏死因子的产生及其mRNA表达的影响[J].中药药理与临床,1998,14(2):16-18.
[10] 江振友,林晨.灵芝多糖对小鼠细胞免疫功能调节作用的实验研究[J].微生物学杂志,2003,23(2):51-54.
[11] 严健,原永明,张舒,等.CD3+、CD4+、CD8+T淋巴细胞亚群在肿瘤患者外周血中检测的临床意义[J].检验医学,2013,28(10):901-903.
[12]WangJ,ZhangX,WeiP,etal.Livin,SurvivinandCaspase3asearlyrecurrencemarkersinnon-muscle-invasivebladdercancer[J].WorldJUrol,2014,32(6):1477-1484.
[13]GolestaniEimaniB,SanatiMH,HoushmandM,etal.Expressionandprognosticsignificanceofbcl-2andbaxintheprogressionandclinicaloutcomeoftransitionalbladdercellcarcinoma[J].CellJ,2014,15(4):356-363.
[14]OttoW,RubenwolfPC,BurgerM,etal.Lossofaquaporin3proteinexpressionconstitutesanindependentprognosticfactorforprogression-freesurvival:animmunohistochemicalstudyonstagepT1urothelialbladdercancer[J].BMCCancer,2012,12:459.
[15] 拜合提亚·阿扎提,王文光,范兆阳,等.水通道蛋白1、3在非肌层浸润性膀胱癌组织中的表达及其与复发现象的相关性[J].新疆医科大学学报,2012,35(6):776-780.
[16] 范兆阳,王文光,木拉提·热夏提,等.水通道蛋白1、3在膀胱尿路上皮癌中的表达及临床意义[J].中国全科医学,2012,15(5):1718-1722.
[17]HuangCY,ChenJY,WuJE,etal.Ling-Zhipolysaccharidespotentiatecytotoxiceffectsofanticancerdrugsagainstdrug-resistanturothelialcarcinomacells[J].JAgricFoodChem,2010,58(11):8798-8805.
(编校:师维康)
Effect ofganodermalucidumpolysaccharides on T cell subsets and AQP1, AQP3 expression of bladder cancer T24 cell line bearing mice
WANG Cheng-cai1,2, LIANG Wen-bo1Δ
(1. Department of Oncology, Xinhua Hospital Affiliated to Dalian University, Dalian 116000, China; 2. Department of Urinary Surgery, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China)
ObjectiveTo study the effect ofganodermalucidumpolysaccharides on T cell subsets and AQP1, AQP3 expression of bladder cancer T24 cell line bearing mice.Methods60 BALB/C nude mice were selection as experimental animals, bladder tumor bearing animal models were made by bladder cancer T24 cells subcutaneous injection, and were randomly divided into control group, cisplatin group,ganodermalucidumpolysaccharides and cisplatin group, cisplatin group given 25 mg/kgcisplatin intraperitoneal injection, cisplatin combinedganodermalucidumpolysaccharide group given 200 mg/kgganodermalucidumpolysaccharide lavage, 25 mg/kg cisplatin intraperitoneal injection, the control group given quite a volume normal saline lavage. Then tumor volume and weight, peripheral blood T cell subsets and AQP1, AQP3, Caspase-3, Bax mRNA content in tumor tissue were determined.ResultsCisplatin group, cisplatin combinedganodermalucidumpolysaccharide tumor volume and mass were significantly lower than the control group (P<0.05), cisplatin andganodermalucidumpolysaccharide tumor volume and mass were significantly lower than that cisplatin group (P<0.05); Cisplatin group, cisplatin combinedganodermalucidumpolysaccharides group CD4+T cells, CD8+ T cells , CD4+/ CD8+were significantly higher than that of control group (P<0.05), cisplatin combinedganodermalucidumpolysaccharide group CD4+T cells, CD4+/ CD8+were significantly higher than that of cisplatin group(P<0.05); Cisplatin group, cisplatin combinedganodermalucidumpolysaccharide group mices tumor tissues Bax, Caspase 3 mRNA content were significantly lower than the control group (P<0.05), cisplatin combinedganodermalucidumpolysaccharide group Bax,caspase 3 mRNA content were significantly lower than that of cisplatin group (P<0.05); Cisplatin group, cisplatin combinedganodermalucidumpolysaccharide group mice tumor tissue AQP1, AQP3 mRNA content were significantly lower than the control group (P<0.05); Cisplatin combinedganodermalucidumpolysaccharide group AQP1, AQP3 mRNA content were significantly lower than cisplatin group (P<0.05).Conclusionganodermalucidumpolysaccharide can inhibit tumor growth and enhance cellular immune function of bladder cancer T24 cell line bearing mice, and adjust the expression of pro-apoptotic genes, AQP1 and AQP3.
Bladder cancer;ganodermalucidumpolysaccharide; T cell subsets; water channel protein; apoptosis
10.3969/j.issn.1005-1678.2016.12.008
辽宁省自然科学基金资助项目(201202131)
王成财,男,本科,主治医师,研究方向:泌尿系肿瘤,E-mail:wangchengc2004@163.com;梁文波,通信作者,男,博士,主任医师,研究方向:肿瘤免疫治疗,E-mail:dllwb@126.com。
R69
A

