萱藻配子孤雌生殖丝状体的采苗及育苗研究
李晓丽,申元,曹淑青,张泽宇
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
萱藻配子孤雌生殖丝状体的采苗及育苗研究
李晓丽,申元,曹淑青,张泽宇
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
摘要:为研究萱藻Scytosiphon lomentaria的丝状体育苗,以大连沿海萱藻为材料,采用配子孤雌生殖方法,进行了丝状体的诱导及采苗、育苗研究。结果表明:单株种藻获得的配子经孤雌生殖形成的盘状体在20℃时生长最快,15℃时次之,10℃时最慢;盘状体直径达到100 μm以上时开始形成丝状体,丝状体在20℃时形成的时间最短、数量最多、生长速度最快,15℃时次之,10℃时最差;将丝状体剥下经增殖后切碎采苗,在10℃时幼苗形成最快、形成率最高,15℃时次之,20℃时无幼苗形成;在10℃时,采苗后培养30 d幼苗长度达到 (11.0±0.3)mm,移至海区栽培4个月后获得藻体长度为60 cm左右的萱藻成体。
关键词:萱藻;配子;孤雌生殖;丝状体;采苗;室内培养
萱藻Scytosiphon lomentaria是经济价值较高的一年生大型经济褐藻,在中国北至辽宁、南至广东沿海均有分布,萱藻在冬春季生长繁茂,藻体最大长度可达80~110 cm,能在近岸潮间带和潮下带的岩礁区形成大的藻场,是中国沿海重要的海藻资源[1-2]。萱藻营养丰富、味道鲜美,是人们喜欢食用的主要海藻之一[3]。研究发现,萱藻中氨基酸含量丰富且种类齐全,共含有7种人体必需氨基酸、2种半必需氨基酸和7种非必需氨基酸,其中天门冬氨酸和谷氨酸含量占总氨基酸的20%以上,儿童生长发育必需的精氨酸和组氨酸含量也较高[4],而且萱藻中岩藻聚糖硫酸脂含量丰富,具有显著的护肝作用[5]。近年来,萱藻作为健康和保健食品,市场需求量迅速增大,有关萱藻规模化苗种生产技术、海区栽培技术的研究已经引起人们的关注。
目前,国内外有关萱藻的研究报道多集中在其生活史和生态学方面[6-10],关于萱藻人工育苗的研究报道较少,久保昭史[11]进行了配子 (合子)采集和盘状体孢子体培养初步研究;三浦昭雄[12]将室内培养的盘状孢子体切碎并附着在维尼纶绳上,在海区浮筏上培育出萱藻幼苗;张泽宇等[13]从合子萌发形成的盘状孢子体上得到丝状体,将丝状体再转化为盘状孢子体并培养至形成单室孢子囊,采集从成熟孢子囊放出的孢子并在室内培育出萱藻幼苗。本研究中利用萱藻配子异宗结合的特点,用单株藻体采集配子的方法,从配子孤雌生殖形成的盘状体上获得丝状体,经增殖后,采用丝状体采苗的方法将丝状体切碎并使其附着在维尼纶绳网帘上,丝状体细胞直接萌发为萱藻幼苗,并将其在海区浮筏上栽培成成体,可将育苗时间缩短为20~30 d。作者根据试验结果,掌握了盘状体生长以及丝状体形成、生长和采苗期的最适宜温度,可为萱藻的规模化苗种生产提供理论指导。
1 材料与方法
1.1材料
试验用萱藻种藻于2014年4月采集于大连市黑石礁海区自然种群,采集时取藻体表面形成配子囊的成熟种藻 (图1),单株用海水洗净后分别放入塑料袋内,带回实验室供试验使用。
1.2方法
1.2.1配子放散与采集 将单株种藻铺放在白纸上,在室内阴干2~3 h后,分别放入盛有100 mL消毒海水的 200 mL烧杯内,在光照强度≥60 μmol/(m2·s)下刺激配子放散,当有褐色烟雾状配子放散后捞出种藻,用吸管在向光处水表面配子趋光集中的褐色区域汲取配子水,分别取2~3
1.2.2盘状体的形成及生长试验 将附着胚配子的载玻片移至直径为9 cm的培养皿 (下同)内,添加培养液后置于不同温度下进行培养,每5 d测定1次盘状体的生长状况,测定50个盘状体的直径并取其平均值。
1.2.3温度对丝状体形成和生长的影响试验 在温度为20℃、光照强度为40 μmol/(m2·s)、光照周期为12 h/d的条件下,盘状体直径达到100 μm左右时,将生长盘状体的载玻片移到培养皿内,添加培养液后移至不同温度下进行培养。每10 d检查1次盘状体,每次测量50个盘状体,按形成丝状体的盘状体数与盘状体总数的百分比计算丝状体形成率。
将生长在盘状体表面的丝状体剥下,移至盛有培养液的300 mL烧瓶中,培养至肉眼可见的藻团时,将丝状体藻团移到载玻片上,用双面刀片切碎后撒在铺有载玻片的培养皿内,添加培养液后静置过夜,次日上午将附着丝状体藻段的载玻片分别移入装有培养液的不同培养皿内,并置于不同温度下进行培养。每5 d测定1次丝状体的生长状况,每次测量50个丝状体的长度并取其平均值。
1.2.4丝状体切碎及幼苗培养 取增殖后的丝状体藻团2 g(湿质量),添加300 mL培养液后,用组织捣碎机 (Philip HR2096)切碎,时间为120 s,在测定藻段长度后,洒在铺有载玻片的培养皿内,附着3 d后,将载玻片移至直径为15 cm的培养皿内,添加培养液后置于不同温度下进行培养。每5 d测定1次幼苗形成率,每次测量50个丝状体,按形成幼苗的丝状体数与丝状体总数的百分比计算幼苗形成率;最后将形成幼苗的载玻片移入不同培养皿内,并置于不同温度下进行培养。每5 d测定1次幼苗生长状况,每次测量50个个体的长度并取其平均值。
以上培养过程均在恒温培养箱内进行,温度分别设定为10、15、20℃,光源为日光灯,光照周期为12 h/d,光照强度为40 μmol/(m2·s)。培养液为过滤后加热至80℃以上再冷却的海水,营养盐的添加量为 NaNO3100 mg/L,KH2PO420 mg/L,微量元素PI溶液[14]1 mL/L,每3 d全量更换培养液1次。
1.2.5幼苗培育及海区栽培 2014年10月20日,将增殖后的孤雌生殖丝状体采用相同方法切碎,洒在铺有维尼纶绳网帘的塑料水槽 (水体0.3 t)内,待附着牢固后,将网帘移入玻璃钢水槽(水体2 t)内进行培养。培养用水为过滤的自然海水,营养盐添加量为NaNO320 mg/L,NaH2PO410 mg/L,培养用水每3 d全量更换1次,待幼苗肉眼可见时移至海区浮筏上栽培。
2 结果与分析
2.1配子附着、萌发与盘状体的形成及生长
配子呈梨形,大小为 (6.0~7.0)μm× (3.5~5.0)μm,色素呈体盘状,具眼点,侧生两条不等长鞭毛 (图2-A)。配子放散具正趋光性,附着时表现出负趋光性,游向背光处并附着。配子附着时长鞭毛接触基质并快速旋转将鞭毛收回体内,当配子前端与基质接触后停止旋转并附着,成为胚配子。胚配子为圆形,直径约5 μm,在20℃下24 h后开始萌发,细胞首先在侧面产生突起并拉长呈长圆形,经2~3次细胞横分裂后形成5~7个细胞的长条状盘状体 (图2-B),随后细胞开始向周边分裂,形成多细胞盘状体。
刚形成的盘状体呈圆形或椭圆形,直径为20~30 μm,由数十个椭圆形细胞组成,呈放射状排列,细胞内含1个褐色的盘状色素体。在20℃下,盘状体细胞首先沿着基质的表面分裂增加附着面积,培养15 d时,盘状体直径达到60 μm以上。之后盘状体中部细胞横分裂加快,由中央开始逐渐向上隆起,厚度逐渐增加。培养25 d时,盘状体直径均超过100 μm,中央部略隆起,盘状体进入快速生长阶段,周边外层可见由透明长方形分生细胞组成的分生膜。培养2个月时,盘状体直径达2 mm左右,肉眼已清楚可见。
从表1可见,培养20 d时,20℃下盘状体直径为 (80.0±3.0)μm,15℃和10℃下分别为(60.0±2.0)、(45.0±2.0)μm;培养30 d时,20℃下盘状体直径增加至 (120.0±4.0)μm,明显大于15℃和10℃下的 (85.0±3.0)、(60.0±3.0)μm。
2.2温度对丝状体、叶状体形成的影响
当盘状体直径达到100 μm左右时,其中央及周边部分表面细胞拉长并延伸出盘状体表面,细胞内原生质向上移动使细胞顶端膨大呈褐色棒状,部分棒状细胞经2~3次细胞横分裂,形成3~5个细胞的丝状体,经生长后形成多细胞丝状体 (图2-C)。刚形成的丝状体为单条丝状体,丝状体长为30.0~40.0 μm,宽为12.0~15.0 μm,内含褐色盘状色素体,随后产生分枝并生长成为分枝丝状体藻团。

图1 成熟萱藻Fig.1 Mature gametophytes of brown alga Scytosiphon lomentaria
从表2可见:在20℃下,培养5 d时开始形成丝状体,培养10 d时形成率达到 (25.0± 5.0)%,培养30 d时丝状体形成率达到100%,每个盘状孢子体上一般都形成多个丝状体;在15℃下,培养10 d时,盘状体上开始形成丝状体,培养30 d时,丝状体形成率为 (80.0±6.0)%;在10℃下,培养20 d时,盘状体上才开始形成丝状体,培养30 d时,丝状体形成率仅为 (20.0± 3.0)%,且每个盘状孢子体上形成的丝状体数量均明显少于20℃和15℃下形成的丝状体数量(P<0.01)。
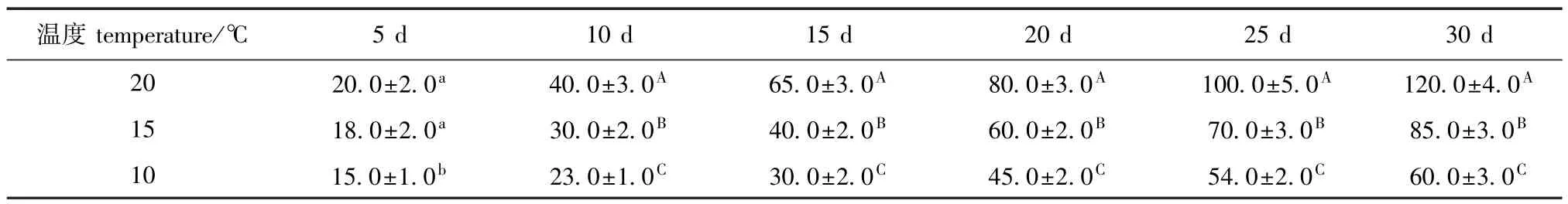
表1 不同温度对萱藻盘状体生长 (直径)的影响Tab.1 Effect of different temperature on growth(diameter)of crusts of brown alga Scytosiphon lomentaria μm
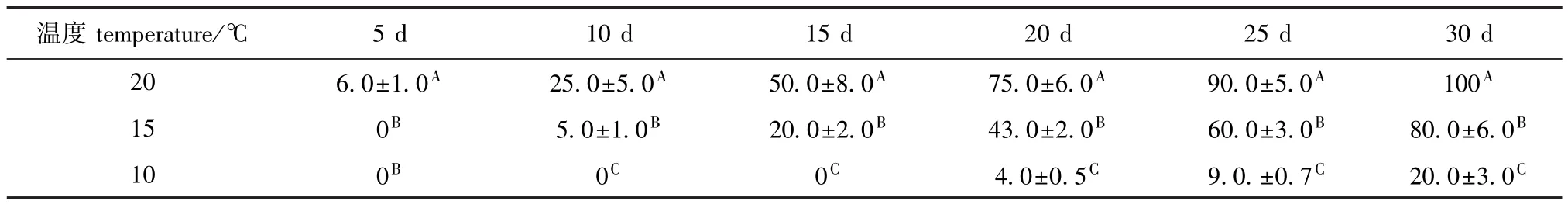
表2 不同温度对萱藻丝状体形成率的影响Tab.2 Effect of different temperature on the formation rate of filaments of brown alga Scytosiphon lomentaria %
叶状体是由2~5列细胞组成的细长藻体,一般形成于盘状体中部。开始时盘状体中部细胞颜色加深,分裂加快,随后延伸出盘状体表面并生长成为叶状体 (图2-D)。当叶状体生长到一定长度(200 μm左右)时生长停止,藻体逐渐失去光泽、变厚,纵裂为2~5条由单列细胞组成的丝状体(图2-E)。叶状体的产生非常普遍,且每个盘状体上产生叶状体的数量也较多,部分盘状体上形成的叶状体可达十余棵。
2.3温度对丝状体生长的影响
切碎后的丝状体藻段长度为70~230 μm,平均为160 μm,依靠破碎细胞溢出的原生质黏附在基质上。丝状体生长时,首先细胞拉长,细胞内的盘状色素体也随之变细拉长,随后细胞中间产生隔阂,色素体和原生质也被分隔,分裂为2个细胞,在显微镜下可见多个细胞同时进行细胞分裂,藻体长度增加很快,在20℃下培养1个月时,可生长成长度为5 mm左右的单列细胞丝状体。随后丝状体两侧产生少数分枝并延长为分枝丝状体,培养2个月时,生长成直径为5 mm左右的丝状体藻团。
不同温度对丝状体生长的影响如表3所示。从表3可见,培养30 d时,丝状体的长度在20℃下达到 (6.4±0.3)mm,在15℃下为 (4.7±0.4)mm,在10℃下仅为 (3.0±0.1)mm。结果表明,在设定的3个温度条件下,丝状体在20℃下生长最快,15℃下次之,10℃下最慢。
随着培养时间的增加,丝状体藻团细胞分裂旺盛,长度快速增加,同时部分细胞缩短变粗,细胞内原生质浓度增加呈黑褐色。之后,筒状细胞逐渐膨大,在其上端或下端向周边环生出多个圆形小细胞,经生长后聚集在一起形成节状细胞团。节状细胞团多环生于细胞隔阂处,由十余个或几十个直径为6~10 μm的圆形细胞组成,细胞内具有1个盘状色素体和丰富的原生质,呈黑褐色。培养后丝状体藻团的丝状体上形成大量节状细胞团(图2-F)。
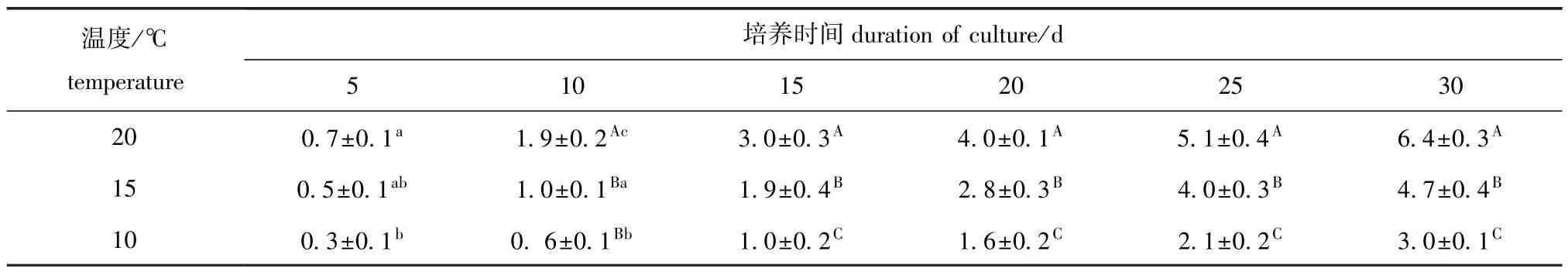
表3 不同温度对萱藻丝状体生长 (长度)的影响Tab.3 Effect of different temperature on growth(length)of filaments of brown alga Scytosiphon lomentaria mm
2.4幼苗的形成与生长
扩增后的丝状体如图3-A所示,经切碎后的丝状体藻段长度为110~230 μm,平均为155 μm,依靠切断细胞溢出的原生质黏附在基质上。在10℃下切碎3 d后,在显微镜下可见丝状体细胞逐渐变短,细胞内原生体浓度增加并呈褐色,细胞表面产生突起并向上延伸呈透明棒状,细胞内的盘状色素体及原生质向棒状细胞内移动,使棒状细胞呈浅褐色,随后棒状细胞逐渐拉长并分裂为2~3个细胞,上部细胞顶端生出透明无色毛,基部细胞向下延伸出透明假根丝,附着在基质上成为萱藻幼苗。一般情况下,丝状体藻段与基质接触的两端细胞先形成幼苗,未与基质接触的细胞和丝状体藻段的中间细胞形成幼苗相对较晚,随着培养时间的延长,几乎所有丝状体藻段细胞均能形成幼苗,显微镜下可见1个丝状体藻段上有多棵幼苗生出(图3-B)。
节状细胞团被打碎后散落在基质上,在10℃下,圆形细胞3 d时开始增大,与基质的附着面变为扁圆形,随后表面产生突起并延伸成棒状细胞,细胞内的色素体和原生质移动到棒状细胞内后成为透明细胞空壳,并与棒状细胞相连。随后棒状细胞基部产生隔阂并分裂成3~5个细胞,上部细胞顶端生出无色毛,下部细胞生出假根丝并延伸到基质表面成为萱藻幼苗。
不同温度对幼苗形成率的影响见表4。从表4可见,温度对幼苗形成率的影响极显著 (P<0.01)。10℃下,丝状体细胞切碎5 d时便开始形成幼苗,10 d时幼苗形成率为 (24.0±2.0)%,20 d时形成率为 (85.0±8.0)%,30 d时形成率达到100%;15℃下,丝状体细胞切碎10 d时开始形成幼苗,20 d时幼苗形成率为 (18.0±2.0)%,30 d时形成率为(45.0±5.0)%;20℃下,丝状体只进行旺盛的细胞分裂,切碎30 d时也没有幼苗形成。

表4 不同温度对萱藻幼苗形成率的影响Tab.4 Effect of different temperature on formation rate of brown alga Scytosiphon lomentaria juveniles %
不同温度对幼苗生长的影响如表5所示。从表5可见:在10℃下,培养10 d时幼苗长度为(1.2±0.2)mm,20 d时长度增加至 (5.2±0.1)mm,30 d时长度达到 (11.0±0.3)mm;在15℃下,培养10 d时幼苗长度为 (0.8±0.1)mm,20 d时长度为 (3.2±0.3)mm,30 d时长度为 (6.2± 0.4)mm;20℃下,培养10 d时幼苗长度为(0.5±0.1)mm,20 d时长度为 (1.2±0.2)mm,30 d时长度仅增至 (2.4±0.1)mm,显微镜下可见幼苗呈弯曲状,藻体表面细胞凹凸不平,部分藻体已经死亡。
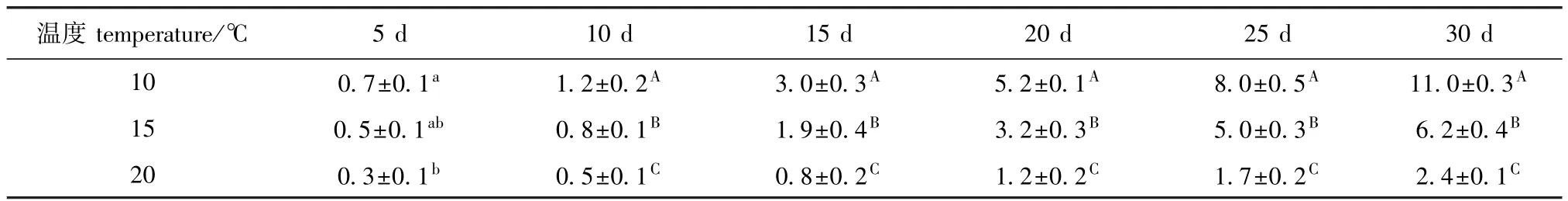
表5 不同温度对萱藻幼苗生长 (长度)的影响Tab.5 Effect of different temperature on growth(length)of brown alga Scytosiphon lomentaria juveniles mm
2.5幼苗培育及栽培
附着在维尼纶网帘上的丝状体细胞在培育10 d左右时陆续形成幼苗,培养40 d时幼苗藻体长度已达1.0 cm左右 (图3-C),随后于2014年11月30日,研究人员将生长在维尼纶绳网帘的幼苗移至海区浮筏上栽培,4个月后生长成藻体长度为60 cm左右的萱藻成体 (图3-D)。
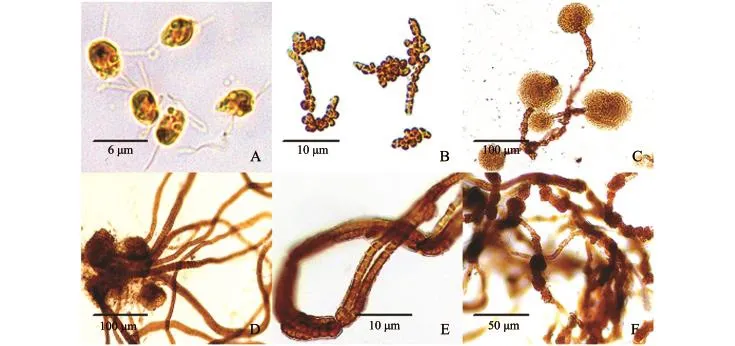
图2 萱藻孤雌生殖丝状体的发生和发育Fig.2 Formation and development of parthenogenetic filaments of brown alga Scytosiphon lomentaria

图3 萱藻孤雌生殖丝状体育苗Fig.3 Seedling by parthenogenetic filaments of brown alga Scytosiphon lomentaria
3 讨论
萱藻的常规人工育苗要经历合子采集、盘状体孢子体室内培育、游孢子采集和幼苗培育等阶段,一般需要6个月左右的培育时间。由于育苗时间长,特别是在夏季高温期内,杂藻大量繁衍导致盘状孢子体死亡或发育程度降低,难以获得大量孢子,导致育苗失败[11-12]。本研究中,根据萱藻配子异宗结合的特点[6],从单株种藻采集的配子孤雌生殖形成盘状体上获得丝状体,经增殖后,采用丝状体采苗的方法,将丝状体切碎并撒在维尼纶绳等附着基上,丝状体细胞直接萌发形成萱藻幼苗,将育苗时间缩短到20~30 d。张泽宇等[13]报道了使用从萱藻配子结合后的合子萌发形成的盘状体上获得的丝状体进行采苗和育苗的研究结果,但该方法中切碎后的丝状体仍要经历盘状孢子体形成、生长,以及单室孢子囊形成、成熟和游孢子放散等阶段,同样存在着育苗时间长、夏季高温期难以逾越的问题。
温度是影响丝状体形成和幼苗萌发的最重要因子之一。本试验中发现,10~20℃范围内,温度越高越利于丝状体的形成和生长,但温度越低越利于幼苗的形成。10℃下,切碎的丝状体细胞在短时间内可形成幼苗,且随着培养时间的延长几乎所有的细胞均可形成幼苗,但在此温度下,丝状体几乎不生长;15℃下,只有部分枝端细胞和与基质接触的丝状体细胞形成幼苗,未形成幼苗的丝状体仍在继续生长;20℃下,丝状体细胞不形成幼苗,只进行细胞分裂,增加丝状体长度,且生长速度明显快于15℃。丝状体生长和幼苗萌发适应不同温度的特性为其增殖培养和采苗提供了便利的条件,作者于2014年采用20℃下丝状体切碎增殖的方法,在2~3个月内获得了大量的丝状体,在秋季自然水温降至12℃左右时将丝状体切碎并撒在维尼纶绳等附着基上,在常温下成功地培育出一定数量的萱藻幼苗。
不同温度对圆形细胞形成幼苗的影响与丝状体藻段基本相同,20℃下,圆形细胞拉长后经多次细胞分裂又形成了丝状体。10℃下,由圆形细胞形成的幼苗生长很快,藻体先进行细胞横分裂,成为十余个细胞的单列细胞藻体后,藻体基部细胞逐渐增大,向下分生出多条假根丝,经分裂形成盘状固着器附着在基质上。随后,自基部细胞开始细胞纵分裂,形成多列细胞藻体,再经过多次纵横分裂后生长成为肉眼可见的圆柱状萱藻幼苗。
参考文献:
[1]曾呈奎.中国海藻志(第三卷):褐藻门(第二册)墨角藻目[M].北京:科学出版社,2000:54-56.
[2]钱树本,孙军,刘涛.海藻学[M].青岛:中国海洋大学出版社,2014:636-637.
[3]李伟新,朱仲嘉,刘凤贤.海藻学概论[M].上海:上海科学技术出版社,1982:151-153.
[4]孙杰,缪静,朱路英,等.烟台沿海4种常见海藻的氨基酸分析及营养评价[J].安徽农业科学,2008,36(8):3081-3082.
[5]王庆钧,谷越,杨颖,等.萱藻中岩藻聚糖硫酸脂的提取工艺优化及其保肝护肝作用[J].大连海洋大学学报,2015,30(4):417-421.
[6]Kogame K.A taxonomic study of Japanese Scytosiphon(Scytosiphonales,Phaeophyceae),including two new species[J].Phycological Research,1998,46(1):39-56.
[7]堀輝三.藻類的生活史集成:褐藻·红藻類:第2卷[M].东京:内田老鶴圃,1993:54-55.
[8]Nakamura Y,Tatewaki M.The life history of some species of the Scytosiphonales[J].Scientific Papers of the Institute of Algological Research,Faculty of Science,Hokkaido University,1975,6(2):57-93.
[9]Parente M I,Neto A I,Fletcher R L.Morphology and life history of Scytosiphon lomentaria(Scytosiphonaceae,Phaeophyceae)from the Azores[J].Journal of Phycology,2003,39(2):353-359.
[10]张泽宇,李晓丽,宋玲君,等.萱藻生活史中盘状体阶段生长特性[J].中国水产科学,2009,16(4):525-532.
[11]久保昭史.萱藻科有用海藻的養殖研究[J].神水試業績,1987(3):41-48.
[12]三浦昭雄.食用藻類の栽培[M].東京:疭星社厚生閣,1992:101-105.
[13]张泽宇,李晓丽,刘宏宇,等.萱藻丝状体诱导培养及采苗研究[J].大连水产学院学报,2010,25(1):14-18.
中图分类号:Q945.51
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.03.001
文章编号:2095-1388(2016)03-0231-06
收稿日期:2015-09-23
基金项目:辽宁省自然科学基金资助项目 (2015020800)
作者简介:李晓丽 (1980—),女,博士。E-mail:lixiaoli@dlou.edu.cn滴移入数个铺有载玻片的培养皿 (直径15 cm)内,添加培养液后在室温下静置过夜,于次日上午移到温度为20℃、光周期为12 h/d、光照强度为40 μmol/(m2·s)的条件下培养。
Seedling collecting and filaments rearing from parthenogenetic gametes of brown alga Scytosiphon lomentaria
LI Xiao-li,SHEN Yuan,CAO Shu-qing,ZHANG Ze-yu
(Key Laboratory of Mariculture&Stock Enhancement in North China’s Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Abstract:Filaments were induce by parthenogenetic gametes and seedlings were collected and reared in brown alga Scytosiphon lomentaria in coastal Dalian to investigate seedlings by parthenogenetic gametes.It was found that the gametes released from a single thallus developed into crusts from differentiated filaments with diameter of above 100 μm.The best growth of crusts and filaments and the induction of filaments were observed at water temperature of 20℃,followed by 15℃ and poor at 10℃.The seedlings were collected from filamentous bodys which were stripped after proliferation and then chopped,developed the earliest with the maximal developmental rate at 10℃,followed by 15℃ and no formation of seedlings at 20℃.After isolation and proliferation,the filaments were cut into fragments and then spread on the vinylon nets,and grown into cylindrical plants with body length of(11.0±0.3)mm in 30 days in indoor culture at 10℃.Then the seedlings were transformed to the open sea and cultured in four months to have body length of about 60 cm.
Key words:Scytosiphon lomentaria;gamete;parthenogesis;filament;seedling collecting;indoor culture

