p GEX-4T-2-A表达系统的构建及其融合蛋白GST-Pla A的表达优化
刘开放,薛正莲,王 洲
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
p GEX-4T-2-A表达系统的构建及其融合蛋白GST-Pla A的表达优化
刘开放,薛正莲∗,王 洲
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
摘要:构建pGEX-4T-2-A表达质粒来获得融合蛋白GST-Pla A.PCR扩增粘质沙雷氏菌PL-06磷脂酶A1基因Pla A,定向克隆到pGEX-4T-2载体上.重组质粒转化至大肠杆菌JM109菌株中,进行阳性克隆的筛选并测序.将测序正确的质粒转化到表达菌株BL21(DE3)PLysS中,经IPTG诱导并进行SDS-PAGE分析,验证融合蛋白GST-PlaA的表达,同时优化培养条件.p GEX-4T-2-A表达质粒构建成功,其融合蛋白GST-Pla A以包涵体形式表达.在OD值为0.8时加入终浓度为0.5 m M的IPTG,37℃诱导8 h时,融合蛋白GST-Pla A表达量最高.为磷脂酶A1蛋白的纯化与功能研究奠定了基础.
关 键 词:磷脂酶A1;融合蛋白;SDS-PAGE;表达条件
磷脂酶是水解甘油磷脂的一类酶,磷脂酶A1能够特异性水解天然磷脂Sn-1位酰基,得到L-β溶血磷脂.许多微生物能产生磷脂酶A1,如曲霉菌、沙雷氏菌MK1和灰色链霉菌等.在工业生产中其主要用途是生产溶血磷脂、大豆油脱胶、加工卵黄、奶酪及甘油二酯的制备等[1-2].在植物油脱胶方面,磷脂酶A1的高效率、低能耗、低污染等优势受到广泛地关注、应用及研究[3].
基于基因工程技术的发展以及表达系统的诸多优点,选用微生物来源的磷脂酶A1进行克隆和表达的研究越来越多.苏燕南[4]等构建的重组菌BL21/Ap28菌株,最终表达了磷脂酶A1.但其表达水平低,酶活也较低[5],传统发酵优化很难大幅度提高酶活以供工业所需,且其纯化比较困难.因此,鉴于GST标签具有助融纯化的特性,能使酶活力提高且有利于其纯化分离,实验通过将目的基因Pla A连接到带有GST标签表达载体p GEX-4T-2,旨在表达GST-Pla A融合蛋白并对表达菌株的培养条件进行优化,为Pla A蛋白的纯化和功能研究,乃至磷脂酶A1蛋白晶体结构的研究奠定基础.
1 材料和方法
1.1 菌种质粒及主要试剂
粘质沙雷氏菌(Serratia marcescens)PL-06、大肠杆菌(Escherichia coli)JM109、BL21(DE3)PLysS由安徽工程大学生化学院208实验室保藏;AP28质粒由安徽工程大学生化学院208实验室构建;质粒载体p GEX-4T-2由江南大学国家工程实验室惠赠.
酵母粉、胰蛋白胨、琼脂糖、十二烷基硫酸钠(SDS)、三羟甲基氨基甲烷(Tris)、聚丙烯酰胺、双叉聚丙烯酰胺、Protein Marker和IPTG购自生工生物工程(上海)股份有限公司;Bam HΙ限制性内切酶、EcoRΙ限制性内切酶、T4 Ligase购自Thermo公司;其他部分试剂购自国药.
1.2 方法
(1)AP28质粒(模版)的提取.参照生工生物(上海)股份有限公司SanPrep柱式质粒DNA微量抽提试剂盒说明书步骤进行提取.
(2)目的基因pla A的扩增.设计pla A基因的一对引物,在上游引物和下游引物的5’段分别加上Bam HΙ和EcoRΙ酶切位点,并添加保护碱基.利用合成的引物,以实验室构建的磷脂酶A1基因pla A与p ET-28a重组质粒(简称AP28质粒)为模板进行目的pla A基因片段的扩增.PCR反应扩增条件为: 95℃、5 min预变性后,进行35个循环.参数为:95℃、35 s;56℃、35 s;72℃、35 s;最后一次循环结束后, 72℃再延伸8 min.
(3)重组质粒的构建及鉴定.PCR扩增得到的plaA基因片段通过1%琼脂糖凝胶电泳验证大小后,使用试剂盒进行胶回收.将PCR产物与提纯的pGEX-4T-2质粒,分别用Bam HΙ和EcoRΙ两种内切酶进行双酶切.酶切产物用DNA纯化试剂盒纯化,再通过T4DNA连接酶将pla A基因片段连接到p GEX-4T-2质粒的Bam HΙ和EcoRΙ酶切位点上.构建的重组质粒命名为p GEX-4T-2-A.将重组质粒转入大肠杆菌JM109感受态菌中.涂布在已加入氨苄青霉素LB平板上,挑取生长的单菌落,过夜培养后进行菌液PCR,电泳验证产物大小.同时,对重组质粒p GEX-4T-2-A进行双酶切并电泳验证.两种方法验证正确后送上海生工测序.测序正确后,将重组质粒pGEX-4T-2-A转化到表达菌株BL21(DE3)PLysS中,命名为PLysS/ p GEX-4T-2-A并进行相应菌株的保种.重组质粒p GEX-4T-2-A构建示意图如图1所示.
(4)融合蛋白GST-Pla A表达形式的鉴定.从平板上挑取单菌落PLysS/p GEX-4T-2-A接种至5 m L LB/Amp液体培养基中,在37℃、200 r/min下过夜培养.次日,转接1 m L菌液至100 m L LB培养基中,同样条件下振荡培养至OD值为0.5时加入终浓度为0.2 m M IPTG培养4 h后收菌.4 000 r/min离心,收集菌体,重悬,超声破碎后分别制备全菌,破碎上清,破碎沉淀蛋白样品.样品经煮沸5 min、12 000 r/min离心,上样,SDS-PAGE鉴定融合蛋白的表达形式.
(5)融合蛋白GST-Pla A诱导表达条件优化.依照诱导温度、诱导时间、添加IPTG时的OD值和IPTG加量进行融合蛋白GST-Pla A表达量的优化.诱导温度梯度设为28℃、31℃、34℃、37℃、40℃;诱导时间梯度设为0、2 h、4 h、6 h、8 h、10 h、12 h、14 h;加入IPTG时的OD值梯度设为0.1、0.3、0.5、0.8、1.0、1.2;IPTG加量终浓度梯度设为0、0.01 m M、0.05 m M、0.1 m M、0.2 m M、0.5 m M、1.0 m M、2.0 m M.诱导结束后,制样,SDS-PAGE电泳确定融合蛋白GST-PlaA最优表达条件.

图1 p GEX-4T-2-A重组质粒的构建
2 结果与分析
2.1 AP28质粒(模版)的提取及pla A基因PCR扩增
AP28质粒的提取如图2所示.以AP28质粒为模板,PCR扩增Pla A基因片段如图3所示.由图3可知,扩增产物在goldview染色后的1%琼脂糖凝胶中进行电泳,凝胶成像可见一条约1 000 bp大小的条带,与理论大小为966 bp的Pla A基因片段相符,表明目的基因Pla A片段扩增成功.
2.2 重组质粒pGEX-4T-2-A转化后的菌液PCR和双酶切验证
以重组质粒转化后的菌液为模板进行PCR筛选,结果扩增出约1 000 bp大小片段(见图4),与PlaA基因大小相符.同时,用Bam HΙ和EcoRΙ双酶切重组质粒p GEX-4T-2-A,获得约5 000 bp和1 000 bp大小的两个片段,与质粒p GEX-4T-2和PlaA基因的理论大小相符(见图5).两种方法验证结果说明PlaA基因已插入pGEX-4T-2质粒中.
2.3 重组质粒p GEX-4T-2-A的测序
对重组质粒pGEX-4T-2-A的测序结果表明,Pla A基因的核酸序列正确,且在表达质粒上的基因框架与设计相同,说明重组质粒pGEX-4T-2-A构建成功.

图2 AP28质粒的提取
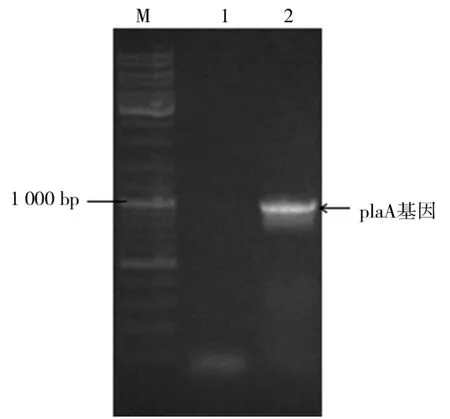
图3 Pla A基因的扩增

图4 重组菌的菌落PCR

图5 重组质粒p GEX-4T-2-A的双酶切
2.4 SDS-PAGE检测融合蛋白GST-PlaA表达形式
PLa A蛋白的理论分子量为35 KDa,GST蛋白的理论分子量为26 KDa,融合蛋白GST-Pla A的理论分子量大小应该为两个蛋白大小之和,即约为61 KDa.重组菌株的SDS-PAGE如图6所示.由图6可知, PLysS/pGEX-4T-2-A全菌样品的SDS-PAGE电泳检测出其表达了理论大小约为61 KDa的融合蛋白GST-Pla A.进一步从破碎上清和破碎沉淀的电泳中可以看出,理论大小的融合蛋白GST-PlaA绝大部分存在于破碎沉淀中,而在破碎上清中看不出有无GST-Pla A蛋白表达.所以,从表达菌株不同位置的SDSPAGE检测结果表明,目的融合蛋白GST-Pla A主要是以包涵体形式表达的.原因可能是蛋白质表达过快,来不及正确折叠.
2.5 融合蛋白GST-Pla A诱导表达条件优化
(1)诱导温度对融合蛋白GST-Pla A表达的影响.取1 m L过夜培养的PLysS/p GEX-4T-2-A菌液接种至已加氨苄青霉素的100 m L LB培养基中.37℃、200 r/min下培养至OD值为0.5加入终浓度为0.2 m M的IPTG后,分别在28℃、31℃、34℃、37℃和40℃诱导4 h后收菌,分别制样品,SDS-PAGE电泳检测.诱导温度对GST-Pla A蛋白表达水平的影响如图7所示.由图7可知,在28℃上升至40℃过程中,融合蛋白GST-Pla A的表达量先增加后降低,且在37℃时GST-Pla A表达量达到最高.所以,选择37℃作为最佳诱导温度.
(2)诱导时间对融合蛋白GST-Pla A表达的影响.取1 m L过夜培养的PLysS/p GEX-4T-2-A菌液接种至已加氨苄青霉素的100 m L LB培养基中.37℃、200 r/min下培养至OD值为0.5加入终浓度为0.2 m M的IPTG后,37℃条件下分别在诱导0、2 h、4 h、6 h、8 h、10 h、12 h、14 h时取样,制样品,SDSPAGE电泳检测.诱导时间对GST-Pla A蛋白表达水平的影响如图8所示.由图8可知,从0~14 h过程中,融合蛋白GST-Pla A的表达量逐渐升高,在8 h达到最大值,之后诱导时间增加表达量明显降低.所以,确定最佳诱导时间为8 h.

图6 重组菌株的SDS-PAGE
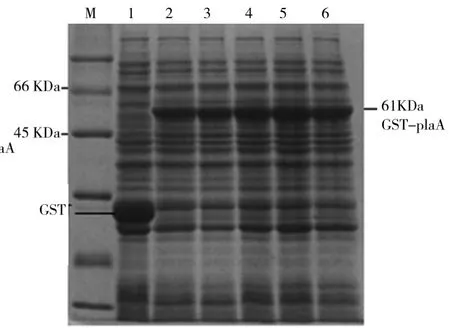
图7 诱导温度对GST-Pla A蛋白表达水平的影响
(3)IPTG加入时的OD值对融合蛋白GST-Pla A表达的影响.取1 m L过夜培养的PLysS/p GEX-4T-2-A菌液接种至已加氨苄青霉素的100 m L LB培养基中.37℃、200 r/min下培养至OD值分别为0.1、0.3、0.5、0.8、1.0和1.2时加入终浓度为0.2 m M的IPTG,37℃诱导8 h后收菌,分别制样品,SDS-PAGE电泳检测.诱导起始OD值对GST-Pla A蛋白表达的影响如图9所示.由图9可知,当IPTG诱导初始OD值从0.1~0.8时,融合蛋白GST-Pla A的表达量上升至最高,OD值大于0.8后随着OD值的上升表达量下降.因此,选择的最佳OD值为0.8.
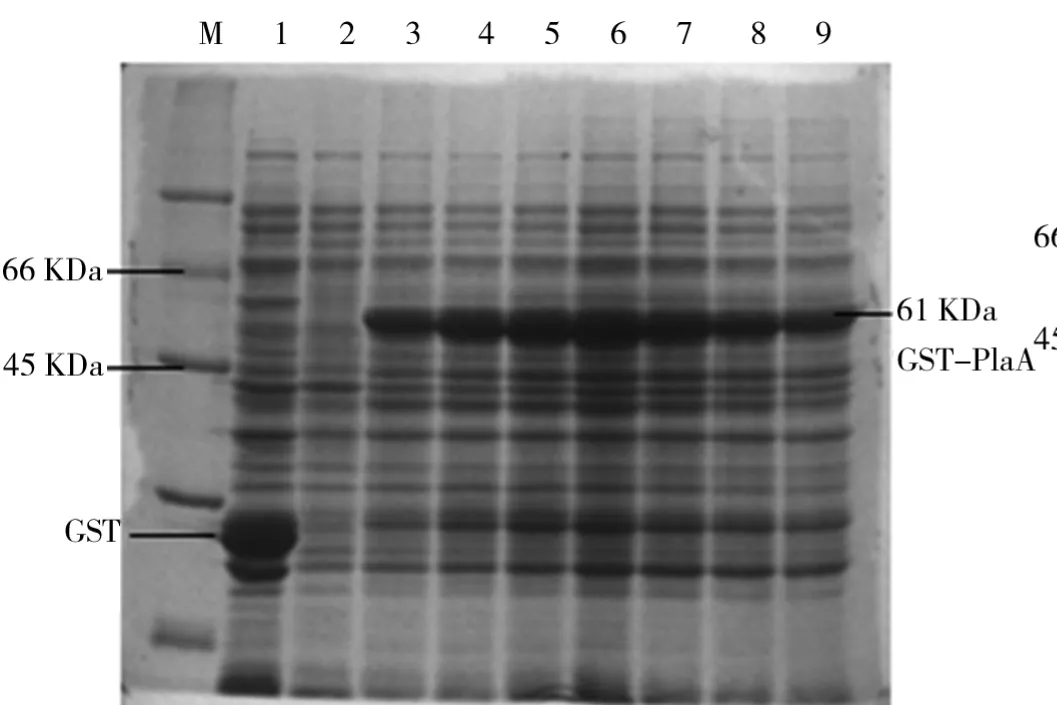
图8 诱导时间对GST-Pla A蛋白表达水平的影响

图9 诱导起始OD值对GST-Pla A蛋白表达的影响
(4)IPTG浓度对融合蛋白GST-Pla A表达的影响.取1 m L过夜培养的PLysS/pGEX-4T-2-A菌液接种至已加氨苄青霉素的100 m L LB培养基中,37℃、200 r/min下培养至OD值为0.8时分别加入终浓度0、0.01 m M、0.05 m M、0.1 m M、0.2 m M、0.5 m M、1.0 m M和2.0 m M的IPTG, 37℃诱导8 h收菌,分别制样品,后经SDS-PAGE电泳检测.IPTG浓度对GST-Pla A蛋白表达的影响如图10所示.由图10可知,当IPTG终浓度为0.5 m M 时,GST-Pla A蛋白表达水平最高.诱导剂终浓度过低,没有融合蛋白表达,诱导剂终浓度大于0.5时,表达水平保持稳定且稍有下降.因此,确定最佳的IPTG诱导浓度为0.5 m M.
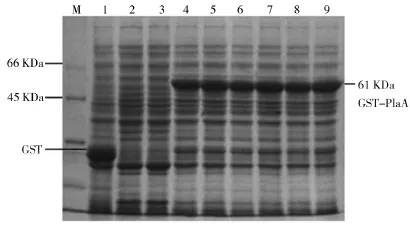
图10 IPTG浓度对GST-Pla A蛋白表达的影响
3 结论与讨论
包涵体形成的原因很多,如蛋白质表达过快、异源蛋白的错误折叠、蛋白质分子间的化学作用等.磷脂酶A1可以分解磷脂,细胞膜主要由磷脂双分子层组成,因而有可能对细胞膜有毒副作用.而宿主菌为了自身的保护作用,也有可能导致GST-Pla A以包涵体形式表达.对诱导温度、诱导时间、加入IPTG时的OD值和IPTG加量这4个单因素进行优化.由于诱导温度过低或过高、诱导时间过短或过长、加入IPTG 时OD值过低或过高以及IPTG浓度过低或过高,都会影响菌体GST-Pla A的表达水平.这是由于大肠杆菌有自己的最适培养温度,菌体内代谢酶受温度影响,温度过低或过高都不利于细菌的生长,进而影响重组蛋白表达.诱导时间对菌体重组蛋白的表达影响明显,时间过短,IPTG还没有来得及诱导表达目的蛋白;而时间过长,IPTG的毒副作用以及菌体自身的衰亡,也导致目的重组蛋白表达量降低.加入IPTG时的OD过低,菌体量过少影响重组蛋白表达;过高又会因为菌体自溶同样降低重组蛋白的表达.而鉴于IPTG的经济性和对宿主的毒性,IPTG浓度过低不足以诱导表达;过高对宿主有一定的抑制作用,同样会使重组蛋白表达量降低.利用基因工程方法生产重组蛋白的关键是高表达、易纯化和高生物活性,而高表达是原核表达技术的基础.综上所述,根据以上4个条件的优化,确定PlysS/p GEX-4T-2-A菌株诱导表达重组融合蛋白的最优表达条件为:在OD值为0.8时加入终浓度为0.5 m M的IPTG,37℃诱导8 h.希望在此重组融合蛋白GST-PlaA高表达条件下,能够通过包涵体的变复性得到预期高活性以及易纯化蛋白.
参考文献:
[1] M Jahani,M Alizadeh,M Pirozifard,et al.Optimization of enzymatic degumming process for rice bran oil using response surface methodology[J].Food Science and Technology,2008,41(10):1 892-1 898.
[2] 王丽丽,汪勇,曹茜,等.响应面优化磷脂酶A1催化酯化制备甘油二酯[J].油脂化工,2010,35(11):40-43.
[3] 李秋生,杨继国,杨博,等.不同磷脂酶用于植物油脱胶的研究[J].中国油脂,2004,29(1):19-22.
[4] 苏燕南.磷脂酶A1基因的克隆和原核表达[D].芜湖:安徽工程大学,2013.
[5] J H Fu,H Q Huang,K Meng,et al.A novel cold-adapted phospholipase A1 from Serratia sp.xjF1:Gene cloning,expression and characterrization[J].Enzyme and Microbial Technology,2008,42(2):187-194.
Construction of expressive system pGEX-4T-2-A and the expression and optimization of its GST-PlaA fusion protein
LIU Kai-fang,XUE Zheng-lian∗,WANG Zhou
(College of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China)
Abstract:To construct a recombinant plasmid p GEX-4T-2-A for GST-Pla A fusion protein expression.PCR was used to amplify phopholipase A1 gene from Serratia marcescens PL-06 named pla A and inserted into the pGEX-4T-2 vector.The recombinant plasmid was transformed to Escherichia coli JM109 strains to screen the positive recombinant clones and then sent to be sequenced.The correct sequenced recombinant plasmid was transformed to a Escherichia coli BL21(DE3)PLysS strains and the GST-Pla A fusion protein expression after IPTG induction was confirmed by SDS-PAGE analysis.Its cultivation conditions was also optimized.The plasmid p GEX-4T-2-A was constructed successfully,the GST-Pla A fusion protein expressed in the form of inclusion bodies.While the OD was 0.8 and induced at 37℃for 8 h with 0.5 m M IPTG,the GST-Pla A fusion protein expression was at the highest level.This experiment established the foundation for the purification and function of phospholipase A1 protein.
Key words:phospholipase A1;fusion protein;SDS-PAGE;expression conditions
中图分类号:Q78
文献标识码:A
收稿日期:2015-10-26
基金项目:国家自然科学基金资助项目(31471615,31501465)
作者简介:刘开放(1990-),男,安徽亳州人,硕士研究生.
通讯作者:薛正莲(1967-),女,安徽芜湖人,教授,硕导.

