不同型号血细胞分析仪检测结果的比对分析
胡 莉,韦永琼
(四川省成都市妇女儿童中心医院检验科 610091)
·临床研究·
不同型号血细胞分析仪检测结果的比对分析
胡莉,韦永琼
(四川省成都市妇女儿童中心医院检验科610091)
目的探讨检验科不同型号血细胞分析仪检测结果的一致性,保证检验结果的可靠性。方法根据美国临床化学标准化委员会的EP9-A2文件要求,用适合浓度的新鲜全血标本分别在迈瑞BC5390-Ⅰ、BC5390-Ⅱ和参比仪器迈瑞流水线BC6900上对白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(PLT)4项指标进行测定,计算回归方程、相关系数及相对偏差,评估结果间的可比性。结果与迈瑞流水线比较,其他2台血细胞分析仪测定结果与其均有良好的相关性(r>0.975),相对偏差均小于1/2美国临床实验室改进修正法规′88允许误差。结论3台血细胞分析仪检测结果具有可比性,保证了检验科血常规结果的一致性及检验报告的可靠性。
血细胞分析仪;比对;可比性
全自动血细胞分析仪因其具有操作简便、检测速度快、结果准确可靠、标本用量少、可报告参数多等诸多优点,自发明以来已得到广泛应用。随着检验医学的不断发展和医院工作量的日益增多,作为临床三大常规检测项目之一的血常规标本量更是与日俱增,因此,同一实验室普遍拥有不同厂家或者相同厂家不同型号的多台血细胞分析仪。本院检验科也同时使用多台不同型号的迈瑞血细胞分析仪。虽然这些仪器的检测原理大致相同或相似,但由于其内部结构、性能之间存在的差异及其他因素的影响,会出现同一患者标本在各台仪器间的检测结果有不可接受的差异[1],从而给临床诊疗活动带来困扰。因此,实验室内部实现同一标本检测结果在各仪器间的统一显得至关重要。只有满足了检测结果的一致性,才能保证检验报告的准确性,为临床诊疗疾病提供可靠依据。为确保本实验室内同一标本在不同血细胞分析仪间检测结果的一致性,本文根据美国临床化学标准化委员会(NCCLS)EP9-A2文件要求[2],对本实验室3台不同型号的迈瑞血细胞分析仪的白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(PLT)4项检测结果进行比对分析和偏差评估,确保本室内检验报告的准确性和可比性,现将结果报道如下。
1资料与方法
1.1标本来源每天选取本院门诊及住院患者的5份新鲜乙二胺四乙酸二钾(EDTA-K2)抗凝全血标本,浓度含高、中、低值,覆盖生物参考区间,连续8 d。整个实验在标本老化前完成。
1.2仪器与试剂3台仪器为深圳迈瑞公司生产的迈瑞流水线BC6900(编号SPA46151115)、BC5390-Ⅰ(编号SM-45000421)、BC5390-Ⅱ(编号SM-45000419)全自动血液分析仪,试剂、质控品和校准物为仪器配套产品。以参加室间质评成绩优秀的BC6900作为参比仪器,BC5390-Ⅰ、BC5390-Ⅱ为比对仪器。
1.3实验条件每台仪器开机后做本底测试并定期进行保养维护,每天室内质控在控,以保证各仪器在良好的实验条件下进行标本检测。
1.4方法试验参照NCCLS EP9-A2文件进行。每天选取8份标本,浓度尽可能在测定范围内均匀分布,并且应涵盖医学决定水平,同时用迈瑞BC6900、BC5390-Ⅰ、BC5390-Ⅱ3台血细胞分析仪作为常规标本检测,按照1~8、8~1的顺序连续检测5 d,共40个标本。对所得的血常规结果(WBC、RBC、Hb、PLT)进行比对分析和偏差评估。偏差=(测定值-参考值)/参考值×100%。
1.5统计学处理采用Excel 2003软件进行数据处理及统计学分析,建立比对仪器与参考仪器间的回归方程Y=bX+a,求得相关系数(r),当r>0.975或r2>0.950,表示仪器间相关性好,检测结果具有一致性及可信性;同时计算比对仪器与参考仪器的相对偏差,根据美国临床实验室改进修正法案(CLIA′88)标准进行判断,以小于1/2 CLIA′88为临床可接受水平[3-6]。判定标准:WBC≤7.5%,RBC≤3%,Hb≤3.5%,PLT≤12.5%。
2结果
2.1离群值检验根据EP9-A2文件要求,本实验中WBC、RBC、Hb及PLT 的4个检测项目均无方法内和方法间的离群值。
2.2相关性分析测试仪器BC5390-Ⅰ、BC5390-Ⅱ与参比仪器BC-6900进行相关性分析,结果显示WBC、RBC、Hb及PLT 4项指标r>0.975,直线回归方程的斜率和截距可靠,表明所选标本的浓度范围是合适的,各项目在仪器之间也有良好的相关性,见表1。

表1 两台比对仪器与参比仪器的相关性分析
2.3相对偏差计算测试仪器与参比仪器WBC、RBC、Hb、PLT 4项指标检测结果的相对偏差,以相对偏差小于1/2CLIA′88为临床可接受误差。BC5390-Ⅰ、BC5390-Ⅱ的相对偏差均小于规定的允许误差,见表2,表明同一标本在本实验室3台血球仪上检测时,其结果不会有较大的偏差。
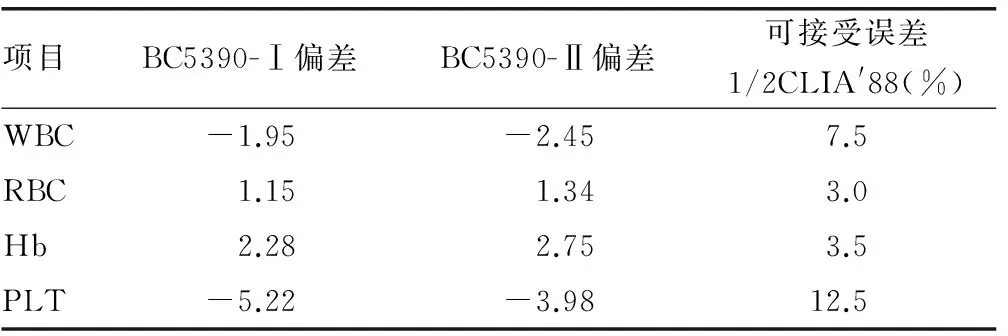
表2 两台比对仪器与参比仪器的相对偏差比较
3讨论
俗称“三大常规”之一的血常规,是临床最常见的检测指标,无论是生病入院还是健康体检都可能需要进行血常规检测,导致其标本量在每个医院中都是最大的,因而实验室仅仅配置1台血细胞分析仪已经满足不了临床的需要,目前大部分实验室都配有多台相同或不同厂家的血细胞分析仪,不同的血细胞分析仪使用各自的检测系统,在良好的仪器状态下,各系统间可能具有较好的重复性,但在不同的仪器之间,由于系统配置的不同,如检测的方法、反应杯的体积、试剂、质控品、校准品及所处环境等的不同,可能导致相互间的检测结果有较大的偏差[5,7],即出现在同一实验室测定同一标本而得出不一致的结果。因此,实验室如果不能保证各仪器间检测结果的一致性,不但会导致检验质量遭到异议、给临床诊疗活动带来困扰,甚至引发医疗纠纷、医疗事故的发生,因此,实验室内部必须首先实现不同检测系统间结果的统一。
为了满足实验室内部结果的统一,除了应有完善的室内、室间质量检测体系,还需建立合理的比对程序,定期做好仪器间的比对工作,是保证检测结果准确性的重要手段,也是室内质量控制的一个良好补充[8]。医疗机构临床实验室管理办法明确规定同一检验项目在不同仪器或系统上测定时,每年至少要比对1次[9];ISO15189规定每半年至少要比对1次[10]。本研究参照EP9-A2的文件要求,用新鲜全血作为标本[11],以参加室间质评结果优秀的BC6900为参比仪器,对本室3台同一厂家不同型号血细胞分析仪的4个主要项目参数(WBC、RBC、Hb、PLT)进行了比对分析。结果显示3台仪器检测项目参数方法内和方法间均无离群点,说明所选标本浓度范围合适;表1、2中数据显示,参比仪器BC6900与2台测试仪器BC5390-Ⅰ、BC5390-Ⅱ具有良好的相关性(r>0.975),以相对偏差小于1/2CLIA′88为临床可接受误差,3台仪器间的偏差均在可接受范围内,满足CLIA′88能力验证分析质量要求,从而实现了不同仪器,不同检测系统最终结果的一致性,满足临床需求。
综上所述,在已实现检验仪器自动化的今天,随着其自动化程度的不断提高,检验质量要求更加严格,质量管理也渐趋标准化,因此实验室必须建立完善的比对程序制度,定期进行比对分析[12]。这既是重要的质量控制方法,也是实现新鲜全血在同一实验室不同血细胞分析仪间传递的可溯源性,从而使各检测系统之间具有可比性、一致性。只有实验室检测结果的准确、一致,才能真正满足临床所需。
[1]王薇,王治国,钟堃,等.同一医院内白细胞计数在3台不同血细胞分析系统上可比性验证[J].国际检验医学杂志,2011,32(5):620-621.
[2]The National Committee for Clinical Laboratory Standards.EP9-A2 Method comparison and bias estimation using patient sample[S].2nd Edition,Wayne,PA,USA:NCCLS,2002.
[3]冯仁丰.临床检验质量管理技术基础[M].2版.上海:上海科学技术文献出版社,2007:185-203.
[4]沈观樵,金海勇,童海江.不同血细胞分析仪比对分析及偏差评估[J].现代实用医学,2014,26(11):1448-1449.
[5]钱靖.三台不同型号血细胞分析仪检测结果的比对研究[J].标记免疫分析与临床,2015,22(6):581-583.
[6]International Organization for Standardization.ISO15189 Medical laboratories-particular requirements for quality and competence[S].Geneva:ISO,2003.
[7]李建华.新鲜血比对方法在血细胞分析仪中的应用[J].检验医学与临床,2013,10(1):91-92.
[8]高宁,王香玲,刘军,等.2台生化分析仪血清酶测定结果的可比性验证[J].国际检验医学杂志,2013,34(3):352-354.
[9]曹荣桂,申子瑜.医院管理学-临床实验室管理分册[M].北京:人民卫生出版社,2003:143.
[10]中国合格评定国家认可中心.ISO15189 医学实验室-质量和能力的特殊要求[S].北京:CNAS,2003.
[11]彭楷,骆展鹏,黎美君,等.血站不同型号血细胞分析仪检测结果比对分析[J].国际检验医学杂志,2015,36(6):747-748.
[12]陈丽芳,林淑仪,姚淑雯,等.多台血细胞分析仪检测结果可比性分析[J].广州医药,2013,44(1):39-40.
2016-01-22修回日期:2016-03-25)
10.3969/j.issn.1673-4130.2016.12.037
A
1673-4130(2016)12-1687-02

