南瓜多糖的提取及其抗氧化性研究
常海军,王小燕
(1.重庆工商大学环境与资源学院,重庆市特色农产品加工储运工程技术研究中心,重庆 400067;2.西南大学食品科学学院,重庆 400715)
南瓜多糖的提取及其抗氧化性研究
常海军1,王小燕2
(1.重庆工商大学环境与资源学院,重庆市特色农产品加工储运工程技术研究中心,重庆400067;2.西南大学食品科学学院,重庆400715)
摘要:【目的】 对酶法提取南瓜多糖的提取条件进行优化,并对其抗氧化能力进行测定.【方法】 以南瓜为原料,通过单因素试验和正交试验优化了南瓜多糖果胶酶提取工艺条件,并采用水杨酸法测定了南瓜多糖对羟基自由基(·OH)的清除效果.【结果】 南瓜多糖的最佳提取工艺条件为:提取温度30 ℃,果胶酶质量浓度2.0%,料液比1∶40,提取时间2.5 h;该工艺条件下多糖的得率为27.19%.南瓜多糖质量浓度为0.3 mg/mL时对羟基自由基(·OH)的清除率最高,清除率为23.30%.【结论】 研究结果为南瓜的精深加工提供了理论依据,并为深入研究南瓜多糖的功效奠定了基础.
关键词:南瓜多糖;果胶酶;提取;抗氧化性
南瓜(Cucurbitamoschataduch)为葫芦科南瓜属一年生蔓性草本植物,营养成分丰富,含有多种功能性营养成分,具有很高的食疗保健作用,被誉为“天然营养保健食物”[1].南瓜多糖(pumpkin polysaccharide,PP)呈棕色粉末,是南瓜活性成分中最重要、最具潜力的功能成分之一.南瓜多糖具有降血脂、降血糖、防癌等功能[2-3].目前,对南瓜多糖所报道的提取方法主要有热水浸提法[4-5]、碱法提取法[6]、超声提取法[7-8]和复合酶提取法[9-10]等,其提取工艺各有特点.热水浸提法是一种常用提取方法,其操作简单,但耗时长,得率低.超声辅助法是在不改变提取物生物活性的前提下,先利用超声波破坏植物细胞壁,来缩短提取时间,但因设备限制难以规模化生产.酶提取法是一种较为有效的提取方法,它可分解细胞壁使多糖更易析出,且可以降解蛋白质,具有条件温和、杂质易除和得率高等优点.常用的酶有纤维素酶、木瓜蛋白酶和果胶酶等[11].于翠芳等[12]采用纤维素酶对南瓜多糖的酶法提取条件进行了优化.孙婕等[13]对南瓜多糖的复合酶法提取工艺进行了优化.但多酶法提取工艺较为复杂,另外多酶间的相互作用以及作用强度等因素难以确定,基于此,本研究选用果胶酶对南瓜多糖的提取工艺进行研究,并初步研究了南瓜多糖的抗氧化特性,以期为南瓜多糖在食品和医药方面的应用提供理论依据.
1材料与方法
1.1材料和试剂
成熟南瓜,购于重庆南岸四公里永辉超市.
果胶酶(pectinase,活力≥500 000 U/g,BR),其他所用试剂均为国产分析纯.
1.2仪器和设备
AL104电子分析天平(梅特勒-托利多仪器有限公司);DFY-400摇摆式高速万能粉碎机(上海振春粉体设备有限公司);TDZ5-WS多管架自动平衡离心机(长沙湘仪离心机仪器有限公司);DHG-9070A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);HH-S数显恒温水浴锅(江苏正基仪器有限公司);UV-3系列紫外分光光度仪(上海美谱达仪器有限公司)等.
1.3试验方法
1.3.1工艺流程南瓜粉制备[3]:南瓜→去皮→去瓤→切片→烘干(70 ℃、24 h)→粉碎→100目过筛→南瓜粉.
南瓜多糖提取[13]:1 g南瓜粉→果胶酶→水溶解→酶解(酶量、温度、时间)→90 ℃灭酶活→离心取上清液→加入4倍体积的无水乙醇→离心沉淀→干燥沉淀得粗多糖.
1.3.2南瓜多糖总糖测定采用蒽酮比色法[7-8].
1.3.3南瓜多糖提取的单因素试验南瓜多糖提取的单因素试验参考Sun方法[14],在固定条件果胶酶用量1.5%,料液比为1∶30,提取时间2 h,提取温度40 ℃的情况下,设置温度(30,40,50,60,70 ℃),料液比(1∶10、1∶20、1∶30、1∶40和1∶50),酶用量(0.5%、1.0%、1.5%、2.0%、2.5%),提取时间(1、1.5、2、2.5、3 h)的单因素试验,研究各因素对南瓜多糖得率的影响.
1.3.4南瓜多糖提取的正交试验根据单因素试验结果,综合考虑多个因素相互效应,以南瓜多糖的提取率和纯度作为测定指标,选取提取温度、果胶酶浓度、料液比和提取时间为因素,做L9(34)正交试验[15],提取步骤同单因素试验,进一步优化南瓜多糖的提取条件.
按照正交表进行提取试验,对各组试验结果进行极差分析和方差分析,以确定最佳提取工艺条件.
1.3.5羟基自由基(·OH)清除能力测定取5支具塞试管,编号,每支试管各加入9 mmol/L的FeSO4和浓度为9 mmol/L的水杨酸-乙醇混合液各2 mL,按试管编号加入0.1、0.2、0.3、0.4、0.5 mg/mL南瓜多糖溶液2 mL.最后加入浓度为8.8 mmol/L的H2O22 mL启动反应,于室温下反应1 h,并以蒸馏水代替南瓜多糖溶液作空白调零,在510 nm处测定样品的吸光度,记录数据[13,16].清除率按下式计算:
清除率(%)=(A0-AS)/A0×100%
式中:A0为空白对照液的吸光度,As为加入提取液后的吸光度.
1.4数据分析
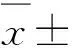
2结果与分析
2.1南瓜多糖蒽酮比色法测定结果
通过蒽酮比色法所制作的葡萄糖标准曲线回归方程式为y=0.008 2x-0.008 2,精度较高(R2=0.997 4),测得南瓜中总糖的含量约为27.3%.
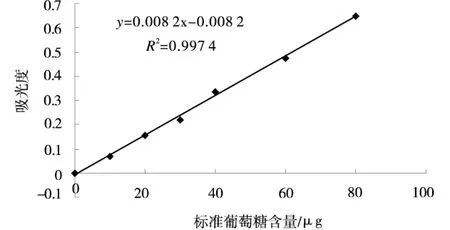
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2南瓜多糖提取工艺单因素试验结果
2.2.1温度对南瓜多糖得率的影响如图2所示,在40 ℃之前随温度上升,南瓜多糖提取率上升,而在40 ℃之后随着温度升高,南瓜多糖提取率呈下降趋势.可能是由于未达到果胶酶的最适温度之前,升高温度有利于细胞壁的破裂或溶解,使细胞内物质流出,南瓜多糖提取率随温度升高而提高.而过高的温度又会使果胶酶失活,酶促反应过程受到抑制,使南瓜多糖的提取率下降.因而选择最佳提取温度为40 ℃.
2.2.2果胶酶浓度对南瓜多糖得率的影响如图3所示,果胶酶体积分数在低于1.5%时,南瓜多糖提取率随酶体积分数的增高而显著增高;当酶体积分数高于1.5%时,随酶体积分数增加,南瓜多糖提取率明显下降.其原因可能是酶体积分数过高导致南瓜多糖发生部分降解的缘故.综合分析,确定提取南瓜多糖的最佳果胶酶浓度为1.5%.

图3 果胶酶浓度对南瓜多糖提取率的影响Fig.3 Effects of pectinase concentration on theyield of crude polysaccharide
2.2.3料液比对南瓜多糖得率的影响如图4所示,料液比达到1∶30之前,南瓜多糖的提取率随着溶剂量的增加显著增大,料液比超过1∶30后,提取率随着溶剂量的增加不再显著增加.考虑到生产成本、经济效益等方面的因素,选择提取南瓜多糖的最佳料液比为1∶30.

图4 料液比对粗多糖得率的影响Fig.4 Effects of liquid to solid water ratio on the yieldof crude polysaccharide
2.2.4时间对南瓜多糖得率的影响如图5所示,提取时间在2 h之前时,随着提取时间的延长南瓜粗多糖的得率逐渐提高,而当提取时间超过2 h以后,粗多糖得率反而呈现下降趋势,这可能是由于提取时间过长导致粗多糖分解或者损失;另外,时间过长,也会影响到粗多糖的品质.综合来看,南瓜多糖提取的最佳提取时间为2 h.

图5 时间对粗多糖得率的影响Fig.5 Effects of extraction time on the yieldof crude polysaccharide
2.3南瓜多糖提取工艺正交优化试验结果
由表1,表2可以看出,以提取率为测定指标时,果胶酶法提取南瓜多糖各因素的主次顺序为果胶酶浓度>提取温度>提取时间>料液比;南瓜多糖提取的最佳工艺组合为A1B3C3D3,即为正交组合中3号试验组,即果胶酶法提取南瓜多糖的最优提取条件为提取温度30 ℃,果胶酶浓度2.0%,料液比1∶40,提取时间2.5 h.该工艺条件下南瓜多糖的得率为27.19%.

表1 南瓜多糖提取L9(34)正交试验结果直观分析表

表2 南瓜多糖提取正交试验方差分析表
从表中F值和F临界值的比较可以看出,各因素均无显著影响,相对来说B果胶酶浓度和A提取温度对南瓜粗多糖的得率影响大些,提取时间和料液比的影响较小.通过对各因素做方差分析,其对试验结果的影响顺序与极差分析结果一致,即果胶酶体积分数>提取温度>提取时间>料液比,但各因素对试验结果的影响均不显著(P>0.05),主要原因是误差偏差平方和(SS)与均方差(MS)都较小,从而使因素的效应达不到显著水平,可能与不同因素间存在的一些互作效应有关.
2.4南瓜多糖清除羟基自由基(·OH)的能力
由图7可以看出,在0.3 mg/mL以前,随着粗多糖质量浓度的升高羟基自由基(·OH)的清除率逐渐增大,而在粗多糖质量浓度大于0.3 mg/mL后,清除率呈现下降趋势,在0.3 mg/mL至0.4 mg/mL之间下降明显,而从0.4 mg/mL开始下降趋缓.南瓜多糖质量浓度为0.3 mg/mL时,最大清除率为23.30%.

图6 各因素与南瓜粗多糖得率的关系Fig.6 Relationship between the factors and the yeild of crude polysaccharide

图7 南瓜多糖浓度对羟基自由基(·OH)的清除率Fig.7 Pumpkin polysaccharide concentration onthe hydroxyl radical (·OH) clearance rate
自由基的清除是利用氧自由基的氧化或还原性,使反应体系中的某种反应物发生氧化或还原反应,生成物在紫外或(和)可见光范围内某一特定波长下具有最大吸收峰,通过测定反应体系在这一波长下的吸光度的变化,间接测定氧自由基的含量.多糖结构中的醇羟基可以与产生(·OH)等自由基所必需的金属离子(如Fe2+、Cu2+等)络合,使羟基自由基的产生受到抑制[11].孙婕等[13]在用不同方法提取的南瓜多糖进行清除羟自由基试验时得出,相同质量浓度下,复合酶法提取所得的南瓜多糖清除羟基自由基(·OH)的能力最强,在南瓜多糖浓度0.3 mg/mL时清除率为40%左右,在1.8 mg/mL时可达83.2%.南瓜多糖及其衍生物具有很好的抗氧化性能,对不同的自由基的清除能力不同.同样,不同成分的南瓜多糖对同一种自由基的清除能力也不相同.因此,清除某种自由基要找到对其具有最大清除能力的南瓜多糖成分[1].
3结论
1)本研究得出南瓜多糖提取最佳工艺条件为:提取温度30 ℃,果胶酶浓度2.0%,料液比1∶40,提取时间2.5 h.该工艺条件下南瓜多糖的得率为27.19%.
2)南瓜多糖对羟基自由基具有一定的清除能力,在南瓜多糖质量浓度为0.3 mg/mL时,最大清除率为23.30%.
参考文献
[1]孙婕,尹国友,张华,等.南瓜多糖提取分离纯化及其抗氧化活性的研究进展[J].河南城建学院学报,2010,19(5):43-46
[2]赵玉,徐雅琴,崔崇士.超声波协同复合酶法提取南瓜多糖最佳条件的研究[J].农产品加工·学刊,2009(7):13-15
[3]万国福.南瓜多糖提取方法比较[J].粮食与油脂,2009(7):45-47
[4]李俊丽,王运强,向长萍.南瓜水溶性多糖提取工艺的研究[J].食品工业科技,2007,28(7):140-142,246
[5]向东,赖凤英,陈冠.水溶性南瓜多糖的提取工艺的研究[J].广州食品工业科技,2004,20(2):48-50
[6]向东,赖凤英,梁平.碱法提取南瓜多糖的研究[J].食品工业科技,2004,25(11):120-122
[7]赵二劳,李满秀,梁兴红.超声提取南瓜多糖的研究[J].声学技术,2008,27(1):58-60
[8]孙俊,邓红,仇农学.南瓜多糖超声提取工艺的优化[J].西北农业学报,2007,16(2):198-202
[9]王洪伟,崔崇士,徐亚琴.南瓜多糖复合酶法提取及纯化的研究[J].食品科学,2007,28(8):247-249
[10]徐雅琴,崔崇士,王洪伟.南瓜多糖提取方法研究[J].食品工业,2006(5):45-47
[11]刘颖,梁盈,林亲录,等.南瓜多糖的提取及其抗氧化活性研究进展[J].食品与机械,2014,30(3):239-243
[12]于翠芳,李洁慧,张名爱,等.纤维素酶法提取南瓜多糖的工艺研究[J].食品工业,2012(3):50-52
[13]孙婕,申娟利,吕灵娟,等.3种提取方法对南瓜多糖得率及抗氧化性质的影响[J].农产品加工·学刊,2011(8):38-40
[14]Sun J,Yin G Y,Chen L Y.Extraction of pumpkin polysaccharide by complex enzyme and its antioxidant research[J].Agricultural Biotechnology,2010,11(5):34-37
[15]张珍,赵有益,韩玲,等.复合保健酸乳加工技术研究[J].甘肃农业大学学报,2007,42(3):106-109
[16]扶教龙,刘净,杨天逸,等.南瓜多糖提取工艺研究[J].食品工业,2011,12:38-42
(责任编辑胡文忠)
Extraction and antioxidant activity on pumpkin polysaccharide
CHANG Hai-jun1,WANG Xiao-yan2
(1.College of Environment and Resources,Chongqing Technology and Business University,Chongqing Engineering Research Center for Processing,Storage and Transportation of Characterized Agro-Products,Chongqing 400067,China;2.College of Food Science,Southwest University,Chongqing 400715,China)
Abstract:【Objective】 The aim of this study is to optimize the enzymatic extraction condition of pumpkin polysaccharide,and to detect the antioxidant properties of pumpkin polysaccharide.【Method】 The pectinase extraction of polysaccharide from pumpkin was investigated,and the extraction parameters were studied by single factor and orthogonal experiments.The scavenging effects of the polysaccharide on hydroxyl radical (·OH) were evaluated with salicylic acid assay.【Result】 The optimum extraction conditions were as follows: extraction temperature at 30 ℃,pectinase concentration 2.0%,solid-liquid ratio 1∶40 and extraction time for 2.5 h.The polysaccharide extraction rate reached to 27.19%.The highest clearance rate for hydroxyl radicals(·OH) reached to 23.30% when the polysaccharide at 0.3 mg/mL.【Conclusion】 This research provides a theoretical basis for the deep processing of the pumpkin,and laid the foundation for further study on pumpkin polysaccharide efficacy.
Key words:pumpkin polysaccharide;pectinase;extraction;antioxidant
基金项目:重庆市科委基础与前沿研究计划项目(cstc2013jcyjA80017);重庆市教委科学技术研究项目(KJ1500633).
收稿日期:2015-05-28;修回日期:2015-07-09
中图分类号:S 642.1
文献标志码:A
文章编号:1003-4315(2016)03-0135-05
第一作者:常海军(1980-),男,副教授,博士,研究方向为农畜产品加工理论与技术.E-mail:changhj909@163.com

