拟南芥低叶绿素荧光LCF3基因的克隆与功能分析
刘凌云 刘 浩 赵 晶 王艳霞 王棚涛
河南大学生命科学学院/棉花生物学国家重点实验室/植物逆境生物学重点实验室, 河南开封 475004
拟南芥低叶绿素荧光LCF3基因的克隆与功能分析
刘凌云 刘 浩 赵 晶 王艳霞 王棚涛*
河南大学生命科学学院/棉花生物学国家重点实验室/植物逆境生物学重点实验室, 河南开封 475004
摘 要:叶绿素荧光动力学技术在测定叶片光合作用中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用。本研究借助叶绿素荧光成像仪, 从拟南芥EMS诱变突变体库中筛选到一株低叶绿素荧光突变体lcf3-1 (lower chlorophyll fluorescence 3-1)。遗传分析表明lcf3-1突变体为单基因隐性突变。突变基因图位克隆结果显示LCF3是PsbW的等位基因。另外, LCF3基因的T-DNA插入突变体及功能回补转基因植物的叶绿素荧光分析结果均证明LCF3基因突变导致拟南芥叶绿素荧光Fv/Fm值降低。进一步实验结果显示, LCF3蛋白定位于叶绿体, 且LCF3基因在植株中普遍表达。PsbW蛋白可能细微调整PSII-LHCII超复合体的组装及稳定。
关键词:拟南芥; 叶绿素荧光; 光合作用; 图位克隆
本研究由国家自然科学基金项目(31170253)和河南省基础与前沿技术研究计划项目(142300413206)资助。
This study was supported by the National Natural Science Foundation of China (31170253) and the Basic and Advanced Technology Research Project in Henan Province (142300413206).
第一作者联系方式∶ E-mail∶ lingyunl@henu.edu.cn
URL∶ http∶//www.cnki.net/kcms/detail/11.1809.S.20160125.1622.010.html
光合作用是绿色植物最重要的生理活动之一,该作用分为光反应和暗反应2个阶段, 是植物和光合细菌将光能转化为化学能的重要过程。光反应中光的吸收是由仅能吸收利用长波光的系统 PSI (photosystem I)和只能吸收利用短波光的系统 PSII (photosystem II)完成[1-2]。其中PSII是由多个亚单位组成的色素-蛋白复合体, 该复合体参与植物光合系统中光解放氧过程[3]。蓝藻PSII复合体主要由分子量<10 kD的低分子量蛋白组成, 高等植物PSII复合体则含有蓝藻中不具备的3个低分子量蛋白PsbR、PsbTn和PsbW[4], 这3个蛋白的细胞定位及功能特点还不完全清楚。
PsbW是一个6.1 kD的PSII低分子量蛋白亚基,最初发现是菠菜PSII的组成成分[5-6], 该蛋白仅参与PSII但不涉及PSI蛋白复合体的组成[7-8], 具有稳定PSII同源二聚体结合的潜在作用[9]。然而, 近年发现PsbW与Lhcb蛋白一起参与PSII后续组装步骤[10-13],并且PsbW缺失导致有序排列的PSII-LHCII (lightharvesting complex II)超复合体的大结构域不能形成,从而使PSII亚单位之间能量传递效率降低, 同时PSII对光胁迫响应的调节变慢[14]。
植物吸收太阳光主要用于光合作用、热耗散和叶绿素荧光。叶绿素荧光发射除了受到激发能的传递、天线色素和反应中心色素性质和定位的影响外,还受PSII反应中心供体侧和受体侧氧化还原状态的影响[15-17]。叶绿素各荧光参数的变化间接反映叶绿体及其内部叶绿素状态。因此, 叶绿素荧光成为光合作用研究中极重要的富含信息的高效指示剂。
叶绿素荧光动力学技术是一种以光合作用理论为基础, 利用体内叶绿素作为天然探针, 研究和探测植物光合生理状况及各种外界因子对其影响的新型植物活体测定和诊断技术。本研究运用此技术,筛选出叶绿素荧光参数Fv/Fm值较野生型低的突变体lcf3-1, 并对其进行分子克隆及基因定位研究。转基因回补实验证实该基因是PsbW的等位基因。LCF3定位于叶绿体, 并在植物中普遍表达。对LCF3的研究使叶绿素荧光技术筛选突变体的理论和方法得到不断的完善, 并且为光合作用机制的深入研究提供理论依据。
1 材料与方法
1.1 植物材料
将野生型拟南芥(Arabidopsis thaliana L.)的生态型Columbia (Col)用于表型筛选, 生态型Landsberg erecta (Ler)用于图位克隆。拟南芥突变体lcf3-1是EMS (甲基磺酸乙酯)诱变Col野生型得到的低叶绿素荧光突变体。
1.2 材料种植
拟南芥种子用0.01%升汞悬浮浸泡5 min, 无菌水漂洗5次后, 播种于含0.6%琼脂的MS培养基上。4℃春化2~4 d后放入培养间, 待种子萌发, 生长10 d左右移至土中继续生长。生长条件为22℃ (昼)/18℃ (夜), 光周期为16 h (光)/8 h (暗), 光强为120~130 μmol m-2s-1。
1.3 突变体的遗传分析
以突变体lcf3-1为母本、野生型Ler为父本, 杂交得到F1代, F1自交获得F2代。观察F2代表型, 并统计植株表型的分离比。
1.4 转基因材料的获得
以野生型Col基因组DNA为模板, 以LCF31F∶5'-GGGGGATCCTCTCAGAATGCAGAATATCAGA-3'和LCF31R∶ 5'-CCCAAGCTTCCATGTTAACTATAT GTGTATTC-3'为引物扩增LCF3基因构建回补载体LCF3∶pCAMBIA1300-COM; 以LCF32F∶ 5'-GGGAA GCTTCAGATATAGTTCACAGCAACAT-3'和LCF32R∶5'-CCCGGATCCGCGGAGGCAGTAAAGCTAGCC-3'为引物构建pLCF3∶pCAMBIA1391-GUS载体; 以野生型Col的cDNA为模板, 分别以LCF33F∶ 5'-GGGG GTACCATGGCTAGCTTTACTGCCTCCG-3'和LCF3 3R∶ 5'-GGGGGATCCGAGTGAAAGACCAGATTCT TC-3'及LCF34F∶ 5'-GGGAAGCTTATGGCTAGCTTT ACTGCCTCCG-3'和LCF34R∶ 5'-GGGGGTACCGA GTGAAAGACCAGATTCTTC-3'为引物构建带GFP标签的永久表达载体LCF3∶super1300+-GFP和瞬时表达载体LCF3∶∶pHBT-GFP。将以上获得的重组载体分别以农杆菌介导[18]或者PEG介导[19]的方法转入突变体lcf3-1或野生型拟南芥Col, 以及野生型Col叶肉细胞原生质体。对其中永久表达植株通过潮霉素筛选获得阳性转基因材料进行功能分析, 叶肉细胞原生质体瞬时表达LCF3∶GFP在激光共聚焦显微镜下观察荧光, 进行LCF3蛋白亚细胞定位分析。
1.5 叶绿素荧光的测定
参照 Wang等[20]方法进行 β-葡糖苷酸酶(GUS)的组织化学染色和共聚焦显微镜观察 GFP荧光定位。利用叶绿素荧光成像仪(CF Imager, Technologica公司)于25℃下测定叶绿素荧光猝灭过程。叶片暗适应30 min后, 测定Fv/Fm值。Fv/Fm比值反映光合系统II光化学反应的最大光合效率。该参数被广泛应用于光合系统受胁迫程度的检测, Fv/Fm值降低暗示光合系统II受损伤。
2 结果与分析
2.1 叶绿素荧光突变体lcf3-1的表型分析
突变体 lcf3-1在植株形态和叶片颜色及开花时间上与野生型均无明显差异。在培养皿中培养lcf3-1 10 d后, 利用叶绿素荧光成像仪检测其叶绿素荧光表型, 发现突变体Fv/Fm值低于Col及Ler野生型(图1-B)。将突变体lcf3-1移栽土中培养25 d后, 其Fv/Fm值仍低于野生型(图1-D), 数据统计分析显示两者之间存在显著相差(P < 0.05)。经暗处理3 d后, 二者在叶绿素含量上无明显区别(图2-A), 但二者Fv/Fm值相差0.20左右, 较暗处理前差异明显增大(图2-B)。

图1 叶绿素荧光突变体的筛选Fig.1 Mutants screening by chlorophyll fluorescence imaging
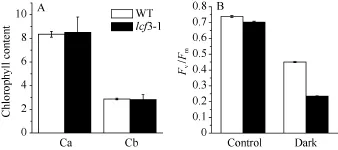
图2 lcf3-1突变体叶绿素含量及Fv/Fm值Fig.2 Chlorophyll content and chlorophyll fluorescence Fv/Fmin WT and lcf3-1 mutant
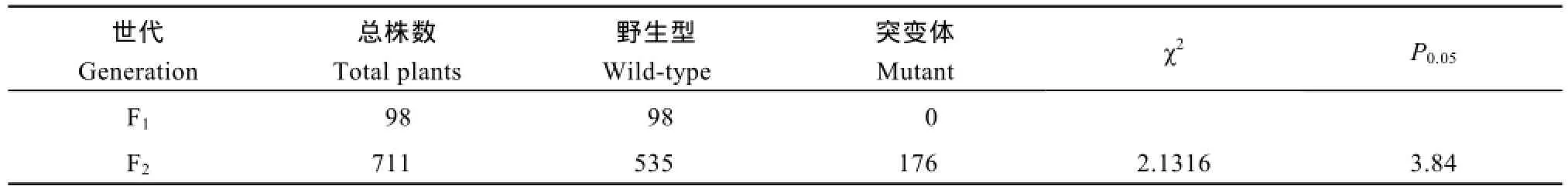
表1 突变体遗传分析Table 1 Genetic analysis of lcf3-1 mutant
2.2 突变体lcf3-1的遗传分析
将突变体与Col野生型回交, 回交F1代所有植株均表现野生型表型, F1代自交得到F2代, F2代种下后经暗处理, 叶绿素荧光成像检测Fv/Fm, 发现F2代表型出现分离, 分离比例接近 3∶1 (表 1), 这表明lcf3-1为单基因隐性突变, 可以通过图位克隆的方法找到该突变位点。
2.3 LCF3基因的图位克隆
将lcf3-1突变体和Ler野生型杂交得到F1代, F1自交得到F2代, 挑选F2代中具有lcf3-1突变体表型的88株植株分别提取DNA, 利用TAIR网站上的引物(marker)信息粗定位。经过 PCR及凝胶电泳检测发现lcf3-1突变位点与第 2染色体中下游NGA168 BAC明显连锁, 重组率约为10.94%。由此推断, 该突变基因位于第 2染色体下端附近。在此基础上扩大遗传群体, 用616个F2代lcf3-1低叶绿素荧光表型植株的DNA在NGA168 BAC的两端分别设计引物进一步细定位, 发现突变位点可能位于 T6B20 BAC上, 重组率为1.62% (图3-A)。通过进一步精细定位和测序确定突变基因为 At2G30570, 该基因只含有一个内含子, lcf3-1突变体中At2G30570内含子的3´端剪接边界区发生突变, 由鸟嘌呤(G)转换为腺嘌呤(A)(图3-B), 从而使lcf3-1突变体中LCF3基因的 mRNA出现不同大小的剪接版本(图 4), 表明lcf3-1突变体中LCF3正常的剪接过程出现了错误。
2.4 LCF3影响叶绿素荧光表型的功能验证
从SALK中心获得了PsbW (At2G30570)基因的T-DNA插入突变体 SAIL_885_A03, 命名为 lcf3-2,并通过半定量RT-PCR检测其At2G30570未表达(图5)。在lcf3-1突变体背景下构建了PsbW自身启动子驱动的 PsbW回补转基因植株, 暗处理后, 突变体lcf3-1和lcf3-2均显示出明显低于野生型的低叶绿素荧光表型(图6-A), 而lcf3-1突变体背景的回补转基因植株则表现出和野生型相似的表型(图6-B)。这一结果进一步证实 lcf3-1突变体的低叶绿素荧光表型是由LCF3/PsbW (At2G30570)基因突变所致。
2.5 LCF3蛋白亚细胞定位分析
LCF3基因突变导致拟南芥低叶绿素荧光表型,推断 LCF3蛋白可能是在叶绿体中发挥作用。pHBT-GFP空载体转化拟南芥叶肉细胞原生质体时,GFP荧光几乎充满整个细胞质部分(图7-A)。融合蛋白LCF3∶∶GFP的绿色荧光则特异地出现在细胞内叶绿体中(图7-B)。另外LCF3∶super1300+-GFP永久转基因植株也显示气孔保卫细胞中LCF3∶GFP融合蛋白绿色荧光与叶绿体红色自发荧光完全重合(图7-C)。以上结果说明LCF3蛋白定位于叶绿体中。

图3 LCF3基因的克隆Fig.3 Map-based cloning of LCF3 gene

图4 lcf3-1突变体基因突变位点分析Fig.4 Analysis of mutation site of lcf3-1 mutant

图5 野生型及lcf3-2突变体中LCF3基因表达情况Fig.5 Expression analysis of LCF3 in WT and T-DNA insertion line lcf3-2 by RT-PCR
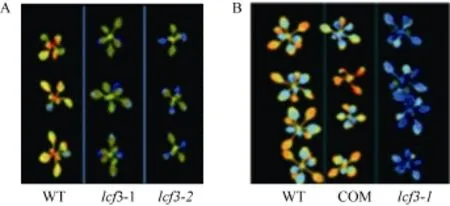
图6 LCF3基因突变导致低叶绿素荧光表型的验证Fig.6 Verification of the function of LCF3 gene on chlorophyll fluorescence
2.6 LCF3基因组织表达分析
利用分离得到的 LCF3基因启动子与报告基因GUS融合的转基因植株, 检测 LCF3在拟南芥不同组织中的表达模式。组织化学染色表明, 14 d龄植株叶片与根成熟区有强烈的GUS表达, 而根尖分生组织没有GUS表达。植物抽薹后对花进行GUS活性染色, 发现花萼、花药以及柱头中均有GUS表达(图8)。这一结果暗示LCF3可能在植物发育的不同时期均有作用。
3 讨论
本文根据叶绿素荧光动力学原理, 用叶绿素荧光成像仪筛选出荧光参数 Fv/Fm值比野生型低的拟南芥突变体 lcf3-1, 并发现其低叶绿素荧光表型可以稳定遗传。对lcf3-1突变体的遗传分析表明, lcf3-1是单基因隐性突变体。突变基因经图位克隆最终将突变位点限定在拟南芥第2染色体中下部的T6B20 和F7F1 BAC之间, 对这2个BAC间所有基因的生物信息学分析, 找到 3个可能与光合作用有关的基因, 并进行基因测序, 最终认定lcf3-1突变体中突变基因LCF3为At2G30570。在lcf3-1突变体中, 该基因内含子3'边界一个碱基发生突变, 由鸟嘌呤(G)转换为腺嘌呤(A)。该突变导致LCF3基因的转录本在剪切成熟过程中发生错误, 部分转录本的内含子无法被剪切, 导致所编码的蛋白功能异常。我们所克隆的LCF3突变基因与已经报道的PsbW基因是等位基因。LCF3基因突变导致拟南芥叶绿素荧光Fv/Fm值低于野生型。LCF3的 T-DNA插入缺失突变体lcf3-2也表现出类似于lcf3-1的低叶绿素荧光表型。结合我们获得的表型回补转基因植株能够恢复拟南芥 lcf3-1突变体低叶绿素荧光表型, 证明该突变体出现的低叶绿素荧光表型确实是由PsbW (At2G30570)基因突变所致。

图7 LCF3蛋白亚细胞定位Fig.7 Subcellular localization of LCF3
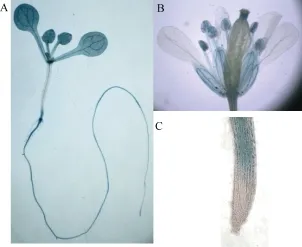
图8 LCF3基因的组织表达分析Fig.8 Organ-specific expression of LCF3 in Arabidopsis
PsbW基因编码一个分子量为6.1 kD的小分子蛋白, 存在于真核光合细胞中, 是光系统 II蛋白复合体的一个成分。已有文献报道PsbW基因T-DNA插入敲除突变体与反义抑制突变体均导致光系统 II超分子复合体不稳定[14]。只有光系统 II (PSII)与集光复合体(LHCII)未结合形成超分子复合体时, 能够检测或分离出游离的PsbW蛋白。PsbW蛋白缺失表现出叶绿素荧光参数 Fv/Fm减少, 光系统 II核心蛋白磷酸化作用显著降低, 以及暗适应叶片中质体醌池氧化还原状态的明显改变。此外, PsbW蛋白缺失还导致质体醌池中氧化还原反应加快。PsbW缺失突变体和反义抑制突变体能够光自养正常生长, 说明PsbW蛋白对光合细胞来说不是必不可少的亚基。虽然PsbW缺失突变体植株PSII-LHCII超复合体结构改变, 但突变体细胞中叶绿体结构与野生型类似。因此PSII-LHCII超分子复合体的稳定性对植物叶绿体类囊体膜上基粒的形成可能不是必需条件[21]。PsbW 蛋白亚基在高等植物叶绿体中的进化源于陆生植物, 其与叶绿体膜上的捕光天线色素蛋白一起参与光合作用。PsbW蛋白可能细微调整PSII-LHCII超复合体的组装及稳定, 因此能在叶绿体基粒膜上形成PSII-LHCII超复合体的有序排列, 优化陆生植物的光合作用, 有效地应对植物生存环境条件的改变。
叶绿素荧光动力学技术作为光合作用研究手段,在植物光合作用突变体筛选中起到了重要作用[22-24],本文的实验结果也印证了这一点。同时这一技术也随着人们对光合作用认识的不断深入而改进。
4 结论
利用图位克隆技术成功克隆到 LCF3基因。该基因突变导致拟南芥叶绿素荧光降低。lcf3-1突变体的叶绿素荧光表型为 At2G30570基因突变所致。LCF3基因在植物中普遍性表达。LCF3定位于叶绿体, 与其参与光合作用调节的功能相吻合。
References
[1]Qin X, Suga M, Kuang T, Shen J R.Photosynthesis Structural basis for energy transfer pathways in the plant PSI-LHCI supercomplex.Science, 2015, 348∶ 989-995
[2]Waters M T, Wang P, Korkaric M.GLK transcription factors coordinate expression of the photosynthetic apparatus in Arabidopsis.Plant Cell, 2009, 21∶ 1109-1128
[3]Barber J.Photosystem II∶ an enzyme of global significance.Biochem Soc Trans, 2006, 34∶ 619-631
[4]Shi L X, Schröder W P.The low molecular mass subunits of the photosynthetic supracomplex, photosystem II.Biochim Biophys Acta, 2004, 1608∶ 75-96
[5]Irrgang K D, Shi L X, Funk C, Schröder W P.A nuclear-encoded subunit of the photosystem II reaction center.J Biol Chem, 1995,270∶ 17588-17593
[6]Lorković Z J, Schröder W P, Pakrasi H B, Irrgang K D, Herrmann R G, Oelmuller R.Molecular characterization of PsbW, a nuclearencoded component of the photosystem-II reaction-center complex in spinach.Proc Natl Acad Sci USA, 1995, 92∶8930-8934
[7]Shi L X, Schröder W P.Compositional and topological studies of the PsbW protein in spinach thylakoid membrane.Photosynth Res, 1997, 53∶ 45-53
[8]Bishop C L, Purton S, Nugent J H.Molecular analysis of the Chlamydomonas nuclear gene encoding PsbW and demonstration that PsbW is a subunit of photosystem II, but not photosystem I.Plant Mol Biol, 2003, 52∶ 285-289
[9]Shi L X, Lorkovic Z J, Oelmuller R, Schröder W P.The low molecular mass PsbW protein is involved in the stabilization of the dimeric photosystem II complex in Arabidopsis thaliana.J Biol Chem, 2000, 275∶ 37945-37950
[10]Rokka A, Suorsa M, Saleem A, Battchikova N, Aro E M.Synthesis and assembly of thylakoid protein complexes∶ multiple assembly steps of photosystem II.Biochem J, 2005, 388∶ 159-168
[11]Thidholm E, Lindstrom V, Tissier C, Robinson C, Schröder W P,Funk C.Novel approach reveals localisation and assembly pathway of the PsbS and PsbW proteins into the photosystem II dimer.FEBS Lett, 2002, 513∶ 217-222
[12]Granvogl B, Zoryan M, Ploscher M, Eichacker L A.Localization of 13 one-helix integral membrane proteins in photosystem II subcomplexes.Anal Biochem, 2008, 383∶ 279-288
[13]Dobáková M, Sobotka R, Tichý M, Komenda J.Psb28 protein is involved in the biogenesis of the photosystem II inner antenna CP47 (PsbB) in the cyanobacterium Synechocystis sp.PCC 6803.Plant Physiol, 2009, 149∶ 1076-1086
[14]García-Cerdán J G, Kovács L, Tóth T, Kereïche S, Aseeva E,Boekema E J, Mamedov F, Funk C, Schröder W P.The PsbW protein stabilizes the supramolecular organization of photosystem II in higher plants.Plant J, 2011, 65∶ 368-381
[15]Massoz S, Larosa V, Horrion B, Matagne R F, Remacle C, Cardol P.Isolation of Chlamydomonas reinhardtii mutants with altered mitochondrial respiration by chlorophyll fluorescence measurement.J Biotechnol, 2015, 215∶ 27-34
[16]Genty B, Briantais J M, Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence.Biochim Biophys Acta (BBA)-General Subjects, 1989, 990∶ 87-92
[17]van Kooten O, Snel J F.The use of chlorophyll fluorescence nomenclature in plant stress physiology.Photosynth Res, 1990, 25∶ 147-150
[18]Clough S J, Bent A F.Floral dip∶ a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana.Plant J, 1998, 16∶ 735-743
[19]Yoo S D, Cho Y H, Sheen J.Arabaidopsis mesophyll protoplasts∶A versatile cell system for transient gene expression analysis.Nat Prot, 2007, 2∶ 1565-1572
[20]Wang P T, Liu H, Hua H J, Wang L, Song C P.A vacuole localized β-glucosidase contributes to drought tolerance in Arabidopsis.Chin Sci Bull, 2011, 56∶ 3538-3546
[21]Sun Q, Emanuelsson O, van Wijk K J.Analysis of curated and predicted plastid subproteomes of Arabidopsis∶ subcellular compartmentalization leads to distinctive proteome properties.Plant Physiol, 2004, 135∶ 723-734
[22]Baker N R.Chlorophyll fluorescence∶ a probe of photosynthesis in vivo.Annu Rev Plant Biol, 2008, 59∶ 89-113
[23]Murchie E H, Lawson T.Chlorophyll fluorescence analysis∶ a guide to good practice and understanding some new applications.J Exp Bot, 2013, 64∶ 3983-3998
[24]Maxwell K, Johnson G N.Chlorophyll fluorescence∶ a practical guide.J Exp Bot, 2000, 51∶ 659-668
DOI:10.3724/SP.J.1006.2016.00690
*通讯作者(
Corresponding author)∶ 王棚涛, E-mail∶ wangpt126@126.com
收稿日期Received()∶ 2015-06-09; Accepted(接受日期)∶ 2016-01-11; Published online(网络出版日期)∶ 2016-01-25.
Map-based Cloning and Functional Analysis of Low Chlorophyll Fluorescence Gene LCF3 in Arabidopsis thaliana
LIU Ling-Yun, LIU Hao, ZHAO Jing, WANG Yan-Xia, and WANG Peng-Tao*
Henan Key Laboratory of Plant Stress Biology/State Key Laboratory of Cotton Biology/College of Life Sciences, Henan University, Kaifeng 475004, China
Abstract:Chlorophyll fluorescence has exclusive role for determining the kinetics of light energy absorption, transmission, dissipation and distribution in leaf photosynthesis.In this study, a mutant was screened by chlorophyll fluorescence equipment from EMS mutagenesis of wild-type Arabidopsis Col-0, which showed lower Fv/Fmthan wild-type and was named lcf3-1 (lower chlorophyll fluorescence 3-1).Genetic analysis of lcf3-1 mutant suggested that the mutation was controlled by single recessive gene.LCF3 gene, which encodes PsbW protein, was isolated by map-based cloning.The T-DNA insertion mutant lcf3-2 showed low chlorophyll fluorescence phenotype as lcf3-1, and this phenotype could be complemented by LCF3 gene of wild-type.These experiments implied that the phenotype of low-chlorophyll-fluorescence resulted from LCF3 gene mutation.Furthermore, our results indicated that LCF3 protein is located in chloroplast and LCF3 gene is expressed in various tissues.PsbW protein is important for the contact and stability between several PSII-LHCII supercomplexes.
Keywords:Arabidopsis thaliana; Chlorophyll fluorescence; Photosynthesis; Map-based cloning

