基于c-Met激酶的小分子抑制剂研究进展
李丽丽, 艾晓杰
(1.上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海 200240;2.上海美迪西生物医药股份有限公司,上海 201299)
基于c-Met激酶的小分子抑制剂研究进展
李丽丽1,2, 艾晓杰1*
(1.上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海 200240;2.上海美迪西生物医药股份有限公司,上海 201299)
摘要HGF/c-Met信号通路在肿瘤的发生、发展和转移中起着重要的调节作用,成为抗肿瘤药物研发的热门靶点。介绍了c-Met 信号通路的作用机制以及c-Met 抑制剂的研究进展,以期能够找到一类肿瘤抑制活性高、选择性好、副作用小的抑制剂,为癌症治疗提供新的途径。
关键词受体酪氨酸激酶;c-Met;小分子抑制剂;抗肿瘤
据世界卫生组织统计,2012年全球癌症新发生病例约为1 400万,预计未来20年将升至2 200万/a,估计死亡数由820万/a上升到1 300万/a。近年来,酪氨酸激酶家族在癌症研究中受到更多的关注,HGF/c-Met 信号通路在胚胎形成、创伤愈合以及组织再生中起重要作用,但在多种癌症中,c-Met 显示出异常的活性,并与基因突变、扩增和重组相伴发生。高表达的c-Met 还与肿瘤治疗的耐药性、愈后情况差以及癌细胞的转移密切相关。因此,c-Met 抑制剂研究已成为肿瘤治疗领域的热门靶点。笔者简要介绍了HGF/c-met信号通路的作用机制以及c-Met小分子抑制剂的研究进展,以期能够找到一类肿瘤抑制活性高、选择性好、副作用小的抑制剂,为癌症治疗提供新的途径。
1HGF/c-Met的结构特点
1.1蛋白激酶(Protein Kinases)蛋白激酶是体内调节细胞生长和分化、器官形成和形态功能发生、心血管生长、组织修复和再生等的一组酶。蛋白激酶通过催化蛋白质的磷酸化,进而调节细胞活性,来完成生理功能[1]。目前,由人类基因编码的蛋白激酶超过518种,它们大多与癌症密切相关[2]。
1.2受体型酪氨酸激酶(RTKs)蛋白激酶可分为受体型和非受体型。受体型酪氨酸激酶(RTKs)结构包含胞外部分、跨膜区域和胞内部分,而非受体型酪氨酸激酶只有胞内部分。c-Met、Ron和Sea,是受体酪氨酸激酶[2]。非受体酪氨酸激酶也有很多亚型,包括Src、Btk、Abl、Fak和Jak等[4]。其中,c-Met作为受体酪氨酸激酶不仅在恶性肿瘤中高表达,与肿瘤细胞的生长、侵袭、转移和凋亡相关,而且还与多种膜受体相互作用,影响信号通路,因此,c-Met激酶作为抗肿瘤药物的靶点研究备受关注。
1.3受体酪氨酸激酶c-Met的结构c-Met激酶是由50 ku的α链和145 ku的β链通过二硫键连接,组成异质二聚体,分为胞外域、跨膜螺旋结构区和胞内域(图1a)。胞外域包含3个不同的功能区:覆盖整个α链和部分β链的N-端sema区(氨基酸残基25~514),有4个二硫键的胱氨酸富集域(PSI)(氨基酸残基515~561)和4个免疫球蛋白区域(IPT,氨基酸残基562~922)。在螺旋结构的跨膜区域(氨基酸残基923~956)之后,胞内域(氨基酸残基957~1 390)也由3个调控区组成,包括有Tyr1003磷酸位点(下调激酶活性)的近膜结构域,有Tyr1234和Tyr1235磷酸化位点(活化激酶活性)的催化结构域,以及有Tyr1349和Tyr1356的C-末端多功能结合区域(向下游募集信号转导)[5]。
1.4肝细胞生长因子(HGF)肝细胞生长因子也被称作分散因子(SF),是唯一已知高亲和性的c-Met配体。前HGF(pro-HGF)在间质细胞源中合成,呈单链的非活性结构,在丝氨酸蛋白酶催化下,pro-HGF会转变成二硫键相连的α-β双链异质二聚体结构的HGF。活化的HGF会被抑制因子HAI1和HAI2抑制,从而处于平衡状态。HGF分子结构包含6个区域,分别是N-末端区(Hairpin loop),α链上的4个环状结构区(K1~K4),β链上的丝氨酸蛋白同化区(SPH)[6](图1b)。
2HGF/c-Met信号通路的作用机制
HGF在细胞外域与c-Met结合后,诱导c-Met发生二聚化,进而在催化结构域的Tyr1234和Tyr1235 2个位点发生磷酸化,刺激C-末端多功能结合区域的Tyr1349和Tyr1356自动磷酸化,从而募集多种细胞间质因子,如GAB1、GAB2、PLC和SRC,进一步吸引SHP2、PI3K、CRKL等对接分子,由此激活RAS/MAPK、PI3K/ALK、JAK/STAT等信号通路,从而调控细胞的生长、增殖、迁移、存活和凋亡[7](图2)。
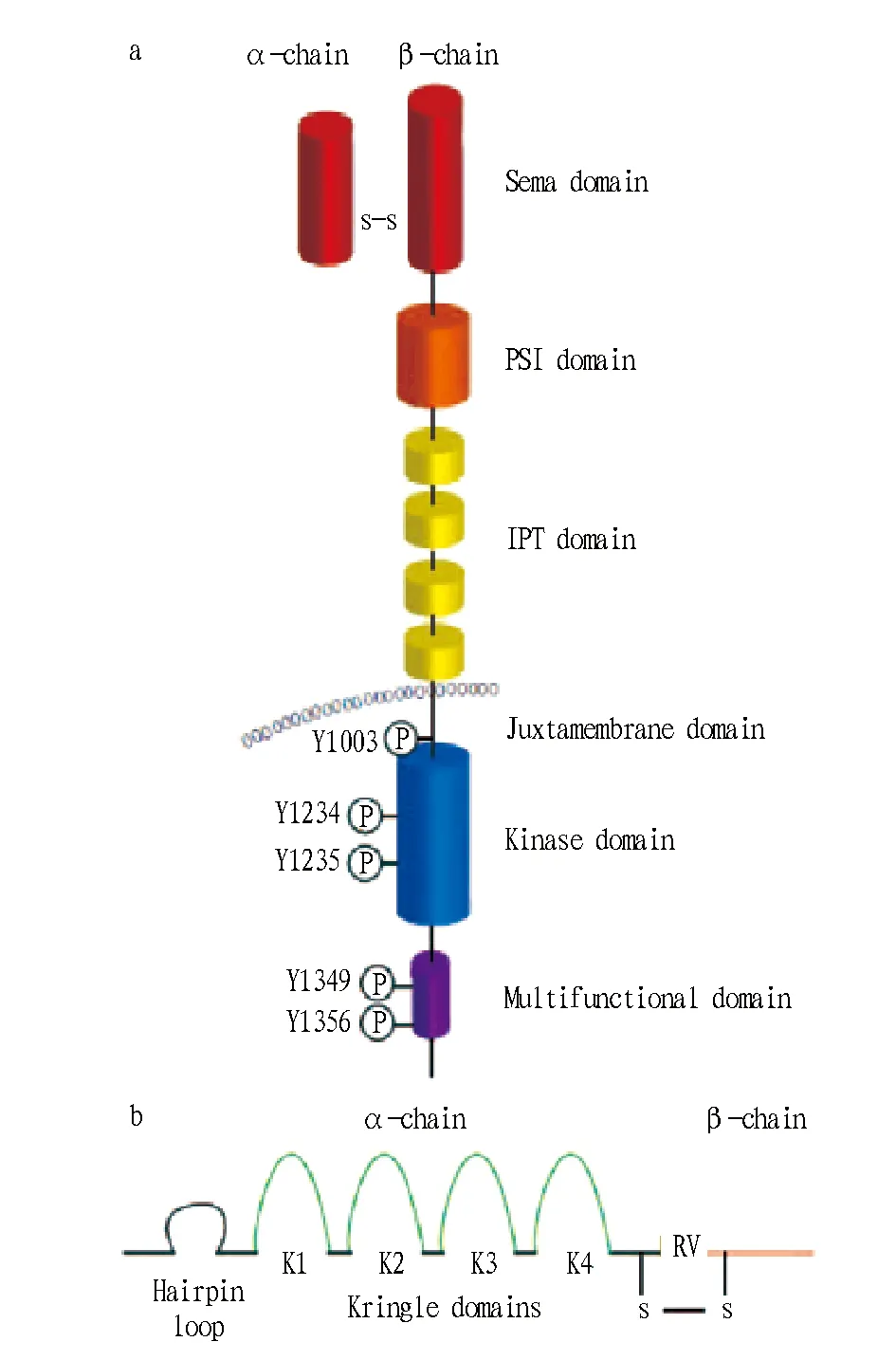
图1 受体酷氨酸激酶c-Met的结构(a)和肝细胞生长因子的结构(b)Fig.1 Structures of receptor tyrosine kinase c-Met (a) and hepatocyte growth factor (b)
在生理环境下,细胞表面的Met通过胞外脱落、胞内清除和泛素介导的降解等调节方式有效得到控制,发挥正常的生理功能,避免过度表达[8]。但在多种恶性肿瘤中均发现Met激酶的异常激活。Met的过度活化,不仅引起肿瘤的发生、发展和转移,还与抗肿瘤治疗的耐药性紧密相关,因此,对HGF/c-Met信号通路抑制剂的研究具有重要意义。
3小分子c-Met抑制剂的类型
基于HGF/c-Met信号通路的抑制剂,根据作用机制和结构不同,包括以下4类:HGF拮抗剂(NK2和NK4)、抗HGF抗体(Ficlatuzumab(AV-299),Rilotumumab(AMG102),TAK701(HuL2G7))、抗c-Met单克隆抗体(Onartuzumab (OA5D5) )和小分子c-Met抑制剂。根据化学结构和与激酶对接的作用位点不同,小分子c-Met抑制剂分为三大类。
3.1选择性c-Met抑制剂该类c-Met抑制剂在激酶口袋中与c-Met的结合呈U型构象,包围Met1121残基,结合在铰链区。由于该类抑制剂的结构与激酶构象吻合度高,对其他酪氨酸激酶靶点抑制作用较小,故其选择性较好。
选择性抑制剂中,克唑替尼(Crizotinib,PF02341066)是目前唯一已上市的针对c-Met和ALK的靶点药物,由Pfizer公司研发,IC50分别是11和24 nmol/L。体外试验表明,克唑替尼能有效地抑制Met激酶的磷酸化,进而抑制Met依赖的肿瘤细胞的增殖、迁移和侵袭[9]。2013年11月20日,FDA批准了其用于淋巴瘤激酶阳性的晚期和转移的非小细胞肺癌的治疗。
Capmatinib(INCB28060)是由Novartis/Incyte公司研发的ATP竞争性c-Met抑制剂,IC50=0.13 nmol/L,对RONβ、EGFR和HER-3无活性,用于多种实体瘤的治疗,已完成Ⅱ期临床试验[10]。
Amgen 公司研发的化合物AMG-208对c-Met具有高度选择性,IC50为9 nmol/L,计算机模拟结果显示,三唑并哒嗪环与Met的Tyr1230相互作用,喹啉环以及连接臂中的氧原子与蛋白形成氢键作用。AMG-208处于Ⅰ期临床试验中[11]。

图2 HGF/c-Met信号通路的作用机制Fig.2 HGF/c-Met signaling pathway and action mechanism
在AMG-208结构的基础上,Amgen公司根据电子等排原理,进一步研发出化合物AMG-337。将连接臂中的氧原子换成氮原子,喹啉环替换成[1,5]二氮杂萘,使之形成分子内氢键,很好地解决了分子对CYP3A4酶的时间依赖性抑制问题。同时,将苯环替换成噻唑环,改善了整个分子的成药性。该化合物目前处于临床Ⅱ期研究中,主要用于治疗胃癌和食道癌[12]。
另外,化合物PF-04217903和PF-04254644均是由Pfizer公司研发的选择性c-Met激酶抑制剂,Ki分别是5.0 和10.3 nmol/L。体外对208种不同激酶进行筛选,2个化合物均表现出高度选择性,体内试验也证明,这2个化合物能有效地抑制肿瘤的生长,且口服的PK数据良好。但化合物PF-04254644是强烈的磷酸二酯酶抑制剂,大鼠试验结果表明,该化合物会导致心率加快,心输出量增加,收缩性指数降低和心肌变性。由此,其在Ⅰ期临床试验中被终止[13]。
类似的2种化合物,JNJ-38877605(IC50=4.0 nmol/L)和SGX-523[14](Ki=2.7 nmol/L)体外试验也表现出很好的激酶活性,但在Ⅰ期临床试验中,化合物JNJ-38877605药效较差,且在患者体内发现肌酐水平增加,化合物SGX-523出现肾脏毒性,因此,这2个化合物也终止了临床研究。
3.2非选择性c-Met抑制剂非选择性c-Met抑制剂可作用于多个靶点,选择性较差,但作用范围更广。从结构上看也更为舒展,基本呈长链状,分子量较大,疏水性强。
由Exelixis公司研发的Cabozantinib(XL184)是目前唯一上市的非选择性抑制剂,对c-Met、VEGFR-2、Ret、Kit、AXL等多种激酶有抑制作用,c-Met激酶的IC50为1.3 nmol/L,VEGFR-2的IC50为0.035 nmol/L。体内试验表明,该化合物能有效地抑制c-Met和VEGFR-2的磷酸化,从而达到治疗肿瘤转移和抗血管生成的目的。2012年11月29日, FDA批准Cabozantinib用于不可手术切除的恶性局部晚期或转移性甲状腺髓样癌的治疗[15]。
Exelixis公司还开发了针对多种激酶有抑制作用的Foretinib,c-Met激酶的IC50为0.4 nmol/L,VEGFR-2的IC50为0.86 nmol/L。和激酶的共晶模型显示,化合物与激酶结合紧密,占据了ATP口袋和疏水空腔,环丙基二酰胺侧链上的2个氧原子分别与Lys1110和Asp1222形成氢键[16]。目前,该化合物处于临床Ⅱ期试验中,主要针对乳腺癌和胃癌的治疗。
与以上结构类似,日本卫材公司研发的化合物Golvatinib(E7050),c-Met激酶的IC50为14 nmol/L,VEGFR-2的IC50为16 nmol/L[17],目前正处于Ⅰ期/Ⅱ期临床阶段。MethylGene公司研发的化合物MGCD-265,能有效地抑制c-Met、VEGFR-2和RON,IC50分别是1、3、2 nmol/L[18],目前处于Ⅰ期/Ⅱ期临床阶段。
在保留二酰胺结构的基础上,引入并环,Bristol-Myers-Squibb公司得到化合物BMS-777607(c-Met的IC50为3.9 nmol/L)[19],目前处于Ⅱ期临床阶段。Lilly公司研发的化合物LY-2801653对c-Met的Ki为2 nmol/L[20],处于Ⅱ期临床试验阶段。
3.3其他结构的c-Met抑制剂Tivantinib(ARQ-197)是由美国ArQule公司与日本第一三共制药联合研发,属于非ATP竞争的新型小分子c-Met激酶抑制剂,对c-Met具有高度选择性,而对Ron几乎无活性,对EGFR、InsR、PDGFRα和FGFR1/4无抑制作用。在MDA-MB-231和NCI-H411细胞系中,对HGF诱导的c-Met磷酸化有较强抑制作用,IC50为100~300 nmol/L。另外,Tivantinib对微管蛋白聚合有抑制作用,扰乱微管蛋白代谢,延长G2/M 期,增加细胞凋亡[21]。
Merck公司研发的全新结构的多靶点激酶抑制剂MK-2461,属于ATP竞争性抑制剂,对c-Met、RON、FLT1/3/4、FGFR1/2/3、VEGFR2和TRKA/B等激酶均具有抑制活性[22]。其中,对c-Met的IC50为2 nmol/L,目前已完成Ⅰ期临床试验,主要针对晚期实体瘤的治疗。
4结论
HGF/c-Met信号通路在肿瘤的生长、侵袭、转移和凋亡中起重要作用,随着研究的不断深入,人们对该信号通路致病机制的认识也愈加清晰,同时一批作用于该信号通路的化学药物和生物药物也正于研发之中,且已经有2个小分子c-Met 抑制剂成功上市并应用于临床,显示HGF/c-Met信号通路具有良好的开发价值和市场潜力。c-Met靶点也面临着一些问题,如c-Met基因突变和基因扩增的发生频率相对较低,c-Met抑制剂只能对部分患者产生应答,肿瘤治疗中的耐药性与c-Met活化之间的关系,c-Met抑制剂和其他激酶抑制剂联合用药的问题,c-Met抑制剂联合化疗和放疗用药的问题。随着HGF/c-Met信号通路的不断研究,一定能够找到一类肿瘤抑制活性高、选择性好、副作用小的抑制剂,以期为癌症治疗提供新的途径。
参考文献
[1] BLUME-JENSEN P,HUNTER T.Oncogenic kinase signaling[J].Nature,2001,411(6835):355-365.
[2] MANNING G,WHYTE D B,MARTINEZ R,et al.The protein kinase complement of the human genome[J].Science,2002,298(5600):1912-1934.
[3] LEMMON M A,SCHLESSINGER J.Cell signaling by receptor tyrosine kinases[J].Cell,2010,141(7):1117-1134.
[4] BOLEN J B.Nonreceptor tyrosine protein kinases[J].Oncogene,1993,8(8):2025-2031.
[5] GHERARDI E,YOULES M E,MIGUEL R N,et al.Functional map and domain structure of MET,the product of the MET proto-oncogene and receptor for hepatocyte growth factor/scatter factor[J].Proc Nati Acad Sci USA,2003,100(21):12039-12044.
[6] BASILICO C,ARNESANO A,GALLUZZO M,et al.A high affinity hepatocyte growth factor-binding site in the immunoglobulin-like region of MET[J].J Biol Chem,2008,283(30):21267-21277.
[7] EDER J P,VANDE WOUDE G F,BOERNER S A,et al.Novel therapeutic inhibitors of the c-Met signaling pathway in cancer[J].Clin Cancer Res,2009,15(7):2207-2214.
[8] MOSESSON Y,MILLS G B,YARDEN Y.Derailed endocytosis:An emerging feature of cancer[J].Nat Rev Cancer,2008,8(11):835-850.
[9] CUI J J,TRAN-DUBEÉ M,SHEN H,et al.Structure based drug design of crizotinib (PF-02341066),a potent and selective dual inhibitor ofmesenchymal-epithelial transition factor (MET) kinase and anaplastic lymphoma kinase (ALK)[J].J Med Chem,2011,54(18):6342-6363.
[10] LIU X,WANG Q,YANG G,et al.A novel kinase inhibitor,INCB28060,blocks MET-dependent signaling,neoplastic activities,and cross-talk with EGFR and HER-3[J].Clin Cancer Res,2011,17(22):7127-7138.
[11] ALBRECHT B K,HARMANGE J C,BAUER D,et al.Discovery and optimization of triazolo- pyridazines as potent and selective inhibitors of the MET kinase[J].J Med Chem,2008,51(10):2879-2882.
[12] BOEZIO A A,BERRY L,ALBRECHT B K,et al.Discovery and optimization of potent and selective triazolopyridazine series of MET inhibitors[J].Bioorg Med Chem Lett,2009,19(22):6307-6312.
[13] CUI J J,SHEN,H,TRAN-DUBEÉ M,et al.Lessons from (S)-6-(1-(6-(1-methyl-1H pyrazol-4-yl)-[1,2,4]triazolo[4,3-b]pyridazin-3-yl)ethyl)quinoline (PF-04254644),an inhibitor of receptor tyrosine kinase c-Met with high protein kinase selectivity but broad phosphodiesterase family inhibition leading to myocardial degeneration in rats[J].J Med Chem,2013,56(17):6651-6665.
[14] BUCHANAN S G,HENDLE J,LEE P S,et al.SGX523 is an exquisitely selective,ATP competitive inhibitor of the MET receptor tyrosine kinase with antitumor activity in vivo[J].Mol Cancer Ther,2009,8(12):3181-3190.
[15] FUJIWARA Y,MIWA A,NAKAMURA K,et al.Quinoline derivative and quinazoline derivative inhibiting self-phosphorylation of hepatocytus proliferator receptor,and medicinal composition containing the same:US,8324245B2[P].2012-12-04.
[16] QIAN F,ENGST S,YAMAGUCHI K,et al.Inhibition of tumor cell growth,invasion,and metastasis by EXEL-2880 (XL880,GSK1363089),a novel inhibitor of HGF and VEGF receptor tyrosine kinases[J].Cancer Res,2009,69(20):8009-8016.
[17] NAKAGAWA T,TOHYAMA O,YAMAGUCHI A,et al.E7050:A dual MET and VEGFR-2 tyrosine kinase inhibitor promotes tumor regression and prolongs survival in mouse xenograft models[J].Cancer Sci,2010,101(1):210-215.
[18] BONFILS C,BEAULIEU N,FOURNEL M,et al.The combination of MGCD265,a MET/VEGFR inhibitor in clinical development,and erlotinib potently inhibits tumor growth by altering multiple pathways including glycolysis[J].Cancer Res,2012,72:1790.
[19] SCHROEDER G M,AN Y,CAI Z W,et al.Discovery of N-(4-(2-amino-3-chloro-pyridine- 4-yloxy)-3-fluorophenyl)-4-ethoxy-1-(4-fluorophenyl)-2-oxo-1,2-dihydro-pyridine-3-carboxamide(BMS-777607),a selective and orally efficacious inhibitor of the MET kinase superfamily[J].J Med Chem,2009,52(5):1251-1254.
[20] YAN S B,VICTORIA L P,ROSE A,et al.LY2801653 is an orally bioavailable Multi-kinase inhibitor with potent activity against MET,MST1R,and other oncoproteins,and displays anti-tumor activities in mouse xenograft models[J].Invest New Drugs,2013,31(4):833-844.
[21] BASILICO C,PENNACCHIETTI S,VIGNA E,et al.Tivantinib(ARQ197) displays cytotoxic activity that is independent of its ability to bind MET[J].Clin Cancer Res,2013,19(15):2381-2392.
[22] PAN B S,CHAN G K,CHENARD M,et al.MK-2461,a novel multitargeted kinase inhibitor,preferentially inhibits the activated MET receptor[J].Cancer Res,2010,70(4):1524-1533.
作者简介李丽丽(1985- ),女,广东云浮人,助理实验师,从事抗肿瘤药效研究。*通讯作者,副教授,从事实验动物模型研究。
收稿日期2016-03-21
中图分类号R 979.1
文献标识码A
文章编号0517-6611(2016)13-153-04
Research Progress of Small Molecule Inhibitor Based on c-Met Kinase
LI Lili1,2, AI Xiao-jie1*
(1.College of Agriculture and Biology Science, Shanghai Jiao Tong University/Shanghai Key Laboratory of Veterinary Biotechnology, Shanghai 200240:2.Shanghai Medicilon Bio-pharmaceutical Co., Ltd., Shanghai 201299)
AbstractThe HGF/c-Met signaling pathway plays important regulating roles in tumorigenesis, tumor development and transfer, which has become the popular target for the research on antitumor drug.We reviewed the research progress of the action mechanism of c-Met signaling pathway and the c-Met inhibitor, aiming at finding an inhibitor with high activity, good selectivity and small side effect, and offering new approach for cancer therapy.
Key wordsReceptor tyrosine kinases (RTKs):c-Met:Small molecule inhibitor:Anti-tumor

