响应面优化芦笋黄酮的酶法辅助提取工艺
李 琴,罗 飞,吴文湧,彭晓波,杨江科
(武汉轻工大学 生物与制药工程学院 湖北 武汉 430023)
响应面优化芦笋黄酮的酶法辅助提取工艺
李琴,罗飞,吴文湧,彭晓波,杨江科
(武汉轻工大学 生物与制药工程学院 湖北 武汉 430023)
摘要:采用响应面法对果胶酶酶解和乙醇抽提的方式分步从芦笋皮中提取黄酮类化合物的工艺参数进行了优化。通过SAS 9. 0软件分析,确定了最佳工艺参数:在液料比 42.2∶1,时间87 min, 温度75.9 ℃的情况下,对酶解后的芦笋废弃物中黄酮进行乙醇萃取,黄酮提取量约为7.28±0.21 mg/g,与预测值(7.37 mg/g)非常相近,拟合系数R2(96.67%)显示该回归模型可准确地预测果胶酶预处理之后的芦笋废弃物中黄酮的乙醇提取效率。
关键词:芦笋皮;响应面法;果胶酶;黄酮
1引言
黄酮类化合物是一类具有酚羟基的苯环通过中央三碳原子相互连结而成的一系列化合物,属植物次生代谢产物,具有消除氧自由基、抗氧化、抗肿瘤、抗病毒等许多药用功能。黄酮类化合物结构中常连接有酚羟基、甲氧基、甲基、异戊烯基等官能团,易溶于水、乙醇、甲醇等级性强的溶剂中,但难溶于或不溶于苯、氯仿等有机溶剂中[1-3]。
近几年,我国芦笋种植与加工产量巨大。在芦笋加工过程中,大约15%—25%的老茎和芦笋皮会被作为废弃物处理,而研究结果显示,这些芦笋废弃物中含有许多活性物质,其中黄酮类化合物含量非常高,主要存在于芦笋表皮[4-7]。目前,黄酮的主要提取工艺有醇提、水提等[8-14]。而因为植物组织中存在大量的多糖(果胶等),这些多糖在醇提或水提过程中会增大萃取体系中的传质阻力,给萃取过程带来阻力,降低萃取效率[15-19]。因此,在本实验中,利用果胶酶酶解[20-21]和醇提工艺相结合,采用响应面法优化芦笋皮中的黄酮类化合物的最佳提取工艺[22-29],为今后芦笋废弃物的加工再利用工业化和高附加值产业化提供技术基础。
2材料和方法
2.1材料
果胶酶购自Biotech;芦笋皮干粉,自制,将新鲜芦笋皮晒干用粉碎机粉碎过100目;无水乙醇、NaOH、NaNO2、Al(NO3)39H2O等试剂均为市售分析纯,购自国药集团。
2.2实验方法
2.2.1酶解反应
将芦笋皮、酶、水以一定的比例混合,装入50 mL具塞三角瓶中,混合均匀后置于恒温摇床中以一定温度和转速密闭振荡酶解。反应完成后,取出离心,吸取上层清液待测。
2.2.2芦丁标准曲线[30-31]
采用亚硝酸钠—硝酸铝比色法:配制50 mg/L的芦丁乙醇溶液,分别取0 mL,1.5 mL,3.0 mL,6.0 mL,9.0 mL,12.0 mL移入 25 mL比色管中,加入5 mL的30%乙醇溶液和0.3 mL的5%亚硝酸钠,混匀后放置5 min,加入0.3 mL的10% 硝酸铝,摇匀后放置 6 min,加入2 mL的4%氢氧化钠,用 30% 乙醇定容至25 mL摇匀,放置 10 min 后在 510 nm 处测出吸光度值,以芦丁浓度为横坐标,OD510为纵坐标模拟回归方程,制备标准曲线。
2.2.3黄酮化合物的提取及测定
将2.2.1中所得待测液与乙醇按一定的料液比定溶于锥形瓶中,用循环式多用真空泵进行抽滤得滤液,移取滤液按2.2.2处理,测定OD510。将OD510代入2.2.2所得标准曲线计算出样品中总黄酮含量[30]。
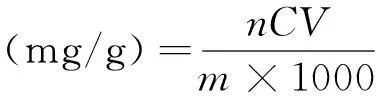
(1)
式中:C为从回归方程中求得的芦丁的浓度 (mg/L),n为提取液稀释的倍数,V为提取液的体积(mL),m为称取的芦笋皮的质量(g)。
2.2.4试验设计
运用软件SAS 9.0和Box-Behnken法设计响应面实验优化提取效率(表1),拟合出二次回归方程(2),同时检验方程的拟合度,获得最优的工艺条件,并进行试验验证。

(2)
式中:Y—黄酮含量(mg/g),β—各项式系数,X—因子(自变量)。
表1Box-Behnken实验设计
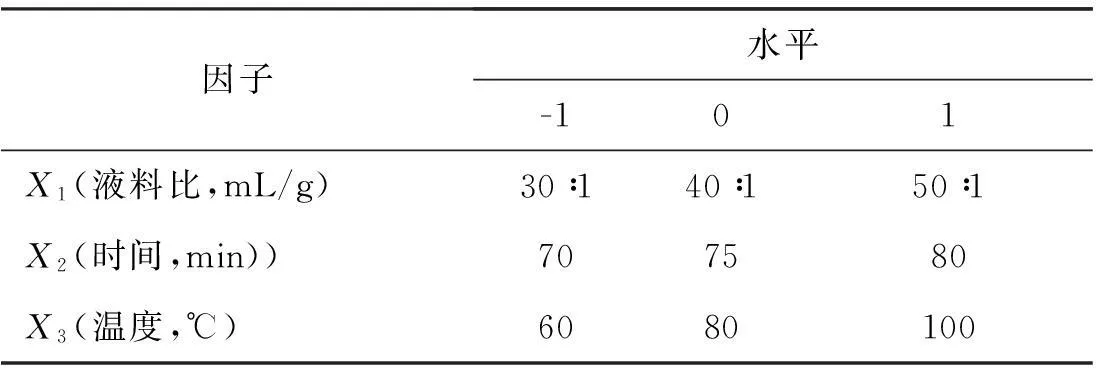
因子水平-101X1(液料比,mL/g)30∶140∶150∶1X2(时间,min))707580X3(温度,℃)6080100
3结果与讨论
3.1响应面优化
根据表1设计,利用响应面方法,对影响果胶酶预处理之后的芦笋废弃物中黄酮乙醇提取量的3个影响因子进行优化,结果见表2。
表2Box-Behnken试验结果
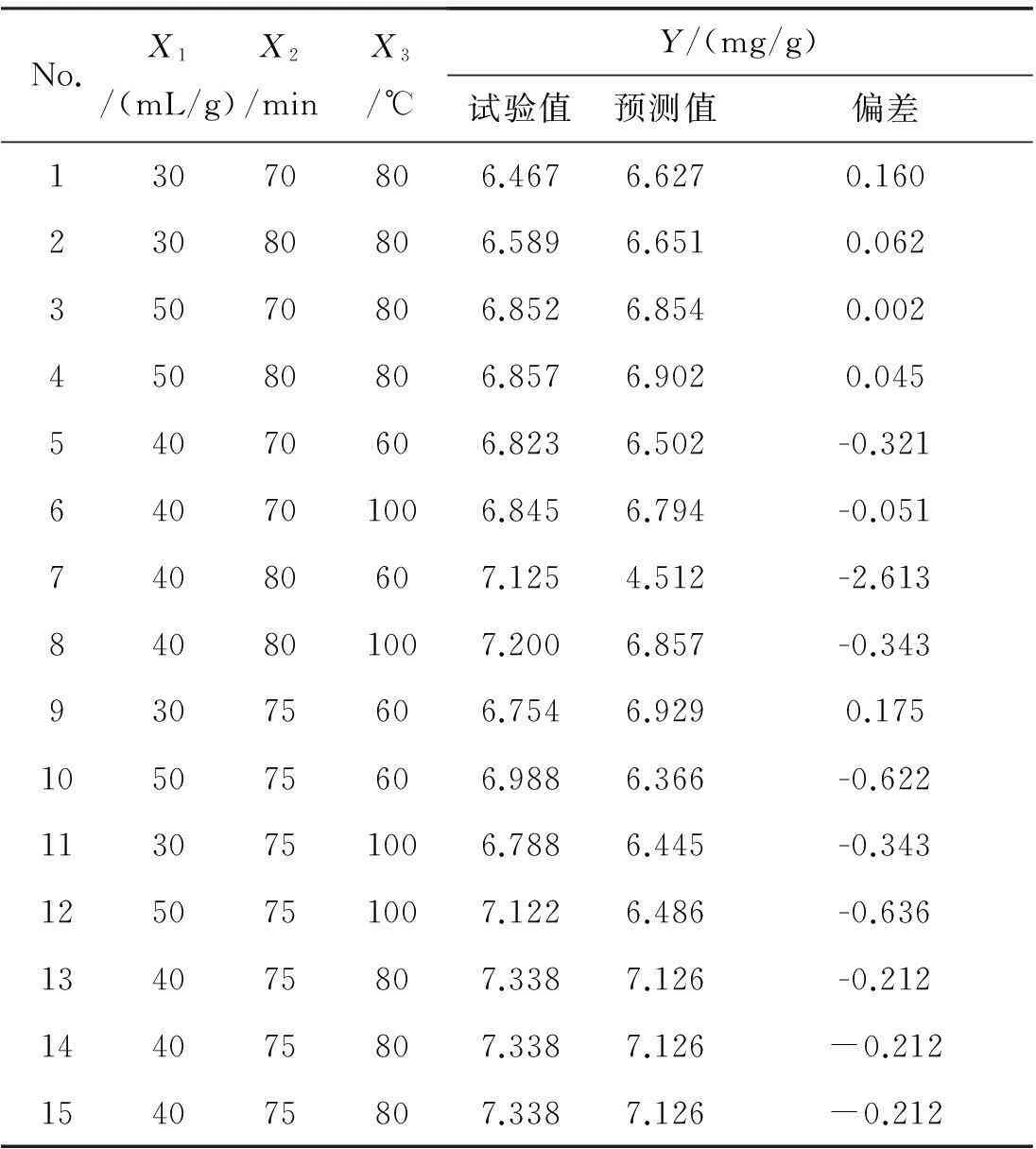
No.X1/(mL/g)X2/minX3/℃Y/(mg/g)试验值预测值偏差13070806.4676.6270.16023080806.5896.6510.06235070806.8526.8540.00245080806.8576.9020.04554070606.8236.502-0.321640701006.8456.794-0.05174080607.1254.512-2.613840801007.2006.857-0.34393075606.7546.9290.175105075606.9886.366-0.6221130751006.7886.445-0.3431250751007.1226.486-0.636134075807.3387.126-0.212144075807.3387.126-0.212154075807.3387.126-0.212
条件:芦笋废弃物1.0 g,酶量5%,酶解温度40 ℃,酶解时间50 min。
利用SAS 9.0软件对实验数据进行多项式回归分析,拟合得多项式回归方程模型(3):
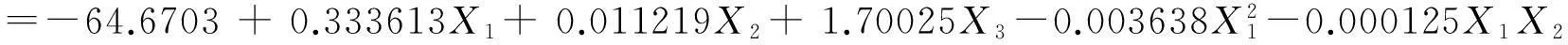

(3)
模型方程(3)的可靠性可通过方差分析来考察,从方差分析结果(表3)可知,在α=0.05的水平上,该模型回归高度显著。拟合系数R2为96.67%,表明该模型与实验结果拟合较好,96.67%的黄酮提取量可以由这个模型进行预测。因此可用上述模型预测果胶酶预处理之后的芦笋废弃物中黄酮的乙醇提取量。
表3回归模型的方差分析

方差来源自由度平方和均方差F值Pr>F回归91.009260.1121416.147160.00346(线性项)30.281070.0936913.490510.00784(二元项)30.722530.2408534.679650.00090(交互项)30.005650.001880.271300.84399残差50.034720.00695(失拟项)30.034720.011580.0001(纯误差)20总离差141.04398R2=0.9667
通过对Y的回归系数的检验(表4)可知,各因子对黄酮乙醇提取量影响的大小顺序为X1>X2>X3。通过回归数据典型分析(图1 A、B、C)可以看出3 个因子的特征值均为负,表明该模型稳定点为一马鞍形顶点,是极大值,可以直接从此二次响应面上确定最佳工艺参数:液料比 42.2∶1,时间87 min,温度75.9 ℃。在此条件下, 黄酮乙醇理论提取量为7.831 mg/g。
表4回归方程的回归系数分析

参数估值标准差tRatioP>|t|X10.15490.02955.25650.0033*X20.10030.02953.40250.0192X30.03310.02951.12430.3120X1X10.36380.0434-8.38730.0004*X1X20.02480.0417-0.59390.5784XIX30.02500.04170.59390.5747X2X20.27850.0434-6.42160.0014*X2X30.01330.04170.31790.7633X3X30.06130.0417-1.41230.2170
*:Significant at 1% level.
3.2响应面交互因子分析
图1显示随着液料比、时间和温度分别增加,黄酮提取量均有不同程度的增加,但是当各参数的值分别超过某一定值后,黄酮提取量则均显示不同程度的下降。
图1(A)表明温度不变时,液料比增至42.2∶1,黄酮提取量也随之增加,但当液料比大于42.2∶1时,黄酮提取量下降,可能是因为在一定范围内,当液料比缓慢增大时,对黄酮的析出与萃取体系的均相是有一定促进作用的,而随着醇量的不断增加并超过一定值后,黄酮析出速率下降,但由于醇量增加导致萃取体系扩大,从而降低了单位萃取体系中黄酮的量。同样,当酶量保持不变时,图1(B)显示在一定温度范围内(≤75.9 ℃),温度的上升有利于黄酮析出,温度超过75.9 ℃时,黄酮提取量随温度升高而降低,原因可能是过高的温度使醇逸出,降低实际参与萃取的乙醇量,进而影响了黄酮的提取量。图1(C)则显示液料比保持不变时,时间与温度对黄酮提取量的影响。当萃取时间少于87 min,黄酮提取量是缓慢增加的,而随着萃取时间的延长,萃取体系逐渐趋于平衡,甚至反萃,因而导致黄酮提取量在一定范围内呈现下降趋势。
3.3模型验证
通过回归模型分析,得到最优反应条件为:液料比 42.2∶1(X1=0.22),时间87 min(X2=0.33), 温度75.9 ℃(X3=0.17)。优化上述参数条件后(液料比 42∶1,时间87 min,温度76 ℃)进行乙醇萃取,3次验证实验得黄酮提取平均量为7.28±0.21 mg/g,与回归模型预测值7.37 mg/g十分接近。表明该模型能较好地预测果胶酶预处理之后的芦笋废弃物中黄酮的乙醇提取量。
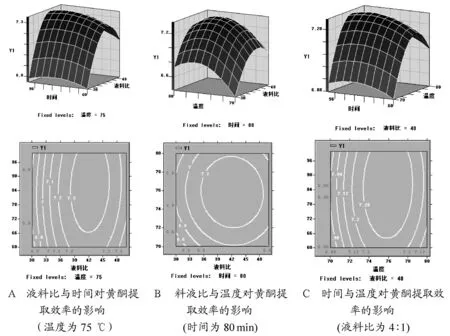
图1 黄酮乙醇提取效率的因素交互影响
4结论
笔者所做实验优化了果胶酶预处理之后的芦笋废弃物中黄酮的乙醇提取工艺参数,通过软件SAS 9.0对实验数据进行分析,获得回归模型。该模型的拟合系数R2为96.67%,说明该模型能够较好地反映果胶酶预处理之后采用乙醇萃取芦笋废弃物中黄酮的实际情况。同时优化了果胶酶预处理之后采用乙醇萃取芦笋废弃物中黄酮的最佳工艺条件为:液料比 42.2∶1,时间87 min,温度75.9 ℃。在该参数条件下对芦笋废弃物中黄酮进行乙醇萃取,黄酮提取量约为7.28±0.21 mg/g,与预测值非常相近,为今后芦笋废弃物的加工再利用工业化和高附加值产业化提供技术基础。
参考文献:
[1]Jian-Hua Xie, Cai-jun Dong, Shao-Ping Nie, et al. Extraction, chemical composition and antioxidant activity of flavonoids from Cyclocarya paliurus(Batal.) Iljinskaja leaves[J]. Food Chemistry,2015, 186(1): 97-105.
[2]蒋丹,陶凤云,李亚秋,等. 芦笋中黄酮类化合物的研究进展[J]. 食品工业科技, 2014, 35 (3):357-361.
[3]段雅庆,莫耽,刘冰,等. 芦笋中黄酮和多糖的提取工艺[J]. 食品科学, 2010, 31 (14):120-124.
[4]Fuentes-Alventosa J M, Jaramillo-Carmona S, Rodríguez-Gutiérrez G, et al.Preparation of bioactive extracts from asparagus by-product[J].Food and Bioproducts Processing, 2013,91(2): 74-82.
[5]Werner B Herppich, Susanne Huyskens-Keil, Karin Hassenberg, et al.Impact of ethanol treatment on physiological and microbiological properties of fresh white asparagus (Asparagus officinalis L.) spears[J]. LWT - Food Science and Technology, 2014, 57(1): 156-164.
[6]杨楠,贾晓斌,张振海,等.黄酮类化合物抗肿瘤活性及机制研究进展[J].中国中药杂志, 2015, 40(3):373-381.
[7]刘姗,孙蓉,唐自钟,等. 野生金龙胆草遗传多样性的RAPD分析及总黄酮成分在局群间的分布特征[J]. 生物技术通报, 2013(9): 84-88.
[8]赵子铭,付刚,李诚.响应面法微波辅助乙醇提取红景天苷工艺优化[J].食品科学, 2013, 34 (14):147-151.
[9]谢蓝华,肖南,张嘉怡,等. 复合酶解辅助乙醇提取茶多酚工艺研究[J].茶叶科学, 2013, 33 (1): 27-33.
[10]刘倩,齐计英,韩静,等. 响应面法优化回流提取紫薯花青素工艺[J].生物技术通报, 2014(12):1297-1304.
[11]沈海涛,王爱英,祝建波. 响应面分析法优化乙酸乙酯萃取番茄红素条件的研究[J].生物技术通报, 2014(1): 83-92.
[12]余响华,戴永强,邵金华.乙醇提取红豆杉树叶紫杉醇醇提条件的研究[J].生物技术通报,2013(10):98-102
[13]郭娇娇,宫智勇. 西芹中总黄酮的提取工艺及抑菌作用研究[J]. 武汉工业学院学报, 2011(3): 1-5.
[14]郭娇娇,罗佳,宫智勇. 桂花中总黄酮提取工艺及其抗氧化活性的研究[J]. 武汉工业学院学报, 2011(1):5-8.
[15]张占军,王富花,曾晓雄. 果胶酶在食品工业中应用的研究进展[J]. 中国酿造,2010(10):4-6。
[16]李祖明,张洪勋,白志辉,等. 微生物果胶酶研究进展[J].生物技术通报, 2010(3):42-49.
[17]崔春兰,郑虎哲,顾立众,等. 响应曲面分析法优化苹果渣中多酚类物质的果胶酶辅助提取工艺[J]. 现代食品科技, 2013, 29(9): 2235-2240.
[18]李丰硕,张灿,薛永常,等. 枯草芽孢杆菌FM208849产果胶酶的固定化及酶学性质研究[J].生物技术通报, 2012(6): 141-146.
[19]袁春龙,张金. 纤维素酶和果胶酶对番茄红素提取的影响[J].食品科学,2013, 31(13): 100-104.
[20]Sorel Tchewonpi Sagu, Emmanuel Jong Nso, Sankha Karmakar, et al. Optimisation of low temperature extraction of banana juice using commercial pectinase[J]. Food Chemistry, 2014, 151 (15): 182-190.
[21]Pooja Kohli, Reena Gupta. Alkaline pectinases: A review[J]. Biocatalysis and Agricultural Biotechnology, 2015, 4(3): 279-285.
[22]Xing-Yi Zhu, Yi-Li Mang, Jie Xie, et al. Response surface optimization of mechanochemical-assisted extraction of flavonoids and terpene trilactones from Ginkgo leaves[J]. Industrial Crops and Products, 2011,34(1):1041-1052.
[23]Ilaiyaraja N, Likhith K R, Sharath Babu G R, et al. Optimisation of extraction of bioactive compounds from Feronia limonia (wood apple) fruit using response surface methodology (RSM)[J]. Food Chemistry, 2015, 173(15): 348-354.
[24]杨正明,滕云,王景富,等. 藏药材牛尾蒿中总黄酮提取工艺优化及质量分数测定[J]. 西南大学学报(自然科学版), 2016, 38(2): 176-181.
[25]陈红梅,谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J].食品科学, 2016, 37(2):45-50.
[26]索南卓玛,包显云,包锦渊. 正交设计与响应面优化玄参黄酮提取工艺研究[J].分子科学学报. 2016, 32(1): 45-51.
[27]郭溆,田硕,王维婷,等. 响应曲面法优化黄秋葵花总黄酮的提取工艺[J].中国食品添加剂, 2016(2): 87-95.
[28]万阅,齐计英,曾红,等. 响应面法优化香菇多糖的超声辅助提取工艺[J].生物技术通报, 2015,31(1): 79-85.
[29]刘晓丹,张克勤,刘连,等. 乌腺金丝桃愈伤组织中总黄酮及金丝桃素含量测定[J].生物技术通报, 2015,31(1): 98-103.
[30]张琪,刘慧灵,朱瑞,等. 苦荞麦中总黄酮和芦丁的含量测定方法的研究[J]. 食品科学,2003,24(7):25-27.
[31]任雪琴,陈新,吴兵,等. 葛根黄酮的提取工艺及三波长—分光光度法测定其含量[J]. 武汉工业学院学报, 2011, 30(4): 32-36.
Response surface optimization of extraction technology of flavonoids from asparagus waste assisted with enzymatic method
LIQin,LUOFei,WUWen-yong,PENGXiao-bo,YANGJiang-ke
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University,Wuhan 430023, China)
Abstract:Experiments were carried to optimize the ethanol extraction parameters of flavonoids from asparagus peel which was hydrolyzed by pectinase using response surface methodology in the study. All the data were analyzed by SAS 9.0 software and the optimized conditions were obtained as follows: solid-liquid ratio 42.2:1, 87 min, 75.9 degrees.Under the optimum conditions, the quantity of flavonoids extractedwas up to 7.28 mg/g, which was close to the predicted value (7.37 mg/g). The model had a satisfactory coefficient ofR2(96.67%) and verified experimentally. The results showed that response surface methodology was a useful method to optimize the ethanol extraction parameters of flavonoids from asparagus peel which was hydrolyzed by pectinase .
Key words:asparagus peel; response surface methodology; pectinase; flavonoids
收稿日期:2015-04-20.
作者简介:李琴(1978-),女,讲师,博士,E-mail:qinyun_2013@163.com.
文章编号:2095-7386(2016)02-0109-05
DOI:10.3969/j.issn.2095-7386.2016.02.021
中图分类号:TS 201.1
文献标识码:A

