转移相关基因干扰对肝癌转移潜能的影响
黄楚恒,李天然,黄晓斌,蔡立杰,卢光明,李延军
·论著·
转移相关基因干扰对肝癌转移潜能的影响
黄楚恒1,李天然2,黄晓斌1,蔡立杰1,卢光明3,李延军3
目的通过干扰高转移潜能肝癌细胞(MHCC97-H)中的骨桥蛋白(OPN)、肿瘤增殖性因子肿瘤生长因子β1(TGFβ1)基因,使之减少OPN、TGFβ1表达,观察MHCC97-H转移能力的变化情况。方法对MHCC97-H细胞行OPN、TGFβ1基因干扰,qPCR法检测干扰效果。MHCC97-H细胞迁移细胞学实验采用transwells法。肺转移动物模型制作方法:裸鼠尾静脉注射各组细胞,含细胞数5×106个/只,隔天连续注射3次,2周后观察肺脏组织。离体肺脏组织标本制作,DAPI 染核处理10 min,甘油PBS 封片,置于荧光显微镜下观察。免疫荧光法检测裸鼠动物模型整合素αvβ3 表达。结果经基因干扰后MHCC97-H表达OPN和TGFβ1明显降低(P<0.05)。细胞学实验显示与对照组比较,经OPN和TGFβ-1干扰组MHCC97-H细胞迁移数量明显减少(P<0.01)。动物模型实验显示与对照组比较,OPN和TGFβ1干扰组肺组织中肝癌细胞较少,定量分析显示OPN和TGFβ1干扰组肺脏组织中肝癌细胞IOD值明显低于对照组(P<0.05)。OPN和TGFβ1干扰组与对照组比较整合素 αvβ3表达IOD值差异无统计学意义(P>0.05)。结论经OPN和TGFβ1基因干扰的MHCC97-H细胞肺转移能力有明显的下降,尤其是TGFβ1基因干扰组下降更加明显,但经OPN和TGFβ1基因干扰的MHCC97-H细胞表达整合素αvβ3能力无变化,整合素αvβ3介导参与了OPN和TGFβ1共同作用肝癌转移行为的变化。
肝癌,转移;骨桥蛋白;肿瘤生长转化因子;整合素
肝癌的转移行为是影响肝癌预后的关键因素之一,多种生物学因子参与到了肝癌的转移过程中。复旦大学肝癌研究所构建的具有不同转移潜能的肝癌模型成为研究肝癌转移行为的有效手段,具有高转移潜能肝癌细胞(MHCC97-H)肺转移率100%。本课题研究组主要关注对肝癌转移潜能的生物干预,为寻找合适的生物治疗靶点提供依据。前期通过基因工程技术对自体骨髓间充质干细胞(autologous bone marrow mesenchymal stem cells,BMSC)进行改造,使其增加转移性相关因子骨桥蛋白(osteopontin, OPN)基因表达、肿瘤增殖性因子肿瘤生长因子β1(transforming growth factor β,TGFβ1)基因的表达,观察经基因改造的BMSC对具有不同转移潜能肝癌的影响情况,研究结果显示外源性生物活性因子可以促进肝癌细胞的增殖和转移[2-3]。因此,减少生物活性因子的表达,可能起到抑制肿瘤转移和增殖的作用。本研究通过抑制MHCC97-H中的OPN、TGFβ1基因,使之减少OPN、TGFβ1表达,观察肝癌细胞转移能力的变化情况。
1 材料与方法
1.1实验仪器及试剂冰冻切片机(HM525 NX型,Thermo公司),正置荧光显微镜(BX43 型, OLYMPUS 公司),冰箱(BCD-211KD3 型, TCL公司),轮转式切片机(RM2235 型,LEICA 公司),病理组织漂烘仪(tec 2500 型,常州市郝思琳仪器设备有限公司),转盘式扫描共聚焦显微镜(OLYMPUS公司DSU),冰箱(BCD-211KD3 型, TCL公司),电热恒温鼓风干燥箱(101-3 型,上海锦屏仪器有限公司),隔水式恒温培养箱(PYX-DHS500BS-Ⅱ型,上海跃进医疗器械有限公司)。鼠多克隆整合素αvβ3抗体(santa,批号:L2206),工作浓度为1∶50;驴抗兔荧光二抗(Life,批号:1531671,激发/发射波长:490/520 nm),工作浓度为1∶800;柠檬酸抗原修复液(pH6.0,福州迈新生物技术有限公司);二甲苯(成都市科龙化工试剂厂);无水乙醇(成都市科龙化工试剂厂);DAPI(sigma,吸收波长/发射波长:358/461 nm)。DMEM 培养基(Gibco公司),胎牛血清(FBS,BI公司),青(p)-链霉素(s)(100×P.S.双抗菌素,杭州昊天生物技术有限公司),胰蛋白酶(trypsin,gibco公司),磷酸盐缓冲液(PBS,国药化学试剂有限公司)。1.2实验动物及饲养条件实验用BALB/c雄性裸小鼠均由上海斯莱克实验动物有限责任公司提供,生产许可证号为SCXK(沪)2012-0002,SPF级,动物质量合格证号为0205939,购入时动物体重为20 g左右。饮用水为灭菌二级超纯水,饮用水质量符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-2006)的规定。实验动物房使用许可证号为SYXK(浙)2015-0008,饲养环境:温度范围20~25 ℃,相对湿度范围40%~70%。裸小鼠试验前在动物房环境中适应6 d。维持饲料由上海斯莱克实验动物有限公司提供,执行标准GB14924.3-2010《实验动物配合饲料营养成分》。
1.3实验方法1.3.1MHCC97-H基因干扰方法本课题组前期结果显示MHCC97-H高表达转移相关基因OPN和增殖相关基因TGFβ1,因此,本研究对两种基因分别进行干扰。实验方法:腺病毒载体的构建,TGFβ1 siRNA1序列:G ̄T ̄G ̄G ̄A ̄G ̄C ̄T ̄G ̄T ̄A ̄C ̄C ̄A ̄G ̄A ̄A ̄A ̄T ̄; OPN siRNA1序列:GAGGAGTTGAATGGTGCATAC,合成PAGE胶纯化的oligo序列,载体用BamH I,EcoR I双酶切,切胶回收,退火获得目的片断shRNA3’和5’的单链,目的片段shRNA与载体连接反应,转化后的TGFβ1及OPN shRNA平板挑菌,测序。重组腺病毒TGFβ1&SPP1 shRNA腺病毒:制备重组质粒,重组腺病毒载体的包装,收毒及扩增,TGFβ1及OPN shRNA腺病毒检验。病毒感染MHCC97-H细胞。qPCR检测基因干扰前后TGFβ1及OPN表达情况,步骤包括:① Trizol-离心柱法提取细胞总RNA:收集约106个细胞,裂解,离心。② RNA纯度的测定和RNA的定量:以相应溶剂为对照,取2 μL RNA溶液于Merinton SMA4000检测,观察A260/A280、A260/A230比值及连续波长吸收峰,并计算RNA溶液浓度,判断RNA提取质量。③ 逆转录。④ 荧光定量PCR扩增。
1.3.2MHCC97-H细胞迁移实验设MHCC97-H空白对照组、MHCC97-H基因干扰阴性对照组(native contrast, NC)、MHCC97H TGFβ1基因干扰组、MHCC97-H OPN基因干扰组,用 10%FBS 1×P.S. DMEM 培养基, 37 ℃,5%CO2培养箱孵育培养。取生长对数期各组MHCC97-H细胞,0.25% Trypsin +0.02%EDTA 消化离心,计数后,以 5 ×104/well密度分组铺 24 孔板上室,下室加入DMEM培养基,继续培养,48 h 后, PBS 清洗 1 次,用4%多聚甲醛固定10 min,取出,用棉签擦去上室非迁移细胞,移去transwells,倒置,风干,在24孔板中加入200 μL 0.1%结晶紫,把小室放入其中,室温孵育10 min,取出,PBS清洗3次,随机取3个视野,照相,计数,统计结果。1.3.3动物模型分组①肝癌肺转移模型动物模型共 32 个样本,具体分组为: GFP基因阴性对照组、 OPN基因干扰组、TGFβ1基因干扰组和空白对照组,每组均 8 个样本。②裸鼠整合素(integrin)αvβ3 表达实验共15个样本,具体分组为:基因阴性对照(native contrast,NC)组、OPN基因干扰和TGFβ1基因干扰组,每组均5个样本。
1.3.4肝癌肺转移动物模型制作方法参考文献方法进行。收集处于对数生长期的MHCC97-H空白对照细胞株、MHCC97-H阴性对照细胞株、MHCC97-H OPN干扰细胞株,1000 rpm 离心5 min,调整细胞浓度至2.5×107个/mL,制备单细胞悬液。32只裸鼠分别自尾静脉注射0.2 mL,含细胞数5×106个/只,注射后按压30 s,防止细胞悬液从针孔流出,隔天连续注射3次,2周后观察肺脏组织,复制肺转移移植瘤模型。
1.3.5肝癌肺转移肿瘤标本制作切片方法步骤包括4%甲醛固定3~5 d,修块,脱水,透明处理,浸蜡,石蜡包埋,6 μm切片,DAPI 染核10 min,甘油PBS 封片,置于荧光显微镜下观察。
1.3.6免疫荧光法检测裸鼠动物模型整合素(integrin)αvβ3 表达①二甲苯脱蜡,梯度酒精分步复水:二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、100%乙醇Ⅰ5 min、100%乙醇Ⅱ5 min、95%乙醇5 min、 80%乙醇5 min、PBS 洗3×3 min。②抗原修复:置0.01M 枸橼酸缓冲液(pH 6.0)中微波修复,自然冷却至室温,PBS 冲洗3×3 min。③滴加一抗,4 ℃孵育过夜,PBS 水洗3×3 min。④滴加二抗,37 ℃孵育60 min,PBS 冲洗3×5 min。⑤DAPI 染核,室温10 min。⑥甘油PBS 封片,共聚焦显微镜观察。免疫荧光呈绿色为阳性表达。
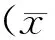
2 结 果
2.1MHCC97-H细胞基因干扰前后TGFβ1及OPN表达结果以β-Action作为内参照基因,以空白对照组(基因干扰前)作为对照基因进行标准化后相对定量,结果见表1。
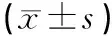
表1 TGFβ1及OPN基因干扰前后MHCC97-H细胞表达
2.2transwells法迁移MHCC97-H细胞计数结果实验组中MHCC97-H NC组迁移细胞数为(129.29±12.32)个,MHCC97-H OPN组迁移细胞数为(72.39±11.32)个,MHCC97-H TGFβ-1组迁移细胞数为(39.12±9.65)个,空白对照组MHCC97-H迁移细胞数为(225.45±17.46)个。结果显示,与对照组MHCC97-H比较,经OPN、TGFβ-1基因干扰MHCC97-H细胞组及阴性对照组,细胞迁移数量组间比较差异具有统计学意义(P<0.01),表明经基因干扰后细胞迁移数量明显减少,尤其是MHCC97-H OPN和MHCC97-H TGFβ1干扰组细胞迁移数量减少为著(P<0.01)。
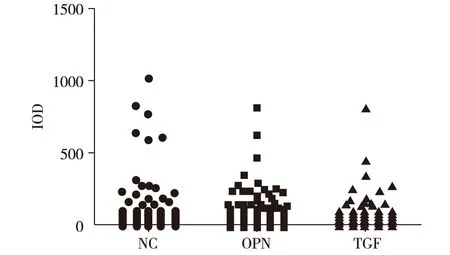
2.3高转移肝癌(MHCC97-H)动物模型肺转移情况荧光成像结果(图1)结果显示,空白对照组和阴性对照组肺脏组织中肿瘤细胞较多,OPN干扰组和TGFβ1对照组肺组织中肿瘤细胞与空白对照组比较较少,表明经基因干扰MHCC97-H肿瘤肺转移潜能下降。为进一步定量观察肺组织细胞中肝癌细胞的转移情况,利用Image J软件对病理切片中肝癌细胞的荧光强度进行定量分析,以细胞积分光密度(integrated option density,IOD)作为定量指标,见图2。

图1 MHCC97-H肿瘤动物模型肺组织转移情况荧光成像(肿瘤细胞呈红色,肺组织细胞核呈蓝色)
NC: 阴性对照组;OPN:OPN基因干扰组;TGFβ1:TGFβ1基因干扰组;MHCC97-H空白对照组图2 肺脏组织中转移性肝癌细胞荧光成像定量分析
利用Image J软件对肺脏中肝癌细胞的荧光强度进行定量分析,结果显示,两组实验组(OPN干扰组和TGFβ1基因干扰组)与空白对照组和阴性基因对照组比较肝癌细胞IOD值较低(P<0.05),表明经OPN和TGFβ1基因干扰后转移能力相减弱,与镜下观察结果一致。
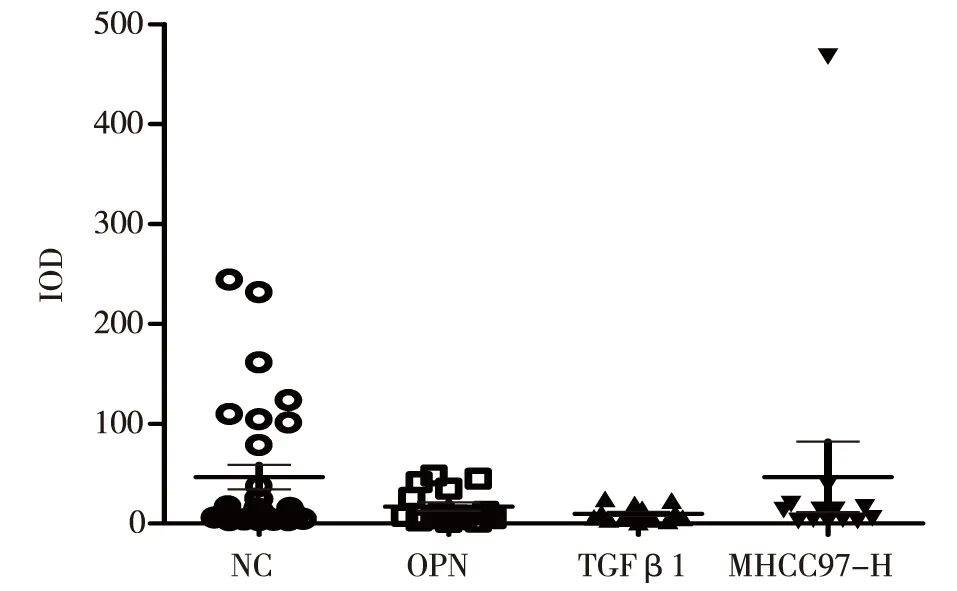
2.4经基因修饰的MHCC97-H动物模型病理切片转移相关因子整合素αvβ3荧光成像表达整合素αvβ3免疫荧光阳性显色绿色为阳性(图3)。
图3 经基因修饰的MHCC97-H动物模型转移相关因子整合素αvβ3荧光成像表达
由镜下可见,两组基因干扰组与对照组比较表达绿色荧光肝癌细胞密度明显减少。利用Image J软件对肺脏中肝癌细胞表达整合素αvβ3的荧光强度进行定量分析,结果显示,细胞IOD值在三组之间差异无统计学意义(P>0.05),表明经OPN和TGFβ1基因干扰的肝癌细胞表达整合素αvβ3能力无变化(图4)。
OPN:OPN基因干扰组;TGFβ1:TGFβ1基因干扰组;NC:阴性对照组 图4 肺脏组织中肝癌细胞表达整合素αvβ3荧光成像定量分析
3 讨 论
肝癌是我国常见的恶性肿瘤,死亡率占恶性肿瘤的第3位,转移和复发是肝癌预后差的主要原因[6-7]。人肝癌细胞株MHCC97-H是具有高转移潜能的肝癌细胞株,其肺转移能力达到100%,该细胞株是研究肝癌肺转移的最佳模型。肝癌的转移行为与多种因素有关,肝癌侵袭转移是一个多基因、多步骤、多因素参与的复杂过程,涉及癌细胞间以及癌细胞与宿主微环境间复杂的相互作用。
本课题组注意到OPN是一种分泌型磷酸化糖蛋白,其分子结构中含有RGD(Arg-Gly-Asp)多肽序列。OPN通过与整合素αvβ3或CD44结合,参与细胞粘附、信号传导、运动等重要的生物学过程,但具体的机制仍在研究之中。研究发现,OPN在伴转移的肝癌组织中显著高表达,提示OPN参与了肝癌的转移行为,通过阻断OPN的表达可以延缓肝癌的转移。另外,TGFβ1是参与肿瘤的增值、侵袭转移重要生物因子,在肝癌的增殖和转移中转化生长因子与肝癌的发生、进展有关[10]。因此,本研究在前期研究的基础上,通过基因工程技术干扰MHCC97-H中OPN和TGFβ1基因,减少两种生物活性因子表达,观察对MHCC97-H细胞及肝癌模型转移能的影响。
细胞学水平观察采用transwells法进行,模拟组织的基底膜结构。肿瘤实现转移突破基底膜是最为关键的一步,突破基底膜的能力代表肿瘤的转移能力。动物模型水平主要是复制高转移潜能肝癌细胞的肺转移模型,通过尾静脉注射经基因干扰前后的MHCC97-H细胞,40 d后观察肝癌的肺转移情况。本实验细胞学实验结果和动物模型实验结果均提示经基因干扰的MHCC97-H细胞迁移能力明显下降,尤其是TGFβ1干扰的MHCC97-H细胞,表明与OPN相比TGFβ1因子更多地参与了肝癌的转移行为。有研究认为[11-12],TGFβ1过度表达可导致对免疫细胞包括T、B淋巴细胞过度抑制,使机体的免疫监督功能大大降低, 对外来病原体免疫应答、免疫清除能力下降,对肿瘤细胞的清除作用降低,导致肿瘤的发生和转移。为进一步探究经基因干扰的MHCC97-H细胞转移潜能变化的生物学机制,本实验对肝癌转移中的关键生物学分子整合素αvβ3表达情况进行分析,对病理切片预处理后进行荧光成像观察,结果显示经基因干扰的实验组(OPN和TGFβ1基因干扰组)肺脏中转移性肝癌病理组织整合素αvβ3的表达能力无明显变化,这可能与整合素αvβ3表达不仅仅在转移性肝癌中表达,肿瘤组织中血管内皮也有整合素αvβ3表达有关。整合素αvβ3介导了肝癌转移行为的变化,周建平等[13]研究结果表明整合素αv表达变化,代表了肝癌的肝癌转移能力的变化。有研究证实[14],TGFβ1因子与整合素αvβ3受体在肿瘤转移相关信号通路上具有联系,即整合素与TGFβ受体介导的两条信号传导通路不仅共用某些信号分子,而且共同作用于多种生物效应并相互促进。OPN分子结构中含有RGD多肽序列,主要通过与其受体整合素αvβ3和CD44相互作用,参与肿瘤转移过程[15]。TGFβ1、OPN与整合素αvβ3之间的关系中,主要OPN介导整合素与细胞外基质(ECM)黏附,成为肿瘤转移的关键步骤,而TGFβ1通过上调整合素关联蛋白激酶(integrin-linked kinase, IKL)的表达而激活蛋白激酶B和TGFβ1提高黏着斑激酶(focal adhesion kinase,FAK)酪氨酸的磷酸化水平,激活下游的信号分子直接或间接地参与整合素与ECM黏附,促进肝癌侵袭和转移。也有学者认为,OPN通过介导TGFβ1依赖性骨髓间充质干细胞向纤维细胞转化机制,而促进肿瘤的增殖和转移[16]。另有学者也进行了TGFβ与MHCC97-H转移的关系的研究,结果表明,TGFβ家族中TGFβRⅡ的高表达能抑制MHCC97-H 的增殖和迁移侵袭,认为其机制可能与TGFβRⅡ高表达后激活TGFβ信号转导通路,改变细胞的生长、运动能力有关[17]。因此,本研究中经OPN、TGFβ1基因干扰的MHCC97-H细胞转移潜能的下降主要与OPN和TGFβ1表达减少有关,而与转移性肝癌组织整合素αvβ3表达无关。
通过基因干扰方法抑制肝癌细胞或组织的OPN和TGFβ1表达,无论从细胞学水平和动物模型水平,肝癌的转移能力均有明显的下降,尤其是TGFβ1基因干扰组下降更加明显,转移相关因子整合素αvβ3表达无明显变化,本研究中经OPN、TGFβ1基因干扰的MHCC97-H细胞转移潜能的下降主要与OPN和TGFβ1表达减少有关,而与转移性肝癌组织整合素αvβ3表达无关。
[1]Li Y, Tang Y, Ye L, et al. Establishment of a hepatocellular carcinoma cell line with unique metastatic characteristics through in vivo selection and screening for metastasis related genes through cDNA microarray . J Cancer Res Clin Oncol, 2003, 129(1): 43-51.
[2]李天然,蔡立杰,赵绍宏,等.OPN转染BMSCs对高转移潜能肝癌细胞的影响.胃肠病学与肝病学杂志,2015,24(9):1057-1061.
[3]李天然,杜湘珂,宋斌,等.TGFβ1转染hMSC对MHCC97-H影响的实验研究.胃肠病学和肝病学杂志,2013,22(7):615-619.
[4]李天然,卢光明,宋斌,等.骨髓间充质干细胞对高低转移潜能肝癌细胞影响的实验研究.胃肠病学与肝病学杂志,2014,23(9):1056-1060.
[5]Kang Y. Imaging TGFβ signaling in mouse models of cancer metastasis. Methods Mol Biol, 2016,1344(1):219-232.
[6]Zhao P, Dai M, Chen W, et al.Cancer trends in china. Jpn J Clin Oncol,2010,40(4):281-285.
[7]倪晶,华海清.索拉非尼联合中药治疗原发性肝癌的研究进展.东南国防医药,2015,17(2):175-178.
[8]Li Y, Tang ZY, Ye SL, et al. Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97. World J Gastroenterol,2001,7(5):630-636.
[9]Ye QH, Qin LX, ForguesM,et al. Predicting hepatitis B virus-positive metastatic hepatocellular carcinomas using gene expression profiling and supervised machine learing. Nat Med, 2003,9(4):416-423.
[10]Budhu A, Wang XW. The role of cytokines in hepatocellular carcinoma. J Leukocyte Biol, 2006, 80(6): 1197-1213.
[11]Li MO, Wan YY, Sanjabi S, et al. Transforming growth factor-beta regulation of immune responses. Annu Rev Immunol,2006, 24: 99-146.
[12]Prasad P, Tiwari AK, Kumar KM, et al. Association of TGFβ1, TNFα, CCR2 and CCR5 gene polymorphisms in type-2 diabetes and renal insufficiency among Asian Indians. BMC Med Genet, 2007, 8:20.
[13]周建平,周伟平.大肝癌TACE后肿瘤组织VEGF、αv整合素表达及MVD变化.东南国防医药,2010,12(3):206-208.
[14]Hayashida T, Jones JC, Lee CK, et al. Loss of beta1-integrin enhances TGF-beta1-induced collagen expression in epithelial cells via increased alphavbeta3-integrin and Rac1 activity. J Biol Chem,2010,285(40):30741-30751.
[15]Zhang R, Pan X, Huang Z, et al. Osteopontin enhances the expression and activity of MMP-2 via the SDF-1/CXCR4 axis in hepatocellular carcinoma cell lines. PLoS One,2011,6(8): e23831.
[16]Weber CE, Kothari AN, Wai PY, et al. Osteopontin mediates an MZF1-TGF-β1-dependent transformation of mesenchymal stem cells into cancer-associated fibroblasts in breast cancer. Oncogene,2015,34(9):4821-4833.
[17]于琨,蒋小峰,邓武坚,等.TGFβRⅡ基因对肝癌细胞MHCC97H 体外增殖和侵袭能力的影响.实用医学杂志,2015,31(5):719-722.
(本文编辑:张仲书;英文编辑:王建东)
Effect ofsilence of associated metastasis gene on hepatocellular carcinoma metastasis
HUANG Chu-heng1, LI Tian-ran2, HUANG Xiao-bin1,CAILi-jie1,LUGuang-ming3,LIYan-jun3.
1.DepartmentofRadiology,95HospitalofPLA,Putian,Fujian351100,China; 2.DepartmentofRadiology,theFirstAffiliatedHospitalofPLAGeneralHospital,Beijing, 100048,China; 3.DepartmentRadiology,NanjingGeneralHospitalofPLA,Nanjing,Jiangsu210002,China
ObjectiveTo observe the change of metastasis ability of hepatocellular carcinoma by inhibiting OPN, TGFβ1 gene expression of the high metastatic potential of hepatocellular carcinoma cells (MHCC97-H). MethodsOPN and TGFβ1 gene silencing were made in the MHCC97-H cells and qPCR was used to test the expression of MHCC97-H cells. MHCC97-H cells migration experiment used transwells assay. Lung metastasis animal model making method: MHCC97-H cells were injected into the tail vein of nude mice three times every two days, and 0.2 mL cells suspension contained 5 × 106cells, and the lung tissue was observed after 2 weeks. Lung tissue samples: DAPI nuclear stainined for 10 min, glycerol PBS mounted, and observed under fluorescent microscope. Nude mice animal model of integrin αvβ3 expression was detected by immunofluorescence. ResultsOPN and TGFβ-1 expression of MHCC97-H by genes silencing significantly decreased (P<0.05). Compared with the control group, the cells migration of MHCC97-H OPN and TGFβ-1 genes silencing groups significantly decreased (P<0.01). Animal model experiments showed that there were less tumor cells in the lung tissue of the OPN and the TGFβ1 gene silence group compared with the control group. The results of quantitative analysis showed that the IOD value of the blank control group and the negative control group was greater than the two experimental groups, and the difference was statistically significant (P<0.05). Compared with the control group, the IOD of integrin alpha v beta 3 expression in two genes silencing groups wasn’t significantly different. ConclusionFrom the level of cytology and animal model results, there was significant decrease in the metastatic ability of MHCC97-H cell by genes silencing, especially in the TGFβ1 gene si-lencing group. The expression ability of related metastasis factor integrinαvβ3 had no change, and it suggests that integrin αvβ3 mediates the role of OPN and TGFβ1 in HCC metastasis.
HCC, metastasis; OPN; TGFβ1; integrin
国家自然科学基金资助项目(81271607); 南京军区医药卫生重点资助项目(11Z035);国家博士后基金(2015M572810)
1. 351100福建莆田,解放军95医院放射科;2. 100048北京,解放军总医院第一附属医院放射科; 3. 210002江苏南京,南京总医院医学影像科
李天然, E-mail: lizhaoruixin@sina.com
R735.7
A
10.3969/j.issn.1672-271X.2016.03.001
2016-02-20;
2016-04-16)
引用格式:黄楚恒,李天然,黄晓斌,等.转移相关基因干扰对肝癌转移潜能的影响.东南国防医药,2016,18(3):225-229,236.

