类球红细菌辅酶Q10发酵培养基的优化*
.福建师范大学生命科学学院 2.厦门市科环海洋生物科技有限公司 周 勇 郑 毅
类球红细菌辅酶Q10发酵培养基的优化*
1.福建师范大学生命科学学院2.厦门市科环海洋生物科技有限公司周勇1,2郑毅1
[摘要]为了提高类球红细菌辅酶Q10的发酵能力,本研究对发酵培养基中重要因子进行优化组合。首先对重要因子进行单因子实验,确定最佳浓度范围。在最佳浓度范围内进行均匀设计试验,分别采用多项式逐步回归、偏最小二乘二次回归、偏最小二乘二次回归(考虑交换项)、偏最小二乘二次回归(考虑平方项)分析。结果表明,偏最小二乘二次回归分析的优化方案预测值与实验值最为接近,显示各因子浓度与辅酶Q10浓度呈现二次曲线关系,各因子间的交换作用不能忽略。偏最小二乘二次回归分析优化方案使辅酶Q10浓度得到明显提高,辅酶Q10的发酵水平达到230.71mg.L-1,比优化前提高了53.81%。
[关键词]类球红细菌辅酶Q10均匀设计偏最小二乘二次回归
辅酶Q(Coenzyme Q,CoQ)又称泛醌(Ubiquinone),是自然界中广泛存在的脂溶性醌类化合物,存在于原核生物的细胞膜或真核生物的线粒体内膜的磷脂双分子层的疏水区域中。辅酶Q是有氧呼吸电子传递链的重要递氢体,同时也是一种天然的抗氧化性剂和非特异免疫增强剂,在多种疾病中具有良好的辅助医疗效果[1, 2]。
目前辅酶 Q10的制备方法有三种:动植物组织提取法、化学合成法、微生物发酵生产法[3]。由于微生物发酵法的产物为天然物质,生物活性高、容易被人体吸收[4],成为制备辅酶 Q10最有潜力的方法与研究热点。发酵培养基优化是提高微生物代谢产物积累水平最有效的办法。于子玲等[5]采用Plackett-Burman实验设计和Box- Behnken响应面分析方法对辅酶Q10生产菌的发酵培养基进行优化,优化后辅酶Q10产量为51.31mg/L,比优化前提高了 99.34%。邵玲莉等[6]对辅酶Q10生产菌鞘氨醇单胞菌YZ0803的发酵条件进行探讨及组分的正交试验优化,在摇瓶水平上,辅酶 Q10的最终浓度高达192mg/L,比优化前提高了39.13%。
均匀设计法[7]是一种常用的因子优化组合方法,它利用试验设计和数学建模,通过局部试验回归,拟合因素与结果间的全局函数关系,从而能获得比较准确的优化组合。
本文先采用单因子实验,确定基础培养基中重要成分的适宜浓度范围。在单因子实验基础上,对重要因子进行均匀设计试验,分别采用二次多项式逐步回归、偏最小二乘二次回归、偏最小二乘二次回归(考虑交换项)、偏最小二乘二次回归(考虑平方项)分析,以期提高类球红细菌产辅酶Q10的发酵水平。
1 材料和方法
1.1菌株
类球红细菌(Rhodobacter sphaeroides),本实验室选育保藏。
1.2培养基
(1)琼脂平板培养基(单位:g·L-1):葡萄糖18、酵母粉4.5、味精2、(NH4)2SO45.25、MgSO48.75、KH2PO41.5、FeSO41.2、NaCl4.2、琼脂粉 20。
(2)种子培养基:与琼脂平板培养基相同,但不添加琼脂,另外添加0.5% CaCO3作为pH缓冲剂。
(3)基础培养基(单位:g·L-1):葡萄糖20、玉米浆粉3.5、味精2.5、(NH4)2SO44.0、MgSO41.0、KH2PO41.2、FeSO41.6、NaCl 3.5、A 0.1、B 0.1,添加1% CaCO3作为pH缓冲剂。
1.3培养方法
从活化的琼脂平板培养基上,挑取单菌落,接入装有20mL种子培养基的 250mL三角瓶中,在温度 32℃、转速220r/min下培养24h,作为摇瓶种子液;按10%接种量,将种子液接入 45mL基础培养基的250mL三角瓶中,在温度32℃、转速220r/min下培养48h。
1.4辅酶Q10的提取及检测
采用超声波提取法[8, 9]破碎细胞,获得辅酶 Q10;采用HPLC法[10]测定辅酶Q10浓度。
1.5实验方法
(1)采用单因子实验,确定基础培养基中重要成分的最佳浓度范围。
(2)在Data Processing Statio(DPS)7.05软件中对重要因子进行均匀设计实验,分别采用二次多项式逐步回归、偏最小二乘二次回归、偏最小二乘二次回归(考虑交换项)、偏最小二乘二次回归(考虑平方项)分析,得出不同的优化方案。通过验证实验,确定辅酶 Q10发酵培养基的最佳优化组合。
2 结果与分析
2.1重要组分的单因子浓度实验
在辅酶Q10基础培养基上,分别对葡萄糖、玉米浆粉、(NH4)2SO4、味精进行单因子优化试验,结果见图1~图4。
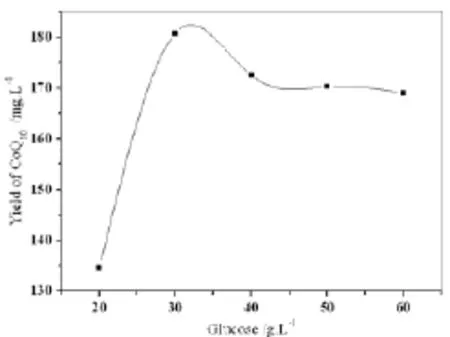
图1 葡萄糖对辅酶Q10产量的影响
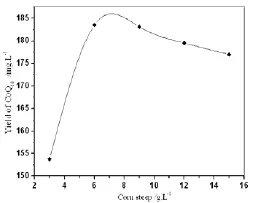
图2 玉米浆粉对辅酶Q10产量的影响

图3 (NH4)2SO4对辅酶Q10产量的影响
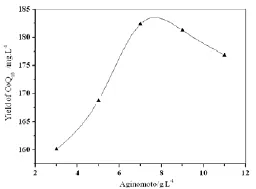
图4 味精对辅酶Q10产量的影响
由图1~图4可初步确定这4种成分的最佳浓度范围:葡萄糖25~40g·L-1、玉米浆粉5~9g·L-1、(NH4)2SO43~7g·L-1、味精5~9g·L-1。
2.2均匀设计试验表格及实施
在葡萄糖、玉米浆粉、(NH4)2SO4、味精的单因子浓度基础上,按照均匀设计表U15(54)进行试验设计,各因子浓度安排水平见表1。
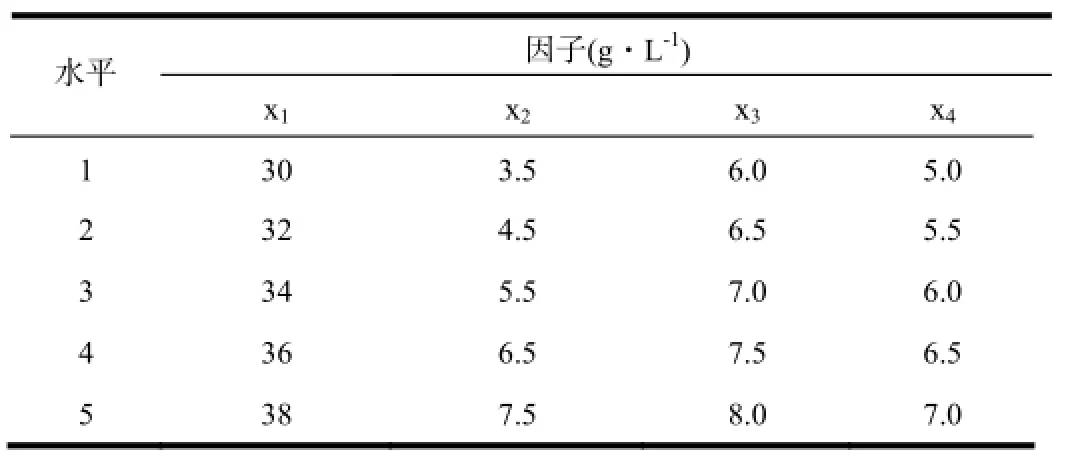
表1 均匀设计试验因素水平
将上述4种组分的浓度水平按照DPS7.05软件自动生成的均匀设计表U15(54)排列,培养基其他组分浓度按照基础培养基进行,试验结果见表2。
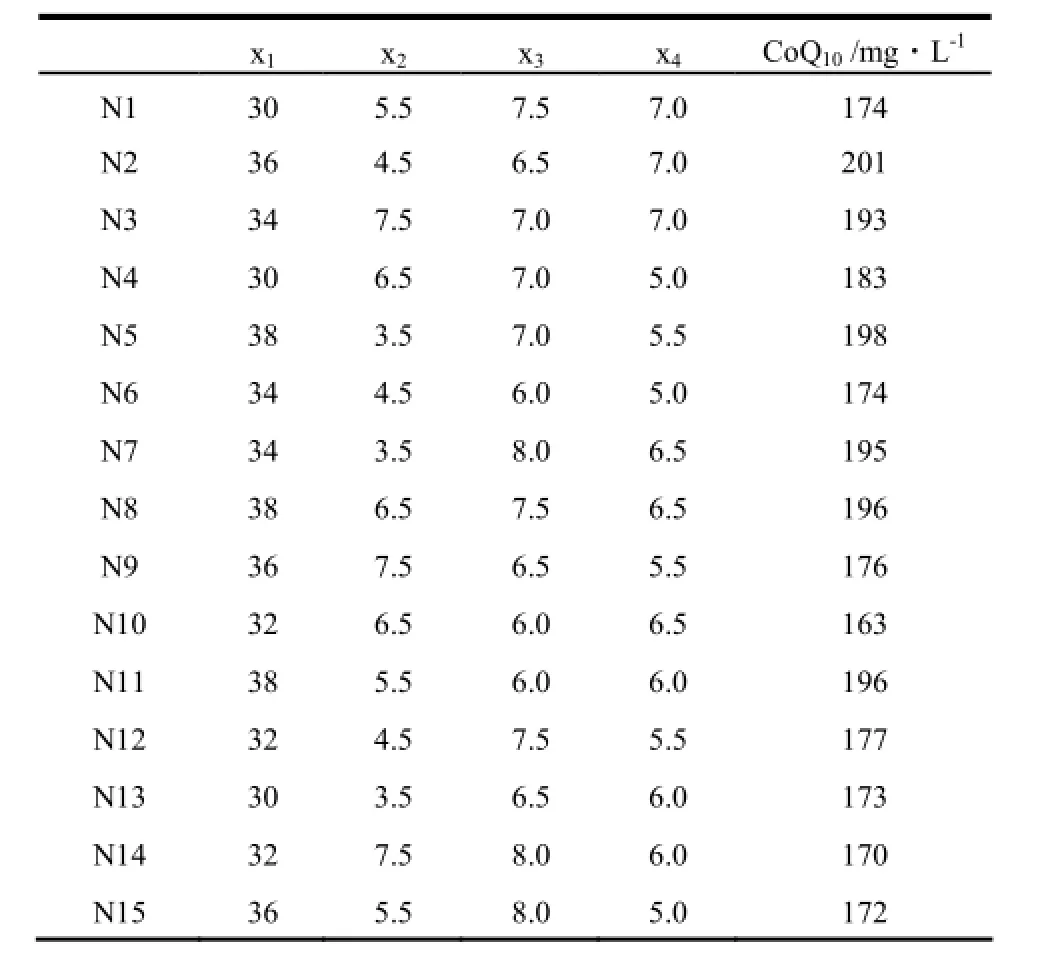
表2 4种培养基成分均匀设计优化
2.3均匀设计试验数据统计分析
2.3.1二次多项式逐步回归分析
采用二次多项式逐步回归分析法对表2进行数据分析,得到以下数学模型方程:
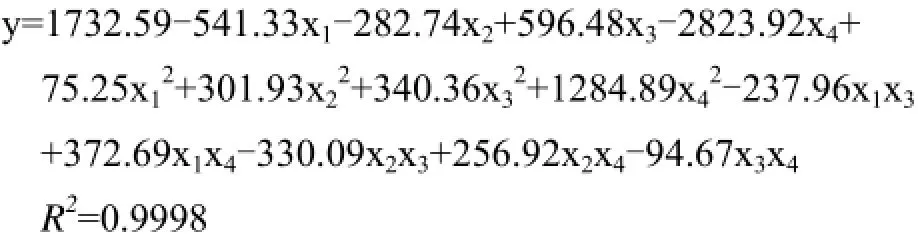
此回归方程相关系数R2=0.9998,表明方程有效。总体显著性检验值 F=222.25,显著水平 P=0.05,表明该模型可信度高。其优化组合为:葡萄糖38g·L-1、(NH4)2SO47.5 g·L-1、味精6.0 g·L-1、玉米浆粉7.0 g·L-1。结果表明,辅酶Q10积累浓度为221m g·L-1,与模型预测值(249mg·L-1)相差11.24%,这表明二次多项式逐步回归分析法所建立的模型不能很好反映出因子与响应值的非线性关系。
2.3.2偏最小二乘二次回归分析
对表2数据进行偏最小二乘二次回归、偏最小二乘二次回归(考虑平方项)、偏最小二乘二次回归(考虑交换项)分析得出不同的优化方案,结果见表3。

表3 培养基不同优化方案对辅酶Q10发酵的影响
由表3可知,偏最小二乘二次回归、偏最小二乘二次回归(考虑平方项)、偏最小二乘二次回归(考交换项)的实验值相差不大,但是后两者的预测值与实验值偏差要大于前者。这表明,上述4个因子浓度与辅酶Q10浓度呈二次曲线关系,同时各因子间的交换作用不可忽略。如果在偏最小二乘二次回归分析中,只考虑各因子的平方项或各因子间的互作项时,则分析预测值与实验值都有较大的偏差。所以将偏最小二乘二次回归分析方案作为辅酶Q10发酵培养基最佳优化方案:葡萄糖38 g·L-1、玉米浆粉7.0 g·L-1、硫酸铵3.5g·L-1、味精 7.2 g·L-1。该优化方案下的辅酶 Q10浓度为 230.71 mg·L-1,比优化前(150 mg·L-1)提高了53.81%。
3 结论
本实验先采用单因子实验,确定基础培养基中重要成分的适宜浓度范围,再采用均匀设计对重要因子进行优化组合,分别进行二次多项式逐步回归、偏最小二乘二次回归、偏最小二乘二次回归(考虑交换项)、偏最小二乘二次回归(考虑平方项)分析。结果表明,各因子的平方项和各因子间的互作项对响应值都具有影响作用。偏最小二乘二次回归分析的模型预测值与实验值偏差最小,其优化方案使辅酶 Q10浓度得到明显提高。
参考文献:
[1] Jeya M, Moon H-J, Lee J-L, et al. Current state of coenzyme Q10 production and its applications[J]. Applied microbiology and biotechnology, 2010, 85(6):1653-1663.
[2] Kettawan A, Kunthida C, Okuno M, et al. Protective effects of coenzyme Q10 against oxidative stress induced by aerobic exercise[J]. Institute of Nutrition, 2012(44):1-2.
[3] 陶志杰,王改玲,李妍. 辅酶 Q10的制备及应用新进展[J]. 畜牧与饲料科学, 2010, 31(9):9-11.
[4] 郑毅,王娅, 朱志春,等. 发酵法生产辅酶 Q10研究进展[J]. 海峡科学, 2012(8):128-130.
[5] 于子玲,袁亚宏,岳田利,等. 响应曲面法优化辅酶 Q10产生菌发酵培养基[J]. 食品工业科技, 2012, 33(18):186-189.
[6] 邵玲莉,石玲玲. 辅酶 Q10产生菌发酵条件的优化[J]. 生物加工过程, 2010, 8(2):18-22.
[7] 唐良华,夏黎明,苏敏. Bacillus sp. ZJU318 脂肪酶发酵条件的优化及其酶学性质的研究[J]. 科技通报, 2006, 22(5):622-626.
[8] 吴祖芳,堵国成,陈坚. 发酵液中辅酶 Q10的分离纯化和定量分析[J]. 无锡轻工大学学报, 2002, 21(4):420-423.
[9] 朱志春,郑毅,朱中南,等. 超声波破碎法提取辅酶 Q10研究[J]. 海峡科学, 2012(2):17-19.
[10] 朱志春. 基因组改组选育类球红细菌辅酶Q10高产菌株[D]. 福州:福建师范大学,2012.
* 福建省自然基金资助,项目编号:2015J01127。

