实时剪切波弹性成像在骨骼肌系统中的应用
王艳春 肖沪生 徐 芳 银浩强 高东雯 任亚娟
实时剪切波弹性成像在骨骼肌系统中的应用
王艳春 肖沪生 徐 芳 银浩强 高东雯 任亚娟
【关键词】肌肉骨骼系统;超声检查;弹性成像技术;综述
实时剪切波弹性成像(shear wave elastography,SWE)是评估软组织弹性的一项新兴超声成像技术,是通过发射声辐射对组织施加激励,在组织内产生远低于声速的剪切波[1],并采用超高速成像技术获得剪切波的高时间分辨率图像,根据杨氏模量与剪切波关系E=3ρc²(E:杨氏模量,c:剪切波传播速度,ρ:组织密度)自动计算出杨氏模量值。通过定量分析系统可以直接得到感兴趣区域的杨氏模量值[2]。SWE目前主要应用于甲状腺、乳腺、肝脏、脾脏、前列腺、唾液腺、生殖泌尿系统及淋巴结等的研究[3],也有应用于血管及颈动脉的定量研究[4-6]。随着SWE在临床的广泛应用,其同样适用于骨骼肌系统。本文对SWE的形成及目前在骨骼肌系统的研究做一综述。
1 弹性技术的发展与实时剪切波技术的形成
目前超声弹性成像技术较多,Taylor等[7]于2000年将超声弹性成像技术分为压迫性弹性成像、间歇性弹性成像和震动性弹性成像。1991年,Ophir等[8]最早提出的超声弹性成像属于压迫性弹性成像,在操作者对组织多次加压-减压过程中,比较感兴趣区内组织与周围正常组织之间产生的弹性差异。1998年,Fatemi等[9]提出超声激发震动声谱成像,利用声学射频压力诱发局部内部震动,并追踪组织运动轨迹,后被称为震动性弹性成像。1999年,Catheline等[10]提出间歇性弹性成像,应用低频率间歇震动造成组织位移,用组织反射回来的超声波探测组织的位置,得到感兴趣区域组织不同弹性系数组织的相对硬度图。2002年,Nightingale等[11]提出声脉冲辐射力成像,通过探头对组织发射脉冲,使组织产生纵向压缩,横向震动(低频剪切波),从而获得横向低频剪切波信号,直接获得剪切波速度并间接反映该区域组织弹性。2008年,西门子公司推出的ACUSON S2000所包含的“虚拟触诊”功能即应用该原理[12]。近年法国Aixplorer型ShearWave™实时SWE超声诊断仪的产生,在自动产生并分析实时剪切波的基础上,通过定量分析系统获得作为重要的生物力学参数的杨氏模量值,从而实现超声弹性成像的全定量,推动了SWE在临床的广泛研究。
2 SWE在骨骼肌系统的应用
2.1 SWE在肌腱中的应用 超声技术已经应用于骨骼肌系统的研究并得到了广泛认可,SWE在肌腱测量方面也具有一定的可行性。Aubry等[13]报道,SWE能有效地用于测量正常人体跟腱,而且跟腱的杨氏模量值随足背屈曲角度的增加而增加。张立宁等[14]利用SWE评价足底筋膜炎,发现足底筋膜的硬度随年龄增加而减小,足底筋膜炎的硬度较正常筋膜小,可能是因为新生血管增多所致,与既往研究[15-16]结果一致。Chen等[17]对36例正常人及14例跟腱断裂患者跟腱弹性模量进行分析,发现尽管正常跟腱硬度可能由于大于机器可测量范围而导致测量数据小于实际值,但因为断裂跟腱弹性模量值明显降低,且新鲜血肿部分表现弹性模量值为0,提示SWE对跟腱断裂的损伤及恢复过程具有较大的临床应用前景。
2.2 SWE在肌肉组织的应用
2.2.1 SWE在肌肉组织的基础研究 杨氏模量值与多种因素有关。Nordez等[18]通过应用SWE对肱二头肌肌腹等长收缩过程中肌肉杨氏模量变化分析发现,杨氏模量值与肌电活动有密切的线性关系。肖沪生等[2]也进一步证实了肌肉收缩过程中杨氏模量值变化曲线与在分子生理学水平的研究有一定的相似性,并证实SWE具有足够的灵敏度能够动态监测肌肉收缩过程中的杨氏模量值。比较两块肌肉组织在静止和紧张状态下各自及相互间的杨氏模量的分布特征显示,组织高回声区在静止状态下杨氏模量值较大,收缩过程中该区域杨氏模量值变化更大[19],与既往研究[20-21]证实肌肉组织收缩过程中硬度增加一致,即杨氏模量值增大。Koo等[22]通过对离体火鸡腓肠肌与胫外侧肌被动张力实验证明,应用实时剪切波技术获得的杨氏模量值与被动肌张力也存在线性关系;Eby等[23]应用一种能够拉长肌肉的设备,结合SWE,测量从猪离体骨骼肌的杨氏模量值与应用传统材料检测所得到的杨氏模量值高度相关。因此,杨氏模量值与肌肉活动性、组成、结构[19]、年龄及性别[18,24]均有较大的相关性。基于SWE于肌肉组织应用的可行性,徐芳等[25]首次将该技术应用于分析针刺“得气”与杨氏模量值变化的关系。任亚娟等[26]通过比较针刺前与针刺后及电刺激后肌肉组织杨氏模量值,发现差异均有统计学意义。上述结论进一步说明该技术可以应用于针刺“得气”的更深层次研究(图1)。通过近年对SWE的可行性研究,初步奠定了该技术应用于肌肉组织的基础,也为实验针灸学展开了新思路。
2.2.2 SWE评价肌肉病变的临床应用 Koo等[27]通过应用SWE成功得到胫骨前肌的弹性-曲度关系参数,能够更好地量化被动肌张力,并为进一步研究诊断价值提供可靠数据,为即将在颈部、背部、腰部等其他肌肉组织的进一步诊断提供了良好的指导方向。Lacourpaille等[28]采用实时SWE评估假肥大性营养不良患者在放松状态下肌肉硬度较正常人的变化特点,结果显示除小指屈肌组差异无统计学意义外,腓肠肌内侧肌、胫骨前肌、股外侧肌、肱二头肌、肱三头肌在顺肌纤维方向测量弹性模量值比较差异均有统计学意义。该研究表明,实时弹性成像可作为评估患者的一种新方法。SWE也被应用于评估帕金森病患者上肢肌张力[29],并用于测量女性耻骨直肠肌杨氏模量值[30],有望为妇科提供新的理论指导。2.3 SWE应用于肌肉组织的优势 以往应用二维超声已经获得丰富的形态学参数,如肌肉厚度、横截面积、肌纤维长度、羽状角等[31],并在一定程度上应用超声技术来评估神经肌肉、肌腱、韧带及关节病变,指导康复治疗,并有学者通过监测肌肉组织的厚度等形态学参数对重症监护室内因制动引起的肌肉无力患者进行评估[32]。但二维超声不能提供骨骼肌系统的机械力学特性,肌肉组织的各向异性也增加了二维超声应用的局限性[33],而超声弹性成像可以克服这种缺陷,随着超声弹性成像的飞速发展与不断完善, SWE克服了二维超声的不足,而且与其他弹性成像技术相比,不需要手动压缩过程,减小了操作者测量过程的误差,具有良好的重复性,并能直接获得代表肌肉组织生物学特性的杨氏模量值,不再局限于只能与周围组织进行弹性比较,更适用于肌肉组织系统的定量评价。
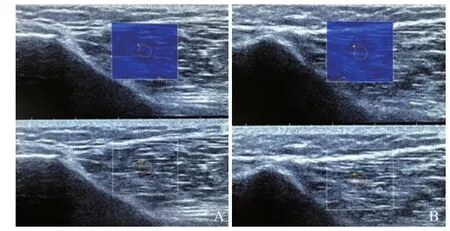
图1 应用Aixplorer型ShearWave™实时SWE超声诊断仪对正常人阳陵泉穴(小腿外侧,当腓骨小头前下方凹陷处)下肌肉组织杨氏模量的测量图像,探头方向与肌纤维排列方向夹角为0°。A、B分别为针刺前及针刺后杨氏模量值测量
3 临床应用展望
肌肉组织弹性正常、异常参考值对肌肉组织病变与否有重要意义。近期有学者通过研究试图确立生理及病理状态下弹性值的范围[34-35],但目前尚缺乏肌肉组织杨氏模量正常、异常值参考范围的相关报道,将成为今后的研究方向。目前,应用SWE进行肌肉相关疾病的研究较少,但该技术的优越性将在肌肉损伤诊断、监测疾病的发展以及评估疾病所处阶段、预后,评价外科、康复理疗疗效等方面发挥更大的作用;在传统医学方面也将会有深远的影响[36]。
4 SWE应用于肌肉组织的局限性
尽管SWE具有非常好的稳定性[37],但其受操作技术的影响,Kot等[38]研究发现,髌韧带的弹性模量与感兴趣区大小无关,而与施加压力大小有关,压力较大会影响弹性模量的准确性。因此,进行SWE时应该施加较小的压力,同时也应注意探头角度问题[39-40],Miyamoto等[41]比较探头与肌束方向夹角及探头与皮肤夹角对测量杨氏模量值的影响,发现探头与肌束夹角<20°时差异无统计学意义,探头与皮肤表面夹角不影响测量值,在一定程度上证明了SWE测量肌肉组织杨氏模量的可靠性和可行性。
综上所述,目前SWE应用于肌肉组织系统的研究较少缺少统一的测量标准,包括机器的调节标准等。同时由于肌肉组织较深,与其他组织有一定的重叠,加上肌肉组织本身复杂的特性和操作者本身的主观性,选择观察部位及体位不同,为研究带来一定的困难。因此,SWE用于肌肉组织系统还需进一步研究其方法学,并增加其他方法的横向对比研究。
参考文献
[1] Sarvazyan AP, Rudenko OV, Swanson SD, et al. Shear wav elasticity imaging: a new ultrasonic technology of medica diagnostics. Ultrasound Med Biol, 1998, 24(9): 1419-1435.
[2] 肖沪生, 任亚娟, 徐智章, 等. 肱二头肌收缩的剪切波声弹性成像动态测定及其生理学意义探讨. 上海医学影像, 2012, 21(2)81-83.
[3] Cosgrove D, Piscaglia F, Bamber J, et al. EFSUMB guidelines an recommendations on the clinical use of ultrasound elastography Part 2: clinical applications. Ultraschall Med, 2013, 34(3): 238-253
[4] Couade M, Pernot M, Prada C, et al. Quantitative assessment o arterial wall biomechanical properties using shear wave imaging Ultrasound Med Biol, 2010, 36(10): 1662-1676.
[5] Garrard JW, Ramnarine K. Shear-wave elastography in caroti plaques: comparison with grayscale median and histologica assessment in an interesting case. Ultraschall Med, 2014, 35(1): 1-3.
[6] Ramnarine KV, Garrard JW, Kanber B, et al. Shear wave elastograph imaging of carotid plaques: feasible, reproducible and of clinica potential. Cardiovasc Ultrasound, 2014, 12: 49.
[7] Taylor LS, Porter BC, Rubens DJ, et al. Three-dimensiona sonoelastography: principles and practices. Phys Med Biol, 2000 45(6): 1477-1494.
[8] Ophir J, Céspedes I, Ponnekanti H, et al. Elastography:quantitative method for imaging the elasticity of biological tissues Ultrason Imaging, 1991, 13(2): 111-134.
[9] Fatemi M, Greenleaf JF. Ultrasound-stimulated vibro-acoustic spectrography. Science, 1998, 280(5360): 82-85.
[10] Catheline S, Thomas JL, Wu F, et al. Diffraction field of a low frequency vibrator in soft tissues using transient elastography. IEEE Trans Ultrason Ferroelectr Freq Control, 1999, 46(4): 1013-1019.
[11] Nightingale K, Bentley R, Trahey G. Observations of tissue response to acoustic radiation force: opportunities for imaging. Ultrason Imaging, 2002, 24(3): 129-138.
[12] 张志伟, 钱雪松. ACUSON S2000彩色多普勒超声诊断仪ARFI技术原理及临床应用. 医疗卫生装备, 2012, 33(8): 125-126.
[13] Aubry S, Risson JR, Barbier-Brion B, et al. Transient elastography of calcaneal tendon: preliminary results and future prospects. J Radiol, 2011, 92(5): 421-427.
[14] 张立宁, 万文博, 张立海, 等. 剪切波弹性成像评价足底筋膜炎.南方医科大学学报, 2014, 34(2): 206-209.
[15] Sahin H, Tholema N, Petersen W, et al. Impaired biomechanical properties correlate with neoangiogenesis as well as VEGF and MMP-3 expression during rat patellar tendon healing. J Orthop Res, 2012, 30(12): 1952-1957.
[16] Tuite DJ, Renström PA, O'brien M. The aging tendon. Scand J Med Sci Sports, 1997, 7(2): 72-77.
[17] Chen XM, Cui LG, He P, et al. Shear wave elastographic characterization of normal and torn achilles tendons: a pilot study. J Ultrasound Med, 2013, 32(3): 449-455.
[18] Nordez A, Hug F. Muscle shear elastic modulus measured using supersonic shear imaging is highly related to muscle activity level. J Appl Physiol (1985), 2010, 108(5): 1389-1394.
[19] Shinohara M, Sabra K, Gennisson JL, et al. Real-time visualization of muscle stiffness distribution with ultrasound shear wave imaging during muscle contraction. Muscle Nerve, 2010, 42(3): 438-441.
[20] Basford JR, Jenkyn TR, An KN, et al. Evaluation of healthy and diseased muscle with magnetic resonance elastography. Arch Phys Med Rehabil, 2002, 83(11): 1530-1536.
[21] Okada M. An electromyographic estimation of the relative muscular load in different human postures. J Hum Ergol (Tokyo), 1973, 1(1): 75-93.
[22] Koo TK, Guo Y, Cohen JH, et al. Relationship between shear elastic modulus and passive muscle force: an ex-vivo study. J Biomech, 2013, 46(12): 2053-2059.
[23] Eby SF, Song P, Chen S, et al. Validation of shear wave elastography in skeletal muscle. J Biomech, 2013, 46(14): 2381-2387.
[24] Eby SF, Cloud BA, Brandenburg JE, et al. Shear wave elastography of passive skeletal muscle stiffness: influences of sex and age throughout adulthood. Clin Biomech (Bristol, Avon), 2015, 30(1): 22-27.
[25] 徐芳, 肖沪生, 徐智章, 等. 剪切波声弹性成像仪对人体足三里穴位定位及紧张度观察. 上海医学影像, 2012, 21(2): 84-87.
[26] 任亚娟, 徐芳, 徐智章, 等. 剪切波声弹性成像技术对足三里穴位不同肌张力及针刺前后的紧张度观察. 中国中西医结合影像学杂志, 2013, 11(2): 113-115, 封2.
[27] Koo TK, Guo JY, Cohen JH, et al. Quantifying the passive stretching response of human tibialis anterior muscle using shear wave elastography. Clin Biomech (Bristol, Avon), 2014, 29(1): 33-39.
[28] Lacourpaille L, Hug F, Guével A, et al. Non-invasive assessment of muscle stiffness in patients with Duchenne muscular dystrophy. Muscle Nerve, 2015, 51(2): 284-286.
[29] 杜丽娟, 程令刚, 李晨, 等. 实时剪切波超声弹性成像技术评估帕金森病患者上肢肌张力的临床研究. 首都医科大学学报, 2014, 35(2): 155-158.
[30] 王瑾, 王慧芳, 陈华, 等. 实时剪切波弹性成像测量女性耻骨直肠肌杨氏模量值. 中国医学影像技术, 2015, 32(4): 586-589.
[31] Hoang P, Saboisky JP, Gandevia SC, et al. Passive mechanical properties of gastrocnemius in people with multiple sclerosis. Clin Biomech (Bristol, Avon), 2009, 24(3): 291-298.
[32] Cartwright MS, Kwayisi G, Griffin LP, et al. Quantitative neuromuscular ultrasound in the intensive care unit. Muscle Nerve, 2013, 47(2): 255-259.
[33] Botar JC, Vasilescu D, Damian L, et al. Musculoskeletal sonoelastography. Pictorial essay. Med Ultrason, 2012, 14(3): 239-245. [34] Berko NS, Fitzgerald EF, Amaral TD, et al. Ultrasound elastography in children: establishing the normal range of muscle elasticity. Pediatr Radiol, 2014, 44(2): 158-163.
[35] Kwon DR, Park GY, Lee SU, et al. Spastic cerebral palsy in children: dynamic sonoelastographic findings of medial gastrocnemius. Radiology, 2012, 263(3): 794-801.
[36] 沈雪勇. 经络腧穴学. 第2版. 北京: 北京中医药出版社, 2002: 291.
[37] Leong HT, Ng GY, Leung VY, et al. Quantitative estimation of muscle shear elastic modulus of the upper trapezius with supersonic shear imaging during arm positioning. PLoS One, 2013, 8(6): e67199.
[38] Kot BC, Zhang ZJ, Lee AW, et al. Elastic modulus of muscle and tendon with shear wave ultrasound elastography: variations with different technical settings. PLoS One, 2012, 7(8): e44348.
[39] Gennisson JL, Deffieux T, Macé E, et al. Viscoelastic and anisotropic mechanical properties of in vivo muscle tissue assessed by supersonic shear imaging. Ultrasound Med Biol, 2010, 36(5): 789-801.
[40] Maïsetti O, Hug F, Bouillard K, et al. Characterization of passive elastic properties of the human medial gastrocnemius muscle belly using supersonic shear imaging. J Biomech, 2012, 45(6): 978-984. [41] Miyamoto N, Hirata K, Kanehisa H, et al. Validity of measurement of shear modulus by ultrasound shear wave elastography in human pennate muscle. PLoS One, 2015, 10(4): e0124311.
【中图分类号】R445.1
【作者单位】上海中医药大学附属龙华医院 上海 200030
【通讯作者】肖沪生 E-mail: xhsx@sina.com
Doi:10.3969/j.issn.1005-5185.2016.03.024
【收稿日期】2015-08-23 【修回日期】2015-10-14 (本文编辑 张春辉)

