HP-β-CD降低油田地层水中SDBS胶束对其检测光谱的干扰
石东坡,尹先清,郑延成,陈 武,付家新,邹 华,任朝华
长江大学,油气资源与勘探技术教育部重点实验室,湖北 荆州 434023
HP-β-CD降低油田地层水中SDBS胶束对其检测光谱的干扰
石东坡,尹先清,郑延成,陈 武,付家新,邹 华,任朝华
长江大学,油气资源与勘探技术教育部重点实验室,湖北 荆州 434023
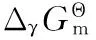
十二烷基苯磺酸钠; 羟丙基-β-环糊精; 胶束; 临界胶束浓度; 定量
引 言
十二烷基苯磺酸钠(SDBS)是三次采油过程中常用的表面活性剂之一,准确检测地层水中SDBS的含量是研究油藏动态渗流规律及评价驱油效率的重要方法[1-2],也为优化三采采出水的地面处理工艺提供参考依据。然而由于地层水组成极为复杂、干扰作用强[3],并且在三次采油过程中,所添加的各类驱油剂及地层水中的无机盐等组分还可能会显著降低SDBS的临界胶束浓度(cmc)[4-5],这些干扰因素导致地层水中SDBS的准确检测一直面临困难。
对于浓度较低、不能形成胶束的SDBS水溶液,适宜采用检测精度较高的光谱法[6-7]或色谱法[8-9]进行准确测定。对于干扰作用较弱的SDBS水溶液,可采用光谱法[10-11]、色谱法[12-13]、电导率法等[4]分别测定已知低浓度(浓度低于cmc)或高浓度(浓度高于cmc)的SDBS溶液的含量,再分别建立低浓度和高浓度两个不同阶段的定量标准曲线进行分析。然而,在可形成胶束、干扰作用较强的油田地层水体系中,SDBS胶束及各干扰物极有可能显著增加这些方法的检测误差[3]。鉴于此,本文在地层水中加入适量的羟丙基-β-环糊精(HP-β-CD),采用同步荧光光谱进行分析,通过HP-β-CD分子内腔的“包结”作用一方面降低了干扰物与SDBS之间的联系,另一方面利用SDBS分子优先与HP-β-CD分子形成包结物的特性,阻止了SDBS分子聚团形成胶束,达到同时降低胶束及干扰物对SDBS定量分析的干扰。与其他方法相比,本方法的检测准确性高,可适用于准确监测地层水中SDBS的含量,SDBS的回收率达100.5%~101.2%。
1 实验部分
1.1 试剂与仪器
十二烷基苯磺酸钠(SDBS),AR,江苏聚成精细化工有限公司; 羟丙基-β-环糊精,>98%,萨恩化学技术(上海)有限公司,经水重结晶两次,干燥,备用; Bruker-500 核磁共振谱仪,瑞士Bruker公司; NICOLET 6700型红外光谱仪,Thermo Scientific; LS-55型荧光分光光度计,美国PE公司。
采用Bruker-500 核磁共振谱仪进行1H-NMR分析时,均以D2O作为溶剂; 采用LS-55型荧光分光光度计进行同步荧光光谱分析时,扫描的波长差Δλ均为25 nm。
1.2 HP-β-CD与SDBS包结物的制备
称取1.541 5 g(1 mmol)HP-β-CD,80 ℃完全溶解于80 mL的蒸馏水中,再加入0.288 4 g(1 mmol)的SDBS,待完全溶解后在80 ℃恒温干燥得到白色的固体包结物。
2 结果与讨论
2.1 HP-β-CD对SDBS水溶液同步荧光光谱的激发效应
采用同步荧光光谱法测定了300.000 mg·L-1SDBS水溶液及加入等摩尔量HP-β-CD后SDBS水溶液的荧光光谱,如图1。
由图1可知,加入等摩尔量的HP-β-CD后,SDBS水溶液的荧光光谱显著增强,但是光谱曲线的变化趋势及最大发射波长均无明显变化。可见HP-β-CD具有增强SDBS荧光光谱强度的特性,表明了HP-β-CD与SDBS之间存在较强的相互作用关系,这种作用关系极有可能源于HP-β-CD包结SDBS并形成了“主-客体”包结物[14],包结物中SDBS受激发从而产生了的增强的荧光光谱[15]。另一方面,荧光的增强必然会提高检测的灵敏度,并能显著降低信噪比。

图1 SDBS(a)及加入等摩尔HP-β-CD 后SDBS(b)的同步荧光光谱图
2.2 HP-β-CD对SDBS临界胶束浓度的影响
当浓度超过临界胶束浓度(cmc)时,SDBS在水溶液中可形成胶束,但在HP-β-CD水溶液中,SDBS分子能否形成胶束还要取决于HP-β-CD对SDBS的包结能力,SDBS分子在形成包结物或胶束之间存在竞争关系。采用同步荧光光谱法测定了SDBS及其在HP-β-CD水溶液中的临界胶束浓度(cmc),见图2。
图2表示了在不同浓度的HP-β-CD水溶液中SDBS的荧光强度随质量浓度的变化趋势。在纯水中SDBS的cmc即为两条直线交点对应的浓度,由曲线a可知该值为442.680 mg·L-1,这一浓度与文献报道的结果十分吻合[4]。向SDBS溶液中加入HP-β-CD后,SDBS曲线的斜率变化趋势发生了两次改变,如图中曲线b,c,d,分别对应曲线b,c或d中的两个拐点,其中第二个拐点对应的浓度均大于SDBS在纯水中的cmc,且该值随HP-β-CD浓度的增加而增大,文献报道了环糊精或其衍生物具有增加表面活性剂cmc的能力[16],因此曲线b,c或d中第二个拐点对应的浓度应为SDBS在相应浓度的HP-β-CD水溶液中的cmc。曲线b,c或d中第二拐点和第一拐点之间的直线斜率,与曲线a中在浓度低于cmc时的直线斜率相当,表明了在该浓度范围内HP-β-CD对SDBS荧光强度的增幅无明显贡献; 此外,在曲线b,c或d中,当浓度小于第一拐点对应的浓度时,SDBS的荧光强度随其浓度的增加幅度明显大于其在纯水中的增幅。由此可以推测出HP-β-CD分子极有可能在水溶液中先与SDBS分子形成包结物,当SDBS浓度达到第一个拐点对应的浓度时,溶液中HP-β-CD分子已全部形成了包结物,继续增加SDBS的浓度,SDBS分子将不能继续形成包结物,即表现为与纯水中的荧光强度变化趋势一致。
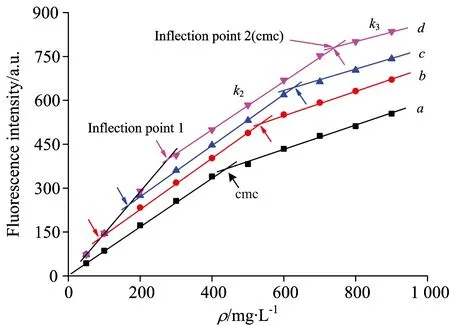
图2 在不同浓度的HP-β-CD水溶液中SDBS 荧光强度随质量浓度的变化曲线a: 0; b: 0.300 mmol·L-1;c: 0.500 mmol·L-1; d: 0.800 mmol·L-1
Fig.2 Plot of fluorescence intensisity versus mass concentration of SDBS in the presence of different concentrations of HP-β-CD
a: 0;b: 0.300 mmol·L-1;
c: 0.500 mmol·L-1;d: 0.800 mmol·L-1
通过计算SDBS在不同浓度的HP-β-CD水溶液中形成胶束的标准摩尔吉布斯函数[17],可对SDBS在水溶液中是否优先与HP-β-CD形成包结物作进一步分析,计算方法见式(1),结果见表1。
(1)
式(1)中R取8.314 Pa·m3·mol-1·K-1,T为热力学温度K,X为SDBS在HP-β-CD水溶液中临界胶束浓度的摩尔分数,α为SDBS胶束在HP-β-CD水溶液中的解离度,其数值等于图2中任一定量标准曲线在临界胶束浓度(第二拐点)前后两条直线的斜率k3和k2之比。

按照Junquera等[18]的研究结论,SDBS与HP-β-CD包结物的包结比可按式(2)计算,结果如表1。
(2)
式(2)中cmcCD为SDBS在HP-β-CD水溶液中的临界胶束浓度,cmc为SDBS在纯水中的临界胶束浓度,nCD为水溶液中HP-β-CD的物质的量浓度,N为SDBS与HP-β-CD包结物的包结比。

表1 HP-β-CD水溶液中SDBS在25 ℃时的热力学参数
从表1可以看出,HP-β-CD与SDBS形成的包结物的包结比介于0.936~1.091之间,表明了一个HP-β-CD分子空腔仅能容纳一个SDBS分子,即二者按照摩尔计量比1∶1进行包结,这一结论与文献的报道结果相当吻合[3]。
进一步与图2对比可以看出,SDBS与HP-β-CD包结物的包结比恰好等于SDBS曲线中(曲线b,c,d)第一拐点处SDBS与HP-β-CD的物质的量浓度之比(该浓度比时,二者恰好完全形成包结物),这与图2的分析结论一致。
2.3 HP-β-CD与SDBS包结物的包结比验证
采用Job’s法 (等摩尔连续变化法) 测定了SDBS与HP-β-CD包结物的摩尔计量比,对表1中计算出的包结比进行验证。
固定SDBS与HP-β-CD的总量为1.0 mmol·L-1不变,连续改变二者组分含量时溶液的荧光强度变化趋势如图3中曲线a。 由图1中曲线a可知,SDBS在纯水中也有一定的荧光强度,扣除SDBS在纯水中的荧光强度后,Job’s曲线b的最大值所对应的SDBS的摩尔分数为0.5,表明了SDBS与HP-β-CD包结物的摩尔计量比为确实为1∶1,验证了表1中包结比介于0.936~1.091之间的计算结果。

图3 SDBS与HP-β-CD包结物的Job’s曲线
2.4 HP-β-CD降低SDBS胶束对其定量的干扰验证
由前文分析可知,当溶液中有游离态的SDBS分子时,它将优先与HP-β-CD分子形成摩尔计量比为1∶1的包结物。因此,当水溶液中HP-β-CD物质的量浓度超过SDBS时,SDBS分子将全部以包结物的方式存在。
从图2还可以看出,在胶束区(SDBS的浓度大于cmc),HP-β-CD浓度的增加对直线的斜率无明显影响(见图2中b,c,d),由表1可知直线的斜率k3在0.374~0.388之间,根据王键吉等[17]的研究结果,这一现象表明了SDBS在形成包结物后,将不参与胶束的形成,即不会形成胶束。
鉴于此,为消除胶束对检测产生的干扰,在SDBS水溶液中按摩尔计量比1∶1加入HP-β-CD,建立SDBS的定量标准曲线,如图4。
从图2中曲线a可以看出,SDBS在纯水溶液中的cmc为442.680 mg·L-1,而图4表明,按摩尔计量比为1∶1加入HP-β-CD后,在0~700.000 mg·L-1范围内SDBS的荧光强度随质量浓度的增大呈线性增加,直线的相关性系数r达0.999 9,可见按摩尔计量比为1∶1加入HP-β-CD后,SDBS分子以包结物的方式均匀地分布在溶液中,SDBS在水溶液中已难以形成胶束。因此,可按照图4中的定量标准曲线对浓度大于cmc的SDBS溶液进行定量分析。
为了验证HP-β-CD在降低SDBS胶束干扰方面的效果,采用临盘采油厂部分站点地层水水样进行验证,地层水的水质分析结果见表2。再分别采用图2中曲线a及图4中的定量标准曲线计算地层水中SDBS的含量,分析结果见表3。

图4 按摩尔计量比为1∶1加入HP-β-CD 后SDBS的定量标准曲线
表3表明,基于纯水建立的SDBS定量标准曲线(图2a),不能准确检测T5-X15或T9-X4水样中SDBS的含量,当T5-X15(或T9-X4)水样中SDBS的含量为200.000 mg·L-1时(低于SDBS在纯水中cmc),回收率也仅为75.9%(或84.4%),表明了基于纯水建立的SDBS定量标准曲线的抗干扰能力较差,Na+和Cl-等无机离子对检测的干扰作用不能忽略。相比之下,在临盘采油厂T5-X15和T9-X4两种水样中,采用图4中的定量标准曲线可以准确检测低浓度(200.000 mg·L-1,低于其在纯水中cmc)或高浓度(600.000 mg·L-1,高于其在纯水中cmc)SDBS溶液的含量,方法的回收率在100.5%~101.2%之间,可见在SDBS溶液中加入摩尔计量比为1∶1的HP-β-CD,可以显著降低SDBS胶束及Na+和Cl-等无机离子对检测的干扰作用。

表2 临盘采油厂部分站点地层水水样分析
表3 SDBS在等摩尔量HP-β-CD水溶液中定量验证实验
Table 3 Synchronous fluorescence spectrum quantitative analysis of SDBS in the presence of the same molar concentration of HP-β-CD
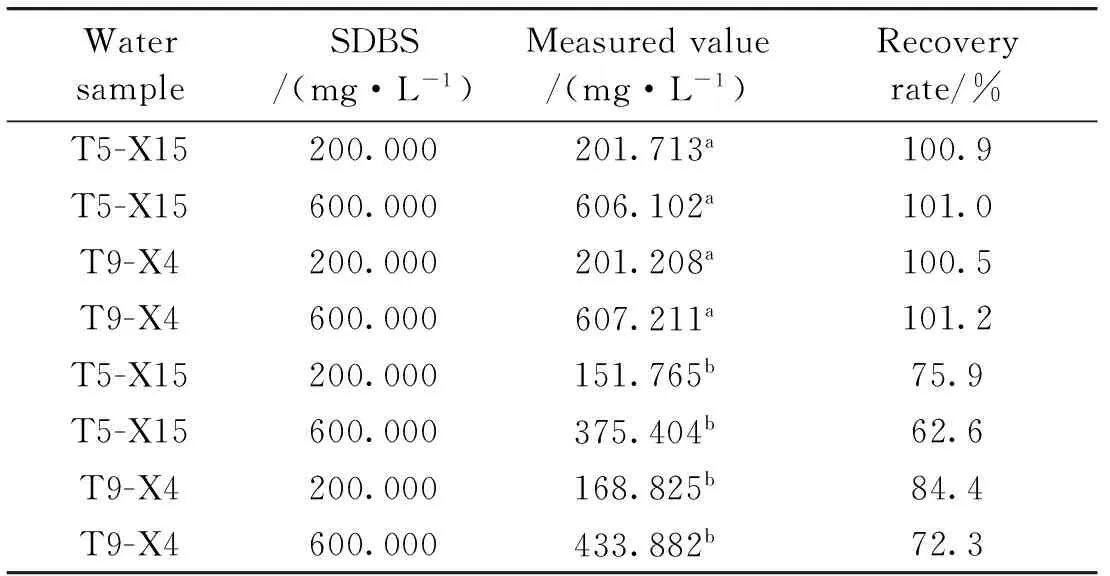
WatersampleSDBS/(mg·L-1)Measuredvalue/(mg·L-1)Recoveryrate/%T5-X15200.000201.713a100.9T5-X15600.000606.102a101.0T9-X4200.000201.208a100.5T9-X4600.000607.211a101.2T5-X15200.000151.765b75.9T5-X15600.000375.404b62.6T9-X4200.000168.825b84.4T9-X4600.000433.882b72.3
a: Calculated by standard curve in Fig. 4; b: Calculated by standard curve (a) in Fig. 2
2.5 HP-β-CD与SDBS形成包结物的键合模式
为了研究包结物中HP-β-CD与SDBS之间的键合模式,对HP-β-CD及其与SDBS包结物进行红外光谱分析和核磁氢谱分析,见图5,图6,图7。
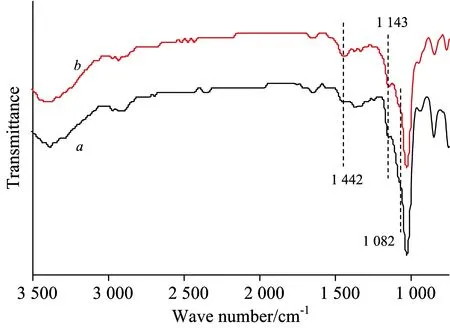
图5 HP-β-CD(a)及其与SDBS包结物(b)的IR光谱
图5表明,HP-β-CD在形成包结物后,1 082 cm-1处归属于其分子内部连接D-吡喃葡萄糖单元的C—O—C基团的弯曲振动峰强度有明显改变,可见SDBS分子已进入了HP-β-CD分子的内部。从图5还可以看出,HP-β-CD分子在1 143 cm-1处归属于小口径端—CH2OH基团的弯曲振动峰强度变化较小,而在1 442 cm-1处归属于HP-β-CD分子大口径端2、3—OH弯曲振动峰强度发生了较大变化,表明了在包结物中,SDBS分子中连接磺酸根的苯环基团可能主要位于HP-β-CD分子的大口径端[3]。

图6 HP-β-CD与SDBS包结物的1H-NMR谱图

图7 HP-β-CD与SDBS包结物的1H-NMR谱图
由图6和图7可以看出,HP-β-CD与SDBS形成包结物后,其分子1~6 H的化学位移值产生了一些变化,如表4。
从表4可以看出,HP-β-CD与SDBS形成包结物后,其分子外侧的1 H,2 H,4 H和6 H的化学位移值几乎没有发生变化,而位于HP-β-CD分子内部的3 H和5 H的化学位移值相对发生了较大变化,可见包结物中的SDBS基团位于HP-β-CD分子的内腔。进一步对比发现,HP-β-CD分子的3H较5 H的化学位移值变化更大,而3 H位置偏向HP-β-CD分子的大口径端,可见在包结物中,SDBS分子中苯环基团可能更靠近HP-β-CD分子的大口径端,这与图5的分析结果相印证。
表4 HP-β-CD及其与SDBS包结物中1~6 H的化学位移值
Table 41H-NMR chemical shift of HP-β-CD and the inclusion of HP-β-CD and its inclusion complex with SDBS

Sample1H2H3H4H5H6HHP-β-CD5.0813.5903.9453.4903.7293.869Inclusion5.0813.5913.9133.4913.7223.870

图8 HP-β-CD与SDBS包结物的可能结构图
综合以上分析结果可以推测出,SDBS与HP-β-CD按摩尔计量比1∶1进行包结,SDBS分子在HP-β-CD分子[HP-β-CD分子结构见图8(a)]中主要的存在方式如图8(b)所示。
3 结 论
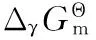
[1] Inceoglua O, Sablayrollesb C, Van Elsasa J D, et al. Applied Soil Ecology, 2013, 63: 78.
[2] Okada D Y, Delforno T P, Esteves A S, et al. Bioresource Technology, 2013, 128: 125.
[3] SHI Dong-po, YIN Xian-qing, ZHENG Yan-cheng, et al(石东坡, 尹先清, 郑延成, 等). Spectroscopy and Spectral Analysis(光谱学与光谱分析), 2014, 34(9): 2460.
[4] Ren Z H, Luo Y, Shi D P. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 428: 18.
[5] HUANG Zhen-jian, TAN Chun-hua, HUANG Xu-guang(黄振健, 谭春华, 黄旭光). Acta Physico-Chimica Sinica(物理化学学报), 2010, 26(5): 1271.
[6] Chen Z G, Peng Y R, Xie F, et al. International Journal of Environment Analytical Chemistry, 2010, 90(7): 573.
[7] Asok A K, Jisha M S. Water, Air, & Soil Pollution, 2012, 223(8): 5039.
[8] Síma J, Pazderník M, Tríska J, et al. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2013, 48(5): 559.
[9] Cantarero S, Camino-Sánchez F J, Zafra-Gómez A, et al. Marine Pollution Bulletin, 2012, 64 (3): 587.
[10] Devi S, Chattopadhyaya M C. Journal of Surfactants and Detergents, 2013, 16(3): 391.
[11] Lashermes G, Zhang Y, Houot S, et al. Journal of Environmental Quality, 2013, 42(2): 361.
[12] Hampel M, Mauffret A, Pazdro K, et al. Environmental Monitoring and Assessment, 2012, 184(10): 6013.
[13] Arvand M, Bozorgzadeh E, Shariati S, et al. Analytical Methods, 2012, 4(8): 2272.
[14] Louiz S, Labiadh H, Abderrahim R. Spectrochimica Acta Part A: Molecular & Biomolecular Spectroscopy, 2015, 134: 276.
[15] Mendes C, Buttchevitz A, Barison A, et al. Expert Review of Anti-Infective Therapy, 2015, 13 (1): 131.
[16] Bendazzoli C, Mileo E, Lucarini M, et al. Microchimica Acta, 2010, 171(1/2): 23.
[17] WANG Jian-ji, YANG Zhen-yu, YUE Yong-kui, et al(王键吉, 杨震宇, 岳永魁, 等). Acta Chimica Sinica(化学学报), 2003, 61(8): 1261.
[18] Junquera E, Tardajos G, Aicart E. Langmuir, 1993, 9: 1213.
(Received Apr. 24, 2015; accepted Aug. 15, 2015)
HP-β-CD Reduced the Interference of the Micellization on Spectrum Quantitative Analysis of SDBS in Oilfield Water
SHI Dong-po, YIN Xian-qing, ZHENG Yan-cheng, CHEN Wu, FU Jia-xin, ZOU Hua, REN Zhao-hua
Key Laboratory of Exploration Technologies for Oil and Gas Resources (Yangtze University), Jingzhou 434023, China

SDBS; HP-β-CD; Micelle; Critical micelle concentration; Quantitative analysis
2015-04-24,
2015-08-15
国家自然科学基金项目(41202111),湖北省自然科学基金资助项目(2015CFB189)和长江青年人才基金项目(2015cqr13)资助
石东坡, 1981年生,长江大学油气资源与勘探技术教育部重点实验室副教授 e-mail: shidongpo2006@126.com
O657.3
A
10.3964/j.issn.1000-0593(2016)06-1803-06
- 光谱学与光谱分析的其它文章
- 基于光声光谱联合主成分回归法的血糖浓度无损检测研究
- Structural, Morphological and Optical Properties of Well-Ordered CdO Nanostructures Synthesized by Easy-Economical Chemical Bath Deposition Technique
- Sensitivity Enhancement in Uranium Determination by UV-Visible Spectroscopy Using Ion Imprinted Polymer
- 采用小波分析方法降低可调谐半导体激光吸收光谱技术测量下限的实验研究
- 钠钾替代条件下不同基因型棉花叶片的FTIR光谱研究
- 近红外高光谱成像技术用于转基因大豆快速无损鉴别研究

