一种新型基底上右旋肉碱的表面增强拉曼光谱研究
程洪梅,周光明,李俊平,张彩红
发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715
一种新型基底上右旋肉碱的表面增强拉曼光谱研究
程洪梅,周光明*,李俊平,张彩红
发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆 400715
在聚乙烯吡咯烷酮(PVP)存在下,用多元醇还原硝酸银,Cu(NO3)2作为保护剂,快速有效的合成大量银纳米线,并优化了反应条件,得到结构均一、分散性较好的银纳米线。以罗丹明B为探针分子检测了该银纳米基底的表面增强效应,结果表明该基底对罗丹明 B 的表面增强效果明显,其表面增强因子可达6.4×105。文中利用这种基底得到了右旋肉碱的表面增强拉曼光谱(SERS),与其固体常规拉曼光谱(NRS)和10-3mol·L-1水溶液的拉曼光谱对比,并对各自的峰位进行了归属。右旋肉碱固体在3 100~2800和1 700~200 cm-1处有明显拉曼振动峰,在右旋肉碱的表面增强拉曼光谱中,1700~200 cm-1处的峰得到了明显的增强。经分析,右旋肉碱分子与银纳米基底呈180°。本文还用合成的纳米银基底得到了不同浓度右旋肉碱溶液的表面增强拉曼光谱,其最低检测浓度为10-6mol·L-1。右旋肉碱是一种重要的心血管药物,本文为其研究提供了较全面的拉曼光谱信息,为右旋肉碱的快速、特征、痕量监测提供了有力依据,也为进一步研究右旋肉碱的药理学提供了重要参考。
银纳米线; 新型基底; 拉曼光谱; 表面增强拉曼光谱; 右旋肉碱
引 言
肉碱有左旋(L型)和右旋(D 型)两种形式,其中L型具有生理活性,而D型则是竞争型抑制剂。右旋肉碱可用于心血管疾病、抗糖尿病药[1], 肉碱对缺血心肌的血流动力学影响极大,对心肌线粒体呼吸酶活性及膜系统有保护作用,此外,它还能减少自由基损伤[2-4]。Molfino Alessio等[5]研究发现,肉碱对于癌症的治疗也有一定的指导作用。目前对肉碱的检测方法已经有很多研究,如: 液相色谱-串联质谱法[1]、离子交换-反相高效液相色谱法[6]、水性液相色谱法[7]、毛细管电泳-串联质谱法[8-9]、衍生物测定法[10]、超高效反相液相色谱法-质谱法[11-12]等。其中大多数都是利用色谱法来测定右旋肉碱,而很少利用光谱法来鉴定右旋肉碱。本文利用光谱学中的拉曼光谱法来鉴定右旋肉碱,为右旋肉碱的药理学研究提供了重要的参考,右旋肉碱的分子优化结构见图1。
拉曼光谱能够提供分子的振动模式和各个基团的准确信息,是分析物质结构信息的有力工具。固体常规拉曼 (NRS) 的信号较弱,但是表面增强拉曼光谱(SERS)能够将拉曼信号增强到104~106倍,能够获得固体常规拉曼(NRS)中得不到的信息,二者结合能更好地对分子的结构进行全面分析[13-14]。

图1 右旋肉碱分子优化结构
表面增强拉曼光谱的基底主要是重金属的纳米粒子,例如纳米金、纳米银等,本文应用的银纳米线基底主要是在前人的基础上得到的新基底。近来,越来越多的人研究怎样快速有效的制备银纳米线。例如Zhang等[15]在硫化钠存在的条件下,用多元醇还原硝酸银制的单晶银纳米线,并成功用于检测农药福美双。Merve Selen Akin等[16]先通过金属辅助化学刻蚀法得到硅纳米线,再在硅纳米线上涂一层亚磷酸酯,将其浸泡于多巴胺溶液中,最后浸泡硝酸银溶液得到的银纳米线具有良好的表面增强效应。Ma等[17]用FeCl3防止银纳米被氧化,加速并促进多元醇还原硝酸银制得高品质的银纳米线,过量的Fe3+还可以用来优化银纳米线的结构。本文中制备银纳米线的方法就是在Cu(NO3)2做保护剂的前提下,利用多元醇还原硝酸银制的,并优化了反应条件,快速有效的合成了稳定的SERS基底。
1 实验部分
1.1 仪器与试剂
RFS-100/s型傅里叶变换拉曼光谱仪(德国Bruker公司),Nd∶YAG激光光源(1 064 nm),液氮冷却Ge检测器,激光强度分为100 mW(固态样品,扫描100次)和200 mW(液态样品,扫描200次),光谱分辨率为4 cm-1。日本日立S4800扫描电镜。实验所用硝酸银和右旋肉碱购自于阿拉丁公司,乙二醇、聚乙烯吡咯烷酮(PVP)、Cu(NO3)2.3H2O、氯化钠和乙醇均购自于成都市科龙化工试剂。所有试剂均为分析纯,实验用水为超纯水(18.2 MΩ)。
1.2 方法
根据Jingjing Ma等[17]的方法,配制40 mL 0.56 mol·L-1的PVP乙二醇溶液,油浴加热至160 ℃,向其入100 μL 0.05 mol·L-1Cu(NO3)2乙二醇溶液,5 min后加入100 μL 0.03 mmol·L-1NaCl乙二醇溶液,再加热5 min,以15 μL·s-1的速度加入0.15 mol·L-1AgNO3水溶液直到溶液变为灰色,将10 mL AgNO3溶液全部加入到混合液中,在160 ℃下油浴搅拌2 h。反应后混合液冷却至室温,用酒精洗涤3次,以4 000 r·min-1的转速离心20 min,最后用酒精稀释。将稀释后的纳米银与一系列浓度右旋肉碱溶液和10-6mol·L-1罗丹明溶液以纳米银与待测样品体积比为2∶1的比例制样,滴于干净玻璃片上,干燥后直接测定。本文还对实验条件进行优化,讨论了Ag+,Cl-,Cu2+浓度对合成基底的影响,其他实验条件参考文献[17]。
2 结果与讨论
2.1 罗丹明B在各条件下合成基底上的表面增强拉曼光谱对比
2.1.1 Ag+浓度的影响
为了研究Ag+浓度对基底的影响,本实验合成一系列Ag+浓度不同的银纳米线,将所合成的纳米银稀释至相同体积,按上述方法制样,用于测定拉曼光谱信号。图2(a)a1~d1分别是Ag+浓度为0.05,0.15,0.3,0.5 mol·L-1时得到RhB的SERS图谱,图2(b)为不同浓度Ag+合成银纳米线对RhB表面增强拉曼光谱的影响,可以看到,当Ag+浓度为0.05 mol·L-1,RhB的SERS峰不明显,而Ag+浓度较高时,我们可以看到明显的SERS峰,峰的位置相同,增强的程度不同,其中Ag+浓度为0.15 mol·L-1时增强效果最好,Ag+浓度过高或者过低都将使得合成的银纳米线基底的表面增强效应不理想。


图2 (a)不同浓度AgNO3合成银纳米线基底上罗丹明B的SERS; (b)不同浓度AgNO3合成银纳米基底对罗丹明B的SERS峰强度的影响
Fig.2 (a)SERS of RhB on silver nanowire synthesized with different concentrations of AgNO3; (b)Effect of different concentrations of silver nitrate on the SERS of RhB
(a1): 0.05 mol·L-1; (b1): 0.15 mol·L-1;
(c1): 0.3 mol·L-1; (d1): 0.5 mol·L-1
2.1.2 Cl-浓度的影响
本文同样考察了不同浓度 Cl-对合成基底的影响,保持其他反应物浓度和反应条件不变,讨论了 Cl-浓度从0~0.6 m mol·L-1时所合成基底对 RhB 拉曼信号的增强效应。同样按照纳米银与罗丹明B溶液体积比为2∶1的比例制样,图3(a)a2~e2中Cl-浓度分别为0,0.1,0.2,0.6,0.3 mmol·L-1,图3(b)为不同浓度Cl-合成银纳米线对RhB表面增强拉曼光谱的影响,从图中可以看出,Cl-浓度对纳米银基底的影响很大,当没有Cl-或者Cl-浓度过高或者过低时合成的基底表面增强效应都不明显,SERS峰强度很弱,Cl-浓度为0.3 mmol·L-1时所得到的SERS光谱明显比其他几组效果更好。

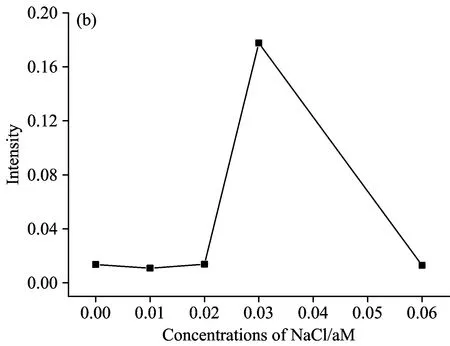
图3 (a)不同浓度NaCl合成银纳米线基底上罗丹明B的SERS; (b)不同浓度NaCl合成银纳米线基底对罗丹明B的SERS峰强度的影响
Fig.3 (a) SERS of RhB on silver nanowire synthesized with different concentrations of NaCl; (b) Effect of different concentrations of NaCl on the SERS of RhB
(a2): 0 mmol·L-1; (b2): 0.1 mmol·L-1; (c2): 0.2 mmol·L-1;
(d2): 0.6 mmol·L-1; (e2): 0.3 mmol·L-1
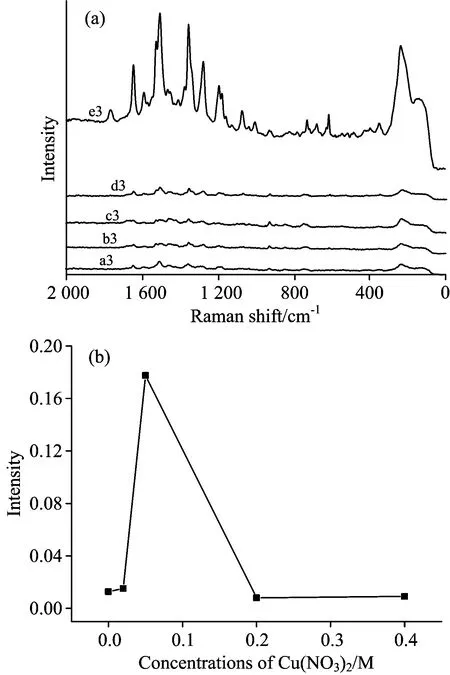
图4 (a)不同浓度Cu(NO3)2合成银纳米线基底上罗丹明B的SERS; (b)不同浓度Cu(NO3)2合成银纳米线基底对罗丹明B的SERS峰强度的影响
Fig.4 (a) SERS of RhB on silver nanowire synthesized with different concentrations of Cu(NO3)2; (b) Effect of different concentrations of Cu(NO3)2on the SERS of RhB
(a3): 0 mol·L-1; (b3): 0.02 mol·L-1; (c3): 0.2 mol·L-1; ;
(d3): 0.4 mol·L-1; (e3): 0.05 mol·L-1
2.1.3 Cu2+浓度的影响
在银纳米线的合成过程中,作为保护剂的试剂至关重要[18]。在本实验中,我们选用Cu(NO3)2作为保护剂,并且讨论了当Cu2+浓度从0~0.4 mol·L-1时,对合成银纳米线基底的影响。图4(a)a3~e3对应 Cu2+浓度分别为0,0.02,0.2,0.4,0.05 mol·L-1,图4(b)为不同浓度Cu2+合成银纳米线对RhB表面增强拉曼光谱的影响。从图中可以观察到,无Cu2+或者 Cu2+浓度偏高或者偏低得到的纳米银基底上RhB的SERS光谱峰不明显,基本是一条直线,而0.05 mol·L-1时得到了较好峰形的SERS光谱图。因此实验选用浓度为 0.15 mol·L-1AgNO3,0.3 mmol·L-1NaCl, 0.05 mol·L-1Cu(NO3)2来合成银纳米线。
2.2 罗丹明B的表面增强拉曼光谱分析
实验选用罗丹明B作为探针分子,将10-6mol·L-1罗丹明B溶液滴到干燥后的银纳米线玻璃片上,干燥后直接测定。图7为罗丹明B分子的表面增强拉曼光谱,从图中可以看到,在 1 648,1 592,1 508,1 358,1 280,1 197,1 077,933,735,684,621 cm-1处均有明显的表面增强拉曼信号,并且与文献[19]所报道的数据基本一致。Zhao等[20]合成的纳米金/石墨烯/纳米银复合材料基底对罗丹明B的增强因子达到1.6×108, Prezgot Danied等[21]合成立方纳米银对RhB增强因子为2.5×105。本实验合成的银纳米线是较好的表面增强拉曼基底,其增强因子可达6.4×105, 可应用于测定样品的表面增强拉曼光谱。
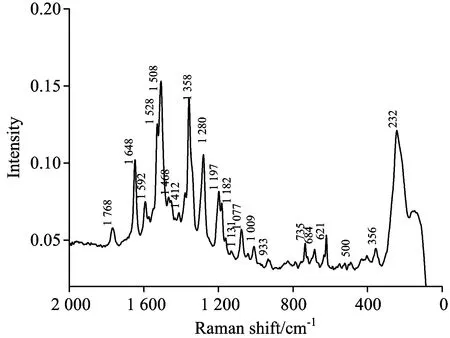
图5 罗丹明B的表面增强拉曼光谱
2.3 扫描电子显微镜(SEM)
将优化条件后合成的银纳米线滴于洁净的硅片上,干燥后在加速电压为30 kV的条件下扫描。图6是本实验合成银纳米线的SEM表征图片,从图6(a)中可以看到银纳米线呈均匀棒状,并且分散均匀,图6(b)是放大后的银纳米线,能够清晰的观察到银纳米线的形状以及少量的纳米颗粒,虽然有极少的颗粒状银纳米存在,但不影响银纳米线的增强效应。为讨论此方法合成的银纳米线的稳定性,我们将银纳米线放置1 h、一周和三个月后,以纳米银与罗丹明B溶液体积比为2∶1的比例制样,测得RhB的表面增强拉曼光谱图。图7为放置不同时间后银纳米线上RhB的SERS光谱图,其中a,b,c分别为放置1 h、一周和三个月后RhB的SERS光谱,从中可以看到放置一周、三个月后的SERS光谱基本没有变化,所以本实验方法可快速有效的合成银纳米线,而且放置长时间后不聚集仍可使用。

图6 银纳米线的扫描电镜图
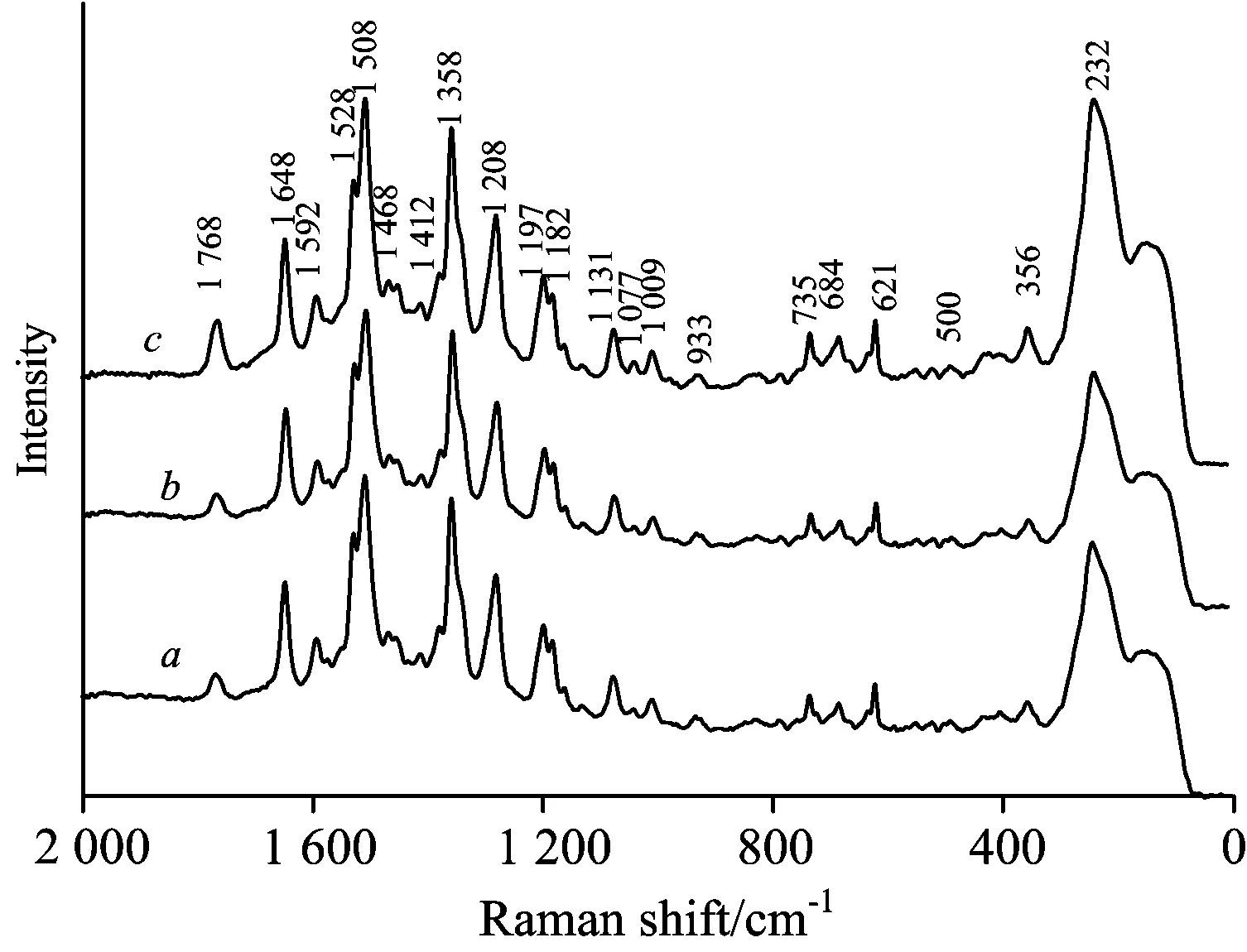
图7 放置不同时间后银纳米线上罗丹明B的SERSa: 1小时; b: 1星期; c: 1个月
2.4 右旋肉碱溶液的拉曼光谱、固体常规拉曼(NRS)与表面增强拉曼光谱(SERS)对比
右旋肉碱可溶于水和乙醇,实验配制一系列浓度右旋肉碱的水溶液,溶液与银纳米线按1∶2的比例制样测定。同时,也测定了10-3mol·L-1右旋肉碱水溶液的拉曼光谱,图8为右旋肉碱溶液拉曼光谱、固体常规拉曼(NRS)与表面增强拉曼光谱(SERS)的对比,其中a为右旋肉碱溶液的拉曼光谱,b为右旋肉碱的NRS,c为其SERS,d,e,f分别为将1 800~0 cm-1放大后右旋肉碱溶液的拉曼光谱、NRS和SERS。实验所得振动峰的归属,参考文献[20]所得结果列于表1。从图中可以看到,纯净右旋肉碱的固体常规拉曼信号较强,但是溶液中右旋肉碱的拉曼信号相当弱,甚至于成一条直线,没有基团的振动峰。而我们日常生活中需要检测的右旋肉碱样品大多是混合在其他样品中,或者是浓度非常低,所以发展一种可以检测低浓度肉碱的方法是非常有必要的。本文就是运用合成的新型基底来检测低浓度的右旋肉碱,实验结果表明,本试验方法能有效的检测右旋肉碱。

图8 右旋肉碱的固体常规拉曼光谱10-3mol·L-1水溶液的拉曼光谱以及表面增强拉曼光谱
a: 10-3mol·L-1水溶液的拉曼光谱;b: 右旋肉碱的固体常规拉曼;c: 右绽肉碱的表面增强拉曼;d: 1 800~0 cm-1处10-3mol·L-1水溶的常规拉曼;e: 1 800~0 cm-1处右旋肉碱的固体常规拉曼;f: 1 800~0 cm-1处右旋肉碱的SERS
Fig.8 The NRS, Raman spectroscopy of D-carnitine solution and SERS of D-Carnitine
a: Raman spectroscopy of D-carnitine solution;b: NRS;c: SERS;d: Enlarged Raman spectroscopy of D-carnitine solution;e: Enlarged SERS;f: Enlarged NRS
如图8所示,右旋肉碱的NRS在3 030 cm-1处有较强的吸收峰,归属于—CH2—的不对称伸缩振动,但是在SERS中这个峰出现在3 027 cm-1且强度很弱,基本消失了。与固体常规拉曼相同,SERS的最强锋出现在2 972 cm-1处,归属为—CH3的伸缩振动。对比a和b,可以看到,NRS中—CH3的伸缩振动还在2 955,2 918,2 820 cm-1处有峰,而在SERS中,2 955 cm-1处峰消失,2 918 cm-1处峰移至2 924 cm-1处,并且强度大大减弱。观察c和d, 将1 800~0 cm-1处放大后,我们可以看到NRS中1 586 cm-1处—COOH的非对称伸缩振动峰在SERS中分裂成了1 582,1 552,1 538 cm-1几处峰。—CH3的剪式振动在SERS中基本消失了,C—C和C—N的伸缩振动在SERS中得到了明显增强,并且在NRS中没有出现的—CH剪式振动也出现在SERS中。在NRS中 645 cm-1出现的骨架振动或者—COH变形振动的峰,SRES中分裂成了660,645,610 cm-1三个峰,而—C—C—C的扭曲振动出现在了SERS中。通过对比,我们从SERS可以得出在NRS中强度较弱的峰,并且可以分列出一些叠峰,NRS与SERS结合在一起就可以得出更详细、准确的拉曼光谱信息。

表1 右旋肉碱固体常规拉曼和表面增强拉曼的峰位归属
注:ν: 伸缩振动;σ: 剪式;ρ: 面内摇摆;τ: 扭曲振动;δ: 变形振动;s: 对称; as: 非对称; ph: 环
通过对右旋肉碱拉曼光谱信息的整理,C—N和C—C键的伸缩振动和—CH2—和C—H键的振动峰强度明显增强,根据SERS的选择定则,吸附分子的减振振动模式涉及分子极化率垂直与表面分量的变化时,该振动模式将在SERS谱中得以增强,因此右旋肉碱可能是通过C—N与银纳米线吸附的,右旋肉碱分子与银纳米基底呈180°。
本文还对不同浓度右旋肉碱的表面增强拉曼光谱进行分析,图9为右旋肉碱浓度从10-3~10-7mol·L-1的表面增强拉曼光谱图,从中可以观察到,当浓度为10-4mol·L-1时,1 082和763 cm-1处峰消失而970~890 cm-1处变成一个宽峰,在600 cm-1处出现一个较强的峰。浓度为10-5和10-6mol·L-1时,只出现了1 041和232 cm-1两处峰,当降至10-7mol·L-1时,完全观察不到拉曼峰,所以此基底对右旋肉碱的最低检测浓度为10-6mol·L-1。

图9 不同浓度右旋肉碱的表面增强拉曼光谱
a: 10-3mol·L-1;b: 10-4mol·L-1;c: 10-5mol·L-1;d: 10-6mol·L-1;e: 10-7mol·L-1
3 结 论
运用新的方法合成了银纳米线, 优化了反应条件并对其表征,发展了一种快速、大量合成银纳米线的方法,得到了稳定、有效的SERS基底。以Cu2+为保护剂,防止空气中的氧气氧化纳米银,而Cl-具有一定的刻蚀作用,从而得到稳定的银纳米线。将其应用于表面增强拉曼光谱的研究中,发现该纳米材料对罗丹明B的增强效果明显,应用于样品右旋肉碱也得到了较好的效果,所以新合成的纳米材料是一个良好的SERS基底。通过对右旋肉碱拉曼光谱的研究,建立了较全的右旋肉碱光谱信息,为右旋肉碱的快速、特征、痕量监测提供了有力依据,也为右旋肉碱的药理学研究提供了重要参考。
[1] Fang H, Wu Huiqin,Huang Xiaolan, et al. Chinese Journal of Analysis Laboratory, 2014, 33(9): 1101.
[2] Wong G K, Crawford M W. Anesthesiology, 2011, 114(6): 1417.
[3] Mohamed M, Sayed-Ahmed, Amal Q, et al. Oxidative Medicine and Cellular Longevity, 2010, 3(4): 266.
[4] Fatani Amal G, Darweesh Amal Q, Rizwan Lubna, et al. Chemotherapy, 2010, 56(1): 71.
[5] Molfino Alessio,Amabile Maria Ida,Monti Massimo,et al. International Journal of Cardiology, 2015, 1.
[6] Minkler Paul E,Stoll,et al. Analytical Chemistry, 2015, 87(17): 8994.
[7] Pesek Joseph J,Matyska Maria T. Journal of Chromatography A, 2015, 1401: 69.
[8] Sánchez-Hernández L, María Castro-Puyana, Carmen García-Ruiz, et al. Food Chemistry, 2010, 120: 921.
[9] Laura Sánchez-Hernández, Carmen García-Ruiz, Antonio L Crego, et al . Journal of Pharmaceutical and Biomedical Analysis, 2010, 53: 1217.
[10] Gu Shuhua, Li Qingyi, Wang Xuecheng. US Patent, 2014, US 8, 709, 819B2: 436.
[11] Zhao Longshan,Xiong Zhili,Lu Xiumei,et al. Plos One, 2015, 10: 6.
[12] Magiera Sylwia, Baranowski Jacek. Journal of Pharmaceutical and Biomedical Analysis, 2015, 109: 171.
[13] Hu Pingping, Liu Hui, Zhen Shujun, et al. Biosensors& Bioelectronics, 2015, 73: 228.
[14] Tian Shu, Zhou Qun, Li Chuanhong, et al. J. Phys. Chem. C, 2013, 117:556.
[15] Zhang Li, Wang Bin, Zhu Guang, et al. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 133: 411.
[16] Merve Selen Akin, a Mehmet Yilmaz, a Esra Babur, et al. J. Mater. Chem. B, 2014, 2: 4894.
[17] Ma Jingjing, Zhan Maosheng. RSC Adv., 2014, 4: 21060.
[18] Benjamin Wiley, Sun Yugang, Xia Younan. Langmuir, 2005, 21: 8077.
[19] Zhang T, Zhang L, Yang S, et al. Rare Metal Materials & Engineering, 2007, 36(10): 1844.
[20] Zhao Y, Li Y, Li X, et al. Nanoscale, 2014, 6(19): 11112.
[21] Prezgot Daniel, Lanoul Anatoli. Journal of Physical Chemistry C, 2015, 119(6): 3293.
(Received Apr. 27, 2015; accepted Aug. 15, 2015)
*Corresponding author
Surface Enhanced Raman Spectroscopy Study of D-Carnitine on a New Base
CHENG Hong-mei, ZHOU Guang-ming*, LI Jun-ping, ZHANG Cai-hong
Key Laboratory on Luminescence and Real-Time Analysis(Southwest University), Ministry of Education, School of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China
A fast and efficient way to synthesize a large number of silver nanowires was developed in this paper, in which the reaction conditions were optimized. Under the protection of Cu(NO3)2silver nitrate was reduced by polyol with polyvinyl pyrrolidone (PVP) in existence. The silver nanowires with uniform structure and good dispersion were obtained. Surface enhancement activity of the silver nanowires was detected by using RhB as a probe molecule,its surface enhancement factor can reach 6.4×105. The results showed that the nanowires significantly enhance the Raman spectroscopy of RhB. The normal Raman spectroscopy (NRS), Raman spectroscopy of D-carnitine solution and Surface enhanced Raman Spectroscopy of D-carnitine by means of the new base were obtained. There are obvious Raman peaks at 3 100~2 800 and 1 700~200 cm-1, and the peak of 1 700~200 cm-1in the surface enhanced Raman spectra of the D-carnitine can be obviously enhanced. The analysis showed that the angle between the molecular and silver nanoparticles were 180°. The vibrational peaks were assigned comprehensively. Compared with the NRS and SERS of D-carnitine, the detailed structural information of D-carnitine was obtained. In this paper, the surface enhanced Raman spectra of the D-carnitine absorbed on the synthesized silver nanoparticles were obtained, and the minimum detection concentration was 10-6mol·L-1. The new method can be a rapid and characteristic way to detect D-carnitine, and it will also provide an important guidance for the studies on pharmacology of D-carnitine.
Keywords Silver nanowire; New base; NRS; SERS; D-carnitine
2015-04-27,
2015-08-15
国家自然科学基金项目(21277110)资助
程洪梅,女,1992年生,西南大学化学化工学院硕士研究生 e-mail: 617614279@qq.com *通讯联系人 e-mail: gmzhou@swu.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)06-1755-06
- 光谱学与光谱分析的其它文章
- 基于光声光谱联合主成分回归法的血糖浓度无损检测研究
- Structural, Morphological and Optical Properties of Well-Ordered CdO Nanostructures Synthesized by Easy-Economical Chemical Bath Deposition Technique
- Sensitivity Enhancement in Uranium Determination by UV-Visible Spectroscopy Using Ion Imprinted Polymer
- 采用小波分析方法降低可调谐半导体激光吸收光谱技术测量下限的实验研究
- 钠钾替代条件下不同基因型棉花叶片的FTIR光谱研究
- 近红外高光谱成像技术用于转基因大豆快速无损鉴别研究

