拉曼光谱技术研究男性生殖生育
黄祖芳,曹 刚,孙 艳,杜生荣,李永增,
林居强1,冯尚源1,雷晋萍1
拉曼光谱技术研究男性生殖生育
黄祖芳1*,曹 刚1,孙 艳2,杜生荣2,李永增1,
林居强1,冯尚源1,雷晋萍1
1.福建师范大学,医学光电科学与技术教育部重点实验室,福建省光子技术重点实验室,福建 福州 350007 2.福建省妇幼保健院生殖研究室,福建 福州 350001
拉曼光谱通过记录光与物质作用时频率的改变,进而获得物质分子振动、转动信息,从而实现物质分子结构及其变化的检测。相比于常规生化检测分析方法,拉曼光谱技术具有无损、非标记检测及对检测样品要求低等优点。拉曼光谱技术已广泛应用于生物医学领域的研究,如人体组织、器官、细胞以及人体体液的各种疾病诊断、检测研究。本文主要综述了拉曼光谱技术在人体精液的研究进展,首先介绍了拉曼光谱技术(包含表面增强拉曼光谱)在法医学领域针对精液整体开展的研究及相关的数据处理方法,然后重点介绍拉曼光谱在男性生殖生育方面的研究,即分别介绍了可客观反映精液质量及男性生殖生育能力的基于精液(精浆)拉曼光谱的定性和定量检测分析;另外,介绍了基于显微拉曼光谱技术开展的单精子水平的精子质量的刻画和评估,以及目前研究初步获得的有望用于优质精子判别的拉曼光谱标记指标,最后展望了拉曼光谱技术在生殖生育领域的应用发展前景。
精子;精浆;拉曼光谱;表面增强拉曼散射(SERS);诊断检测;定量分析
引 言
精液是男性特征性的体液,包含细胞(精子)和非细胞(精浆)两部分,精液中精子占5%左右,其余为精浆。精浆主要含有果糖、蛋白质、多肽、以及糖类(如葡萄糖,果糖)、酶类(如前列腺素)、无机盐和有机小分子等。
以精液为对象的研究目前主要涉及法医学研究和男性生殖生育的研究。法医学中关于性犯罪现场的人体精液的证据收集及不同体液中痕量精液的无损、准确鉴别对于罪犯身份的确定有着至关重要的作用。精液法医学鉴定和男性生育能力的精液精子质量评估均涉及专业技术操作,往往需要进行DNA的分析鉴定,专业要求高,对样品检测存在有损操作;而男性生殖生育研究方面,开展精液(包含精子和精浆)的质量检测是目前男性生育能力的重要评估依据。目前临床精子精液检查主要包括精液常规分析、精子形态学染色分析、精子顶体反应分析、精子核DNA碎片分析、抗精子抗体(AsAb)检测、精浆生化分析等。精液的分析结果容易受射精频度,温度,实验条件,检验人员的技术熟练程度,主观判断能力等诸多因素影响,导致结果容易发生偏差,而精浆生化的分析检测存在操作步骤繁杂,检测耗时等问题。
拉曼光谱是基于拉曼散射效应的光谱技术,属于光的非弹性散射现象,通过记录光与物质作用过程中物质分子振动能级的改变,进而获得反映分子结构及成分特征性的光谱信息。相比于弹性散射,物质分子的拉曼散射效应通常很微弱,因而拉曼光谱技术的早期应用与发展受到很大的限制,随着光电检测技术的发展,常规拉曼光谱系统亦可获得强荧光背景干扰下的生物组织的拉曼光谱,如采用长波长的光激发,更好的干扰光过滤技术,更加灵敏的信号检测系统等。此外,值得一提的是,表面增强拉曼散射(SERS)技术,其通过测定吸附于粗糙金属表面的样品而实现拉曼信号的增强,克服常规拉曼散射截面小的缺点,进而提供更加丰富、灵敏的物质分子结构信息。目前,拉曼光谱技术已广泛应用于组织,细胞及生物分子水平的检测研究,成为生物医学领域的重要研究手段之一[1],显示出广阔的应用前景。近年拉曼光谱技术应用于人体体液的检测研究备受关注,其中,基于拉曼技术的体液成分含量检测[2],体液中“痕量”药物的分析检测[3-4],以及基于体液拉曼光谱的疾病检测诊断[5-8]等取得很好的进展,有望为临床生化检测和基于体液的人体疾病无损、快速诊断研究提供新方法,开拓新方向。
本文主要综述了拉曼光谱技术在精液(精液整体、精浆及精子)研究的情况,即拉曼光谱技术在法医学中精液来源的鉴定和区分,以及拉曼光谱技术在临床男性生殖生育的研究应用新进展,最后展望了基于拉曼光谱技术的精液研究的发展前景。
1 精液拉曼光谱分析在法医学检测方面的研究
拉曼光谱技术具备无损、不受水的干扰、可提供分析物“指纹”信息等优点,使其在法医学研究应用中扮演着重要的角色。2009年Kelly Virkler等[9]利用拉曼光谱测量比较了50例精液样品的拉曼光谱信号。分析比较发现不同的精液样品总体的拉曼谱峰、轮廓基本一致,样品间总体光谱轮廓上无明显差异。进一步通过显著因子分析法(SFA)和交替最小二乘法(ALS)的分析处理,发现干燥的精液主要包含酪氨酸,蛋白、胆碱及精胺等三个主要光谱成分。结合精液中主要物质的光谱特征峰对总体的平均谱进行拟合分析,以及拟合优度指标评估特征性数据与实验光谱的匹配度,发现精液拉曼光谱具有明显区别于血液和唾液拉曼光谱的特征,结合这些主要成分的光谱数据有望用于犯罪现场精液的确认与其他不同体液的区分。
法医学中犯罪现场的体液鉴别检测往往情况复杂,其中精液和血液的混合更为常见,因而容易对原本就痕量的精液检测结果造成严重干扰,2012年Vitali Sikirzhytski等[10]首先分别测量了血液、精液纯样品的拉曼光谱,并测量获得两者不同比例混合的拉曼光谱数据,结合SVMDA方法(支持矢量机判别)针对不同比例混合的精液、血液样品进行鉴别区分。初步实验结果表明,结合光谱数据分析处理,拉曼光谱检测方法可实现混合物中精液含量5%(甚至更低)的检测限,虽然结果的可靠性有待真实犯罪现场的进一步验证,但初步的实验结果显示出该方法有望推广应用于法医学中犯罪现场的精液检测,以及各种混杂体液的鉴别区分。
2 精液拉曼光谱在男性生殖生育方面的研究
2.1 精浆的拉曼光谱研究
精浆不仅是精子运输的载体,更是精子生长发育的“土壤”,因而精浆生化指标的检测对于精液、精子质量的评估,以及男性生育能力的诊断具有重要的指导意义。精浆中所含的果糖,柠檬酸等物质的测定可间接反映出精液中精子的活力和质量,成为男性生殖生育领域研究关注的热点。目前临床关于精浆中某种特定物质的生化检测已有成熟的试剂盒,然而这些测试存在操作繁琐、耗时、需专门技术人员等问题。寻找操作简便、快速的测量方法具有十分重要的意义。为此,作者本人首次结合精浆样品预处理和拉曼光谱方法开展精浆中柠檬酸的定量检测;即首先将精液样品进行离心获得精浆,然后采用截止蛋白为3 kDa的滤膜进一步过滤精浆中的大蛋白分子等,进而获得精浆超滤液;之后通过设置适当的激发功率进行精浆超滤液的拉曼光谱采集,通过记录柠檬酸的952 cm-1拉曼特征峰的强度值,并与柠檬酸标准检测试剂盒定量测量值进行比较,获得检测限为1.0 mg·mL-1的检测结果[11]。初步研究结果表明,在检测精度要求不高的前提下,该方法有望为精液中柠檬酸含量的定量提供检测新方法。此外,我们采用液滴涂层沉积拉曼(drop coating deposition Raman, DCDR)光谱技术针对精浆中的果糖开展定量检测研究,实验中利用“咖啡环效应”现象实现精浆滤液中果糖的富集,结合果糖的627cm-1特征峰,以标准浓度的果糖溶液为参考,通过强度比值获得精浆中果糖含量的定量检测,将拉曼方法的检测结果与果糖标准检测试剂盒的定量检测结果比较发现,该方法的检测相对误差为10.23%[12],虽实验设计有待于进一步的优化和提高,初步实验表明相比于果糖试剂盒检测方法,该方法具备操作快速、测量简单的优点。
男性不育往往是多因素共同作用的结果,针对单一成分的测定可能不足以客观、全面的评估男性生育能力。采用拉曼光谱技术针对精浆整体进行检测评估,可获得精浆中各种物质成分的综合拉曼光谱,有望为精浆质量评估提供全面、客观的数据信息。2011年本课题组利用拉曼技术测量精液中分离了精子后的精浆拉曼光谱,分析比较了正常和异常精液所对应的精浆的拉曼光谱;虽然两者在拉曼谱形上无明显的差异(如图1所示),通过差谱比较可明显发现归属于色氨基酸的1 449 cm-1谱峰与归属于脂质的1 418 cm-1谱峰存在着显著差异,结合主成分分析和线性判别分析法可获得较好的区分[13]。
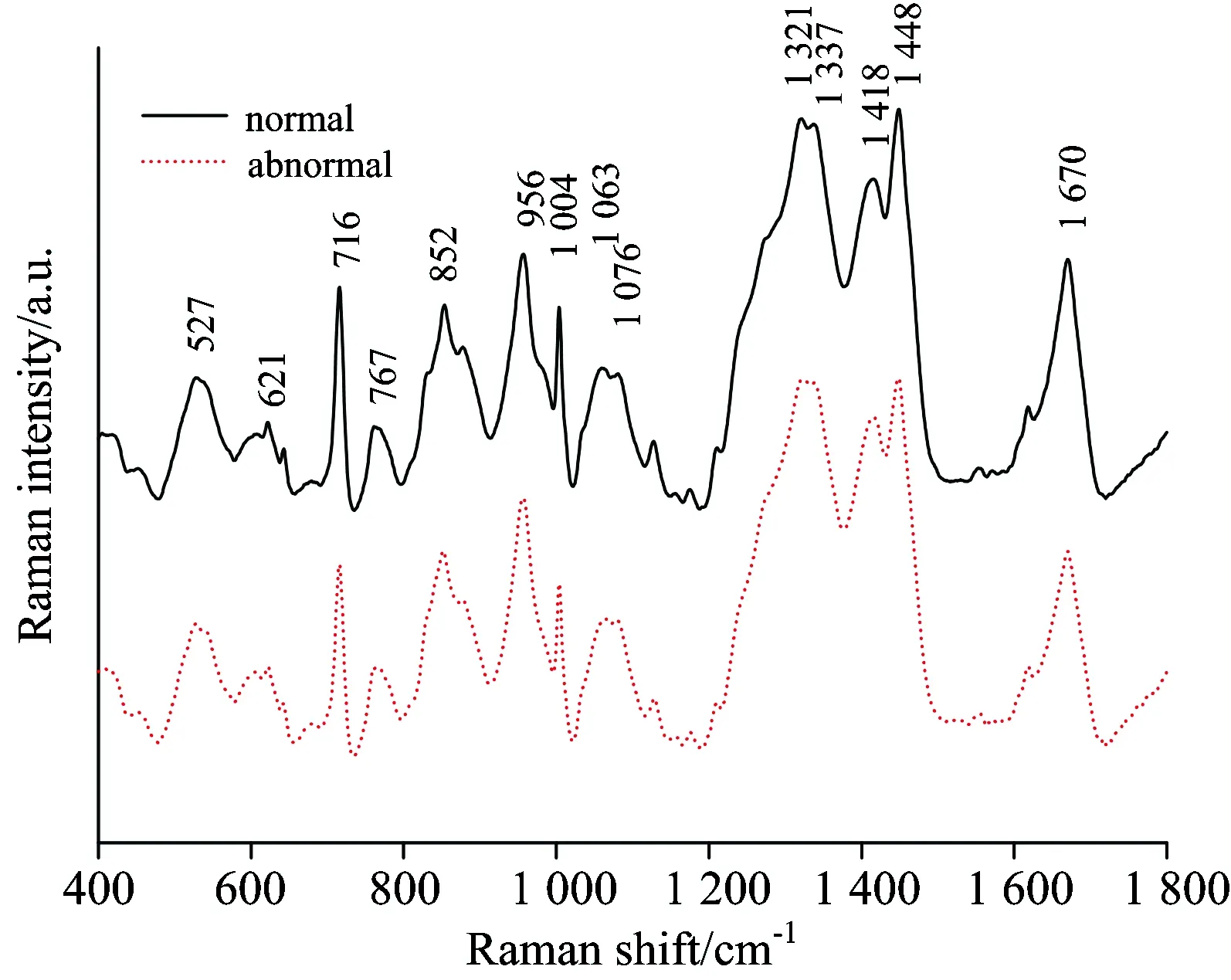
图1 正常和异常精浆光谱比较
此外,我们还利用了偏振-表面增强拉曼光谱的方法分析比较正常和异常精液的精浆偏振SERS光谱,相比于常规拉曼光谱,精浆SERS光谱具有很好的信噪比,丰富的谱峰信息。实验中我们对比正常,左旋和右旋圆偏振光激发下正常和异常精液中的精浆SERS光谱的差异(如图2所示),同样结合主成分分析等数据分析方法,对获得的精浆SERS光谱数据进行分析比较,结果发现在左旋偏振激发下可获得很好的区分[14]。
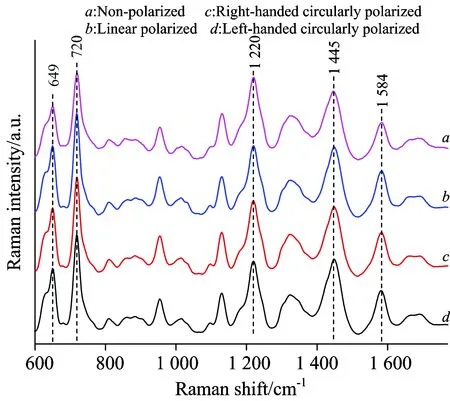
图2 不同偏振激发下的精浆SERS光谱比较,详见参考文献[14]
Fig.2 Comparison of SERS spectra from seminal plasma under different types of excitation, see Ref.[14] for detail
2.2 精子的拉曼光谱研究
精子是男性的生殖细胞,在男性生殖生育领域中精子形态是评估其质量的重要特征之一,研究表明不育男性精液中异常形态精子所占比例高,即使正常健康的个体,精液中形态异常精子约占精子总数的25%~40%。形态异常往往意味着功能异常,且精子形态异常与染色质结构异常有关[15-17]。基于普通光学显微镜的精子形态统计分析操作简便,但重复性和准确性不佳;高分辨成像法,如电镜技术,X射线成像,二次离子质谱仪等虽可实现精子高分辨率的结构成像分析,但存在样品制备要求高、测量时间长等问题;此外基于精子涂片的染色技术,如Diff-quick染色、瑞士-姬姆萨染色、巴氏染色等,虽可提供简单有效的精子形态染色评估,由于对精子样品的有损操作性,因而不具备应用于活体精子评估分析的可能。针对这些问题,Meister等提出采用显微拉曼光谱方法进行单个精子的刻画,即利用拉曼光谱成像的方法对精子进行整体的刻画,结合聚类分析方法,成功实现精子不同部位(头部,颈部,中段线粒体,尾部)的拉曼光谱成像,并初步评估不同剂量紫外光对精子细胞核、线粒体等部位的影响[18],实验中发现一定剂量的紫外光照射虽然对精子形态影响不大,但拉曼光谱中来源于线粒体的751 cm-1和来源于精子细胞核的788 cm-1两个谱峰发生明显的变化,结果表明基于显微拉曼光谱的精子评估,可无损获得单个精子的生化信息,为今后开展精子的无损、快速评估提供前期的可行性研究。Victoria等[19]以流式细胞计的精子DNA损伤分析结果作为参考,对200个精子的DNA进行拉曼光谱测量,将得到的拉曼光谱数据与流式细胞计的分析结果进行比较发现,拉曼谱峰中同样归属于DNA磷酸骨架的1 050和1 095 cm-1谱峰的强度比值(1 050/1 095)与精子DNA碎片指数成正比(如图3所示)。
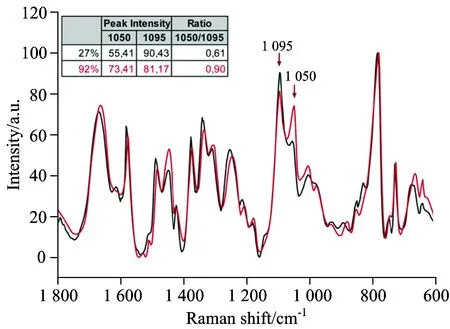
图3 DNA碎片指数为27%的未处理精子拉曼光谱(黑色)和碎片指数为92%的氧化损伤精子拉曼光谱(红色)的比较,详见参考文献[20]
Fig.3 Raman spectra of an untreated spermatozoon with 27% DFI (black) and of another after induced oxidative nDNA damage resulting in 92% DFI (red), see Ref.[20] for detail
即两个谱峰的比值越高,精子DNA损伤越严重,实验初步结果显示1 050和1 095 cm-1两个拉曼谱峰的比值有望作为拉曼光谱评估精子DNA损伤情况的无损、客观新标准。2013年,上海仁济医院Feng Liu等[20]比较了卵子透明带结合及未结合精子时的实时拉曼光谱,发现在800~900和3 200~4 000 cm-1两个波数范围内两者存在一定的强度差异,虽然测量获得的拉曼光谱的整体信噪比较低,结果提示该方法有望将来用于鉴别区分透明带结合和未结合的精子。2014年,我们小组提出结合图像处理与拉曼光谱分析的方法,初步获得确保形态和质量客观评估的正常精子的快速鉴别和筛选,有望用于今后临床开展的单精子水平的精子质量快速和客观评估[21]。
基于拉曼光谱的精子质量刻画和分析主要仍局限于非活动精子的测量,直接开展基于拉曼光谱检测的活动精子质量的评估还未见报道。为此我们小组初步开展了体外活动精子的显微拉曼光谱检测,通过与非活动精子的拉曼光谱的比较,发现两者的光谱整体差异较小;此外,实验还初步获得“正常”精子对应的特征拉曼光谱数据和评价指标,特别在活动精子的拉曼光谱中初步验证了谱峰中归属于磷酸骨架的1 050和1 095 cm-1的谱峰比值与精子DNA质量高度相关。初步的实验结果表明,基于显微拉曼系统的活体精子的拉曼光谱评估方法有望服务于生殖领域中优质活体精子的无损评估和筛选,进一步的实验结果还在完善和统计中。
3 结 论
拉曼光谱技术拥有其他光谱技术无法兼具的非标记、无损性、特异性高等综合优势,因而其在生物医学领域的应用研究备受关注。不论是犯罪现场的精液痕量检测鉴别,还是基于精液的男性生育能力的评估,拉曼光谱技术在这些领域的前期基础研究已显示出充分的可行性。应该指出的是,拉曼光谱技术在人体精液方面的研究还属于初步阶段,如在法医学鉴定应用领域还无法与现有的常规分析和DNA分析等手段相竞争,还有待于大量基础性及临床性的研究和验证工作的开展。拉曼光谱技术的进一步发展,如便携式拉曼光谱仪的普及与应用,高性能SERS基底的发展,以及拉曼光谱数据分析方法的优化,必将深化和发展法医学领域和男性生殖生育领域中精液的研究,同时有望将这些研究方法推广应用于女性的生殖生育研究领域,进而为人类的生殖生育诊断评估提供简便、可靠的新方法,更好的造福人类。
[1] YI Wei-song, JIANG Hou-min(易伟松,江厚敏).Acta Laser Biology Sinica(激光生物学报),2011, 20(2): 280.
[2] Rohleder D, Kiefer W, Petrich W.Analyst, 2004, 129(10): 906.
[3] Inscore F, Shende C, Sengupta A.Applied Spectroscopy, 2011, 65(9): 1004.
[4] Yuen C, Zheng W, Huang Z.Biosensors and Bioelectronics, 2010, 26(2): 580.
[5] Feng S, Lin D, Lin J.Analyst, 2013, 138(14): 3967.
[6] Li Y, Pan J, Chen G.Journal of Biomedical Optics, 2013, 18(2): 027003.
[7] Chen P, Tian Q, Baek S.Laser Physics Letters, 2011, 8(7): 547.
[8] Feng S, Chen R, Lin J.Biosensors and Bioelectronics, 2010, 25(11): 2414.
[9] Virkler K, Lednev I K.Forensic Science International, 2009, 193(1): 56.
[10] Sikirzhytski V, Sikirzhytskaya A, Lednev I K.Forensic Science International, 2012, 222(1): 259.
[11] Huang Z, Chen X, Li Y.Applied Spectroscopy, 2013, 67(7): 757.
[12] Huang Z, Wang J, Lin J.Journal of Raman Spectroscopy, 2014, 45(10): 879.
[13] Huang Z, Chen X, Chen Y.Journal of Biomedical Optics, 2011, 16(11): 110501.
[14] Chen X, Huang Z, Feng S.International Journal of Nanomedicine, 2012, 7: 6115.
[15] Belokopytova I A, Kostyleva E I, Tomilin A N.Molecular Reproduction and Development, 1993, 34(1): 53.
[16] Blanchard Y, Lescoat D, Lannou D.Andrologia, 1990, 22(6): 549.
[17] Bach O, Glander H J, Scholz G.Andrologia, 1990, 22(3): 217.
[18] Meister K, Schmidt D A, Bründermann E.Analyst, 2010, 135(6): 1370.
[19] Sánchez V, Redmann K, Wistuba J.Fertility and Sterility, 2012, 98(5): 1124.
[20] Liu F, Zhu Y, Liu Y.Fertility and Sterility, 2013, 99(3): 684.
[21] Huang Z, Chen G, Chen X.Journal of Biophotonics, 2014, 7(9): 671.
(Received Jun.11, 2015; accepted Nov.5, 2015)
*Corresponding author
Studies of Male Fertility with Raman Spectroscopy
HUANG Zu-fang1*, CAO Gang1, SUN Yan2, DU Sheng-rong2, LI Yong-zeng1, LIN Ju-qiang1, FENG Shang-yuan1,LEI Jin-ping1
1.Key Laboratory of OptoElectronic Science and Technology for Medicine of Ministry of Education, Fujian Provincial Key Laboratory of Photonics Technology, Fujian Normal University, Fuzhou 350007, China 2.Fujian Maternal and Child Health Hospital, Fuzhou 350001, China
Raman spectroscopy which belongs to scattering spectroscopy obtained molecular vibrational and rotational information to achieve detection and analysis of molecular structure and corresponding changes through recording the frequency shift when light interacted with materials.Compared with routine biochemical analysis, Raman spectroscopy has the advantage of non-invasive, label-free and no sample requirement.Raman spectroscopy has been widely applied in biomedical field such as human tissue, organs, cells and human body fluids for disease diagnosis.This article mainly focuses on recent research advances of Raman spectroscopy in human semen.Firstly, Raman spectroscopy(including surface-enhanced Raman spectroscopy, SERS) employed in forensic science for semen analysis, and some related data processing methods were introduced, then Raman spectroscopy involved investigations of male fertility was highlighted, more specifically, the Raman-based qualitative and quantitative analysis which assist the objective detection and evaluation of male fertility.Furthermore, studies of single sperm cell based on micro-Raman system to characterize and evaluate sperm quality and the preliminarily obtained Raman biomarkers which indicate high-quality sperm cell were introduced.Finally, the potential development of Raman spectroscopy involved in reproduction and fertility field was also discussed.
Spermatozoa; Seminal plasma; Raman spectroscopy; Surface-enhanced Raman spectroscopy; Diagnosis; Quantitative analysis
2015-06-11,
2015-11-05
国家自然科学基金项目(61308113, 61210016,11274065),福建省自然科学基金项目(2013J01225),教育部“长江学者和创新团队发展计划” 创新团队项目滚动支持计划项目(IRT_15R10)资助
黄祖芳,1981年生,福建师范大学助理研究员 e-mail: zfhuang@fjnu.edu.cn *通讯联系人 e-mail: zfhuang@fjnu.edu.cn
Q492
A
10.3964/j.issn.1000-0593(2016)09-2818-05

