美洲水貂刺鼠信号蛋白基因SNPs检测及其与毛色表型的关联分析
宋兴超,徐 超,刘宗岳,岳志刚,丛 波,刘琳玲,杨福合
(中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建国家重点实验室,长春 130112)
美洲水貂刺鼠信号蛋白基因SNPs检测及其与毛色表型的关联分析
宋兴超,徐超,刘宗岳,岳志刚,丛波,刘琳玲,杨福合*
(中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建国家重点实验室,长春 130112)
摘要:旨在检测刺鼠信号蛋白(Agouti signaling protein,Agouti)基因外显子2、内含子2、外显子3及部分内含子3的单核苷酸多态性(Single nucleotide polymorphisms,SNPs)在不同毛色美洲水貂群体中的分布,探讨该基因变异与水貂被毛颜色表型的相关性。以金州黑水貂、吉林白水貂、银蓝水貂、咖啡水貂和珍珠色水貂共计430个样本的血液基因组DNA为模板,采用PCR扩增和Sanger双脱氧链终止测序技术,对Agouti基因序列进行SNPs检测,并将突变位点与水貂毛色表型进行关联分析。结果表明,获得的美洲水貂Agouti基因长度为2 510 bp,内含子2存在4个SNPs:g.18G>A、g.159A>G、g.235G>T和g.1189C>T,部分内含子3检测到6个SNPs:g.252C>T、g.290A>C、g.298G>C、g.340A>G、g.343T>C和g.379T>C,在外显子2和3区域并未检测到SNPs位点。关联分析表明,Agouti基因7个SNPs(内含子2:g.1189C>T;内含子3:g.252C>T、g.290A>C、g.298G>C、g.340A>G、g.343T>C和g.379T>C)位点的基因型均与水貂毛色表型极显著相关(P<0.000 1),且部分内含子3中的5个SNPs位点(g.290A>C、g.298G>C、g.340A>G、g.343T>C和g.379T>C)可能处于紧密连锁状态。研究结果初步表明,Agouti基因可能是影响美洲水貂被毛颜色的候选基因或与决定毛色性状主效基因相连锁的分子标记。
关键词:美洲水貂;Agouti基因;毛色表型;单核苷酸多态性;关联分析
哺乳动物皮肤、被毛的颜色和鸟类的羽色是一种重要的质量性状,也是动物形态选择、品种归属识别及鉴定的重要依据之一[1]。野生美洲水貂(Neovisonvison)全身被毛一致,呈深褐色,在家养条件下称为标准貂,彩色水貂是深褐色标准貂的突变型,目前已出现30多个毛色突变基因(包括复等位基因),并通过各种组合,已增加至100余种[2]。彩色水貂皮色泽鲜艳、绚丽多彩,具有较高的经济价值,根据毛色可以分为黑色系、白色系、浅褐色系和灰蓝色系4大类[3]。水貂作为一种小型珍贵毛皮动物,其被毛颜色是决定貂皮质量及价值最重要的指标,培育出新颖美观的彩貂新品种是当前水貂的主要育种方向之一,应用分子生物学技术克隆水貂毛色相关基因,筛选与水貂被毛颜色表型相关的单核苷酸多态性(Single nucleotide polymorphisms,SNPs)位点,通过分子标记辅助选择(Marker assisted selection,MAS)可以加快彩貂良种的选育进度。
近年来,关于水貂毛色发生的分子遗传学机理研究备受关注。S.Cirera等[4]研究表明,银蓝水貂黑素亲和素(Melanophilin,MLPH)蛋白缺失肌动蛋白Va (MYO5A)结合域可导致稀释色型。R.Anistoroaei等[5]报道,酪氨酸酶(Tyrosinase)基因外显子1的错义突变(g.138T>A)可能与水貂的白化表型相关。宋兴超等[6]对美洲水貂黑色素皮质激素受体-1(Melanocortin-1 receptor,MC1R)基因完整编码区进行克隆及生物信息学分析。被毛颜色的形成主要受控于毛囊中黑色素细胞合成及分泌的真黑色素(Eumelanin)和褐黑色素(Pheomelanin)的比例及分布,是涉及多个基因与位点共同进行调控的复杂信号通路,该通路涉及黑色素细胞发育、黑色素小体形成与转运、黑色素合成与类型转变等生物学过程,其中,刺鼠信号蛋白(Agouti signal protein gene,Agouti)基因是参与调控大多数脊椎动物毛色性状的一个主效基因,该基因主要通过调控色素合成过程中真黑色素和褐黑色素之间的转换来控制毛色的发生[7]。Agouti基因外显子与非编码区突变对小鼠[8]、家猫[9]、山羊[10]和驴[11]毛色的影响机制已有相关报道。但是该基因对水貂毛色性状的调控方式还不清楚,因此,研究探讨Agouti基因变异与水貂毛色表型的相关性,对于进一步揭示水貂毛色形成的分子遗传学机制尤为重要。本研究以5个不同毛色水貂群体为研究对象,通过PCR扩增及Sanger双脱氧链终止测序技术对Agouti基因外显子2、内含子2、外显子3和部分内含子3区域进行SNPs位点检测,并对该基因突变位点与水貂毛色表型进行关联分析,旨在筛查与水貂被毛颜色相关的分子遗传标记,以期为深入研究Agouti基因调控水貂毛色性状的功能提供参考。
1材料与方法
1.1血液采集及基因组DNA提取
以2个培育品种和3个引进品种共计5种毛色表型430个样本为研究对象(图1)。其中培育品种包括金州黑水貂(图1A,JZH,120只)和吉林白水貂(图1B,JLB,86只),引进品种包括银蓝水貂(图1C,YL,95只),咖啡水貂(图1D,KF,86只)和珍珠色水貂(图1E,ZZ,43只)。样本取自大连名威貂业有限公司和中国农业科学院特产研究所毛皮动物试验基地7月龄左右、雄性家养美洲水貂血液,水貂取皮时用一次性无菌注射器心采血5.0 mL置于真空采血管中,参考文献[12]中酚-氯仿抽提法提取水貂血液基因组DNA,灭菌超纯水溶解,经琼脂糖凝胶电泳和紫外分光光度计检测完整性、含量及纯度,稀释为70 ng·μL-1,-20 ℃保存备用。
1.2主要试剂
DNA提取所用试剂购于天根生化科技(北京)有限公司,DL2000 DNA Marker、PCR产物纯化试剂盒、ExTaqDNA聚合酶和dNTPs均购自宝生物工程(大连)有限公司;琼脂糖购自Promega公司。

A.金州黑水貂;B.吉林白水貂;C.银蓝水貂;D.咖啡水貂;E.珍珠色水貂A.Jinzhou black mink;B.Jilin white mink;C.Silverblue mink;D.Coffee mink;E.Pearl mink图1 不同被毛颜色的美洲水貂Fig.1 Different coat color in American mink
1.3引物设计、PCR扩增及测序
因GenBank数据库中未公布美洲水貂Agouti基因序列信息,所以本研究以与水貂同属鼬科动物的雪貂(序列号:XM_004785317)Agouti基因mRNA序列作为参考,将该序列在Ensembl数据库中雪貂全基因组数据库进行检索,获得一段4 321 bp雪貂Agouti基因核苷酸序列,以该序列作为假定的美洲水貂Agouti基因,利用Primer Premier 5.0和Oligo 6.0软件筛选3对引物(表1),扩增水貂Agouti基因。引物序列由上海生工生物工程有限公司合成。
反应体系25 μL:ExTaqDNA 聚合酶(5 U·μL-1)0.25 μL,10×PCR Buffer(Mg2+Plus)2.5 μL,dNTPs 2.0 μL,模板DNA 1.0 μL(70 ng·μL-1),上、下游引物(10 pmol·μL-1)各1 μL,灭菌超纯水17.25 μL。反应循环参数:94 ℃预变性5 min;94 ℃变性30 s,Tm(表1)退火30 s,72 ℃延伸30~82 s(表1),35个循环;72 ℃延伸10 min;4 ℃保存。PCR产物经1.2%琼脂糖凝胶电泳检测,将目的片段经过切胶、回收纯化后,送上海生工生物工程有限公司进行双向测序。
表1扩增美洲水貂Agouti基因序列引物信息
Table 1Information of primer sequences for amplifying American minkAgoutigene

引物Primer序列(5'→3')Sequence退火温度/℃Tm延伸时间/sExtendedtime扩增区域AmplifiedregionAgouti-1F:CTATCGGAACACTTAGGAAATGGGTR:TTATTAAATTGGTGGTATACAGGGC57.530外显子2Agouti-2F:TTGGATTTCCCTTCTGTCTCTATTGR:TCTTCTTTTCCGCCTCTTTTCTACT60.282内含子2+外显子3Agouti-3F:GAAGCACTGAACAAGAAATCCAAAR:CCATCCAGGTAAAATCCACTAACA59.562部分内含子3
1.4数据分析
1.4.1SNPs位点识别与基因型判定利用BioEdit 7.0生物软件的ClustalW Multiple alignment程序对获得的美洲水貂Agouti基因序列进行比对,检测SNPs位点;通过测序峰图软件Chromas 5.0判定SNPs位点的基因型,单一峰为纯合基因型,套峰为杂合基因型。
1.4.2基因型、等位基因频率统计及SNPs位点与毛色性状关联分析采用Popgene 1.32软件计算基因型频率和等位基因频率,并利用SAS 9.2统计软件的χ2独立性检验程序进行SNPs位点基因型与毛色表型的关联分析(P<0.05表示差异显著,P<0.01为差异极显著)。
2结果
2.1Agouti基因PCR产物检测
利用设计引物(表1)进行水貂Agouti基因扩增,1.2%的琼脂糖凝胶电泳检测扩增产物(图2),3对引物均获得特异性的产物,Agouti-1引物扩增片段为494 bp(图2A),Agouti-2引物扩增片段为1 335 bp(图2B),Agouti-3引物扩增片段为1 032 bp(图2C),3个片段大小与预期设计扩增长度一致,单一无拖尾,表明引物特异性较好,适合进行测序分析。
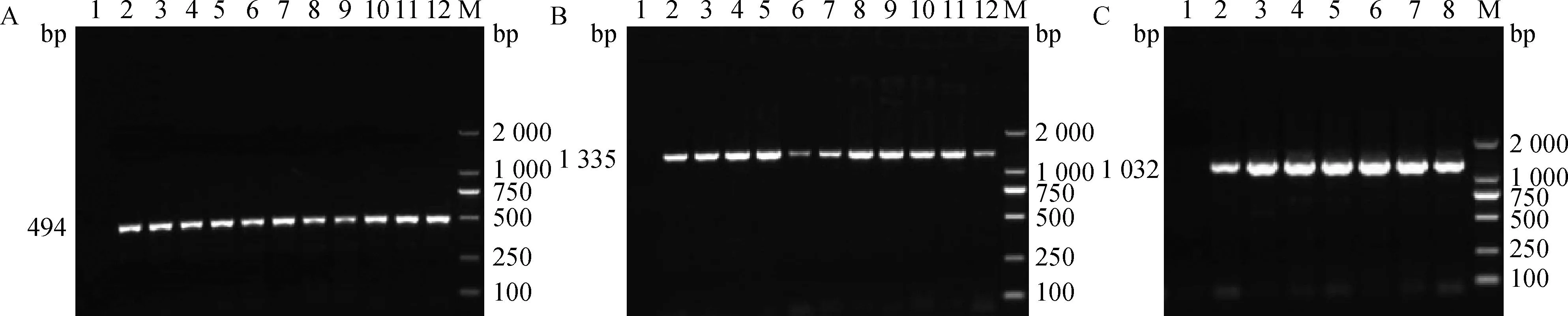
M.DNA相对分子质量标准;1.阴性对照;2~12.产物。A. Agouti-1;B. Agouti-2;C. Agouti-3M.DL2000 DNA marker;1.Negative control;2-12.The products of Agouti gene.A.Agouti-1;B.Agouti-2;C.Agouti-3图2 水貂Agouti基因3对引物PCR产物电泳Fig.2 Electrophoresis of the products of Agouti gene in mink from 3 pairs primers
2.2SNPs位点筛查及基因型判定
参照雪貂Agouti基因序列结构特征分析3对引物的测序结果,共获得美洲水貂Agouti基因2 510 bp核苷酸序列,其中外显子2、内含子2、外显子3和部分内含子3长度分别为160、1 256、62和967 bp(序列号KJ488543)。利用BioEdit 7.0软件中的ClustalW Multiple alignment程序对5个不同毛色水貂群体的测序结果进行比对,筛查SNPs位点,结合测序峰图判定每个位点的基因型。SNPs位点的命名原则:每个内含子的第1个起始碱基标记为“1”,在不同毛色水貂Agouti基因内含子2和3中,共检测到10个SNPs(图3和表2),外显子2和3区域均未检测到多态位点。内含子2中检测到4个SNPs,其中吉林白水貂、咖啡水貂和珍珠色水貂仅检测到3个位点发生变异:g.18G>A、g.159A>G和g.1189C>T,每个位点均包括3种基因型;金州黑水貂仅检测到1个变异位点:g.235G>T,包括2种基因型;银蓝貂这4个突变位点均存在。部分内含子3上,在不同毛色水貂群体间检测到6个SNPs:g.252C>T、g.290A>C、g.298G>C、g.340A>G、g.343T>C和g.379T>C,6个SNPs位点在5种毛色水貂群体中分别存在3种基因型。
2.3Agouti基因内含子2序列4个SNPs位点基因型及等位基因频率的分布
对获得的5个不同毛色品种的430只水貂Agouti基因内含子2序列进行分析,统计各毛色表型中4个SNPs的基因型和等位基因频率。由表3可见,在g.18G>A和g.159A>G位点上,5种不同毛色水貂中G和A等位基因频率均较高,为优势等位基因,其中金州黑水貂G和A等位基因的基因频率最高,均为1.000 0,即金州黑水貂群体在这2个位点未发生变异;在其它毛色品种中,这2个等位基因的分布大致相似。对于g.235G>T位点,仅在金州黑水貂和银蓝水貂群体间检测到变异位点,存在GG和TT两种基因型,然而,对于位点g.1189C>T,金州黑水貂、吉林白水貂、咖啡水貂和珍珠色水貂均存在CC、CT和TT 3种基因型,且CT基因型在吉林白水貂中为优势等位基因型,而银蓝水貂未检测到TT基因型。由此推测,g.1189C>T位点可能与吉林白水貂的白色被毛表型相关。
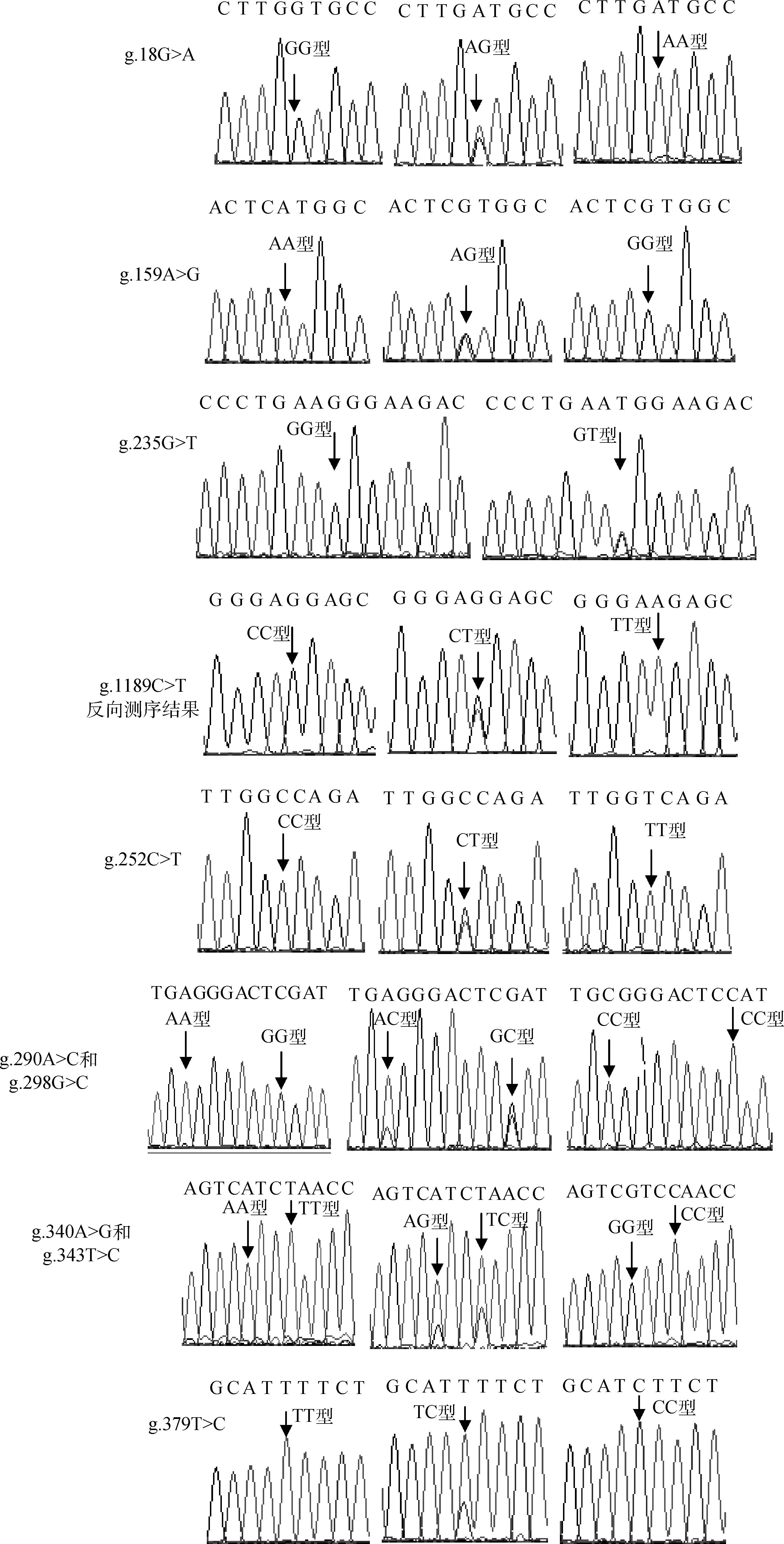
图3 美洲水貂Agouti基因SNPs位点测序Fig.3 Sequencing profiles of Agouti gene from American mink with different coat color
表2水貂Agouti基因10个SNPs的信息
Table 2The information of 10 SNPs in minkAgoutigene
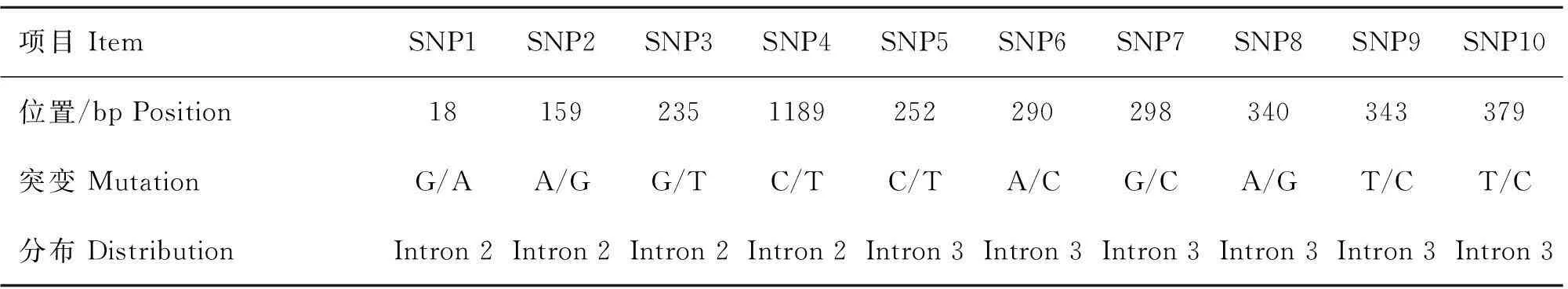
项目ItemSNP1SNP2SNP3SNP4SNP5SNP6SNP7SNP8SNP9SNP10位置/bpPosition181592351189252290298340343379突变MutationG/AA/GG/TC/TC/TA/CG/CA/GT/CT/C分布DistributionIntron2Intron2Intron2Intron2Intron3Intron3Intron3Intron3Intron3Intron3
表3Agouti基因内含子2序列4个SNPs在5个不同毛色水貂群体中的基因型与等位基因频率
Table 3Genotype and allele frequency of 4 SNPs forAgoutigene intron 2 in 5 coat color mink breeds
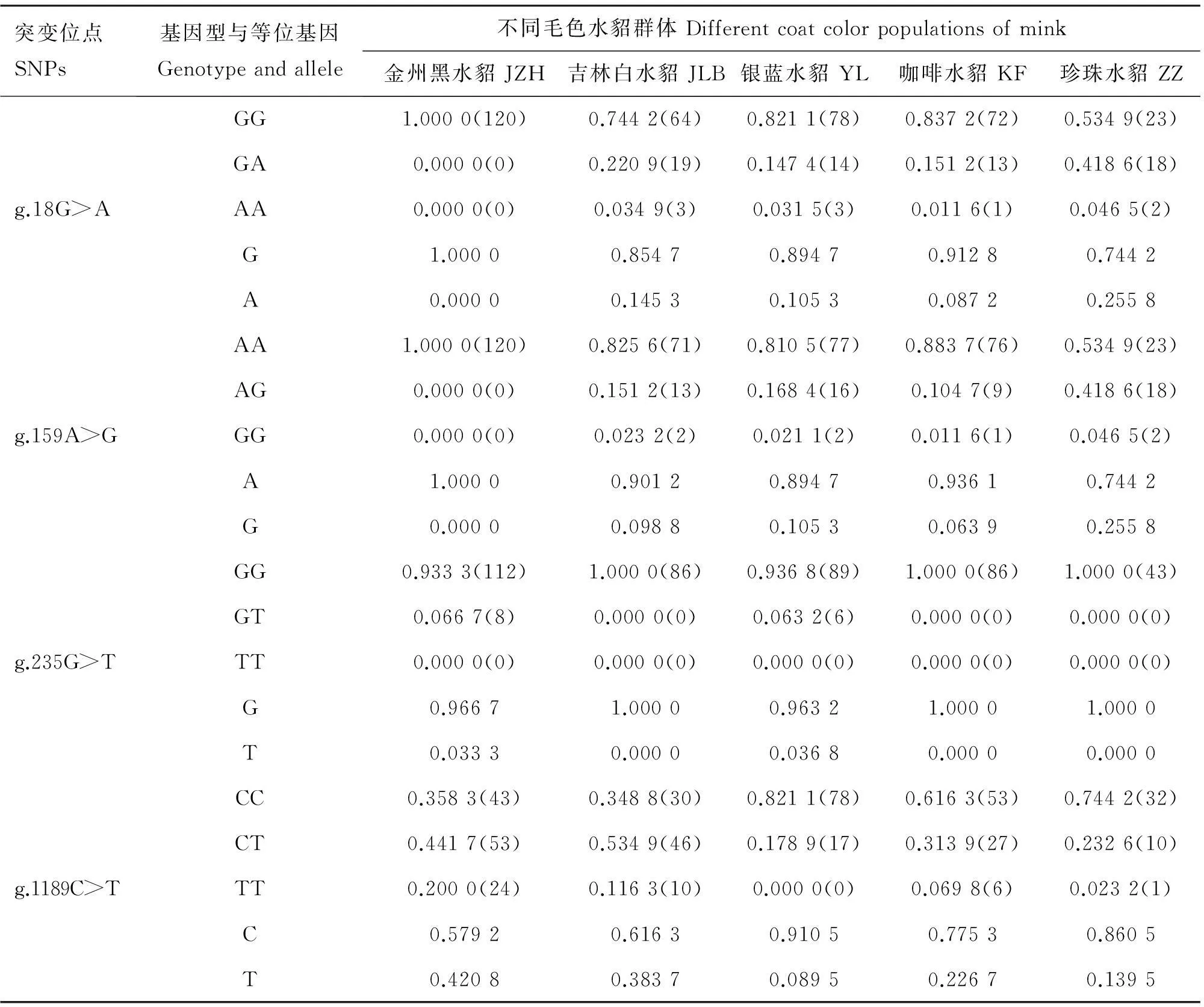
突变位点SNPs基因型与等位基因Genotypeandallele不同毛色水貂群体Differentcoatcolorpopulationsofmink金州黑水貂JZH吉林白水貂JLB银蓝水貂YL咖啡水貂KF珍珠水貂ZZg.18G>AGG1.0000(120)0.7442(64)0.8211(78)0.8372(72)0.5349(23)GA0.0000(0)0.2209(19)0.1474(14)0.1512(13)0.4186(18)AA0.0000(0)0.0349(3)0.0315(3)0.0116(1)0.0465(2)G1.00000.85470.89470.91280.7442A0.00000.14530.10530.08720.2558g.159A>GAA1.0000(120)0.8256(71)0.8105(77)0.8837(76)0.5349(23)AG0.0000(0)0.1512(13)0.1684(16)0.1047(9)0.4186(18)GG0.0000(0)0.0232(2)0.0211(2)0.0116(1)0.0465(2)A1.00000.90120.89470.93610.7442G0.00000.09880.10530.06390.2558g.235G>TGG0.9333(112)1.0000(86)0.9368(89)1.0000(86)1.0000(43)GT0.0667(8)0.0000(0)0.0632(6)0.0000(0)0.0000(0)TT0.0000(0)0.0000(0)0.0000(0)0.0000(0)0.0000(0)G0.96671.00000.96321.00001.0000T0.03330.00000.03680.00000.0000g.1189C>TCC0.3583(43)0.3488(30)0.8211(78)0.6163(53)0.7442(32)CT0.4417(53)0.5349(46)0.1789(17)0.3139(27)0.2326(10)TT0.2000(24)0.1163(10)0.0000(0)0.0698(6)0.0232(1)C0.57920.61630.91050.77530.8605T0.42080.38370.08950.22670.1395
括号内的数字为该基因型个体数。下表同
Figures in brackets are the individual number of the genotype.The same as below
2.4Agouti基因部分内含子3序列6个SNPs位点基因型及等位基因频率的分布
利用引物Agouti-3对5个不同毛色水貂品种的430个样本进行扩增,获得所有个体6个SNPs的基因型数据,并统计各群体各位点的基因型与等位基因频率(表4)。结果显示,5个水貂群体的6个位点均发生了突变。g.252C>T位点的C等位基因在5个毛色水貂群体中为优势等位基因,其中金州黑水貂群体突变率最低,等位基因T频率为0.222 2。除金州黑水貂品种外,g.290A>C位点的C等位基因在吉林白水貂、银蓝水貂、咖啡水貂和珍珠色水貂群体中为优势等位基因。g.298G>C、g.340A>G、g.343T>C和g.379T>C位点在各群体中等位基因频率与g.290A>C位点完全一致,初步推测,这5个变异位点在所有群体内可能处于紧密连锁状态,或者与控制水貂毛色表型的位点连锁。
表4Agouti基因内含子3序列6个SNPs在5个不同水貂毛色群体中的基因型与等位基因频率
Table 4Genotype and allele frequency of 6 SNPs forAgoutigene intron 3 in 5 coat color mink breeds
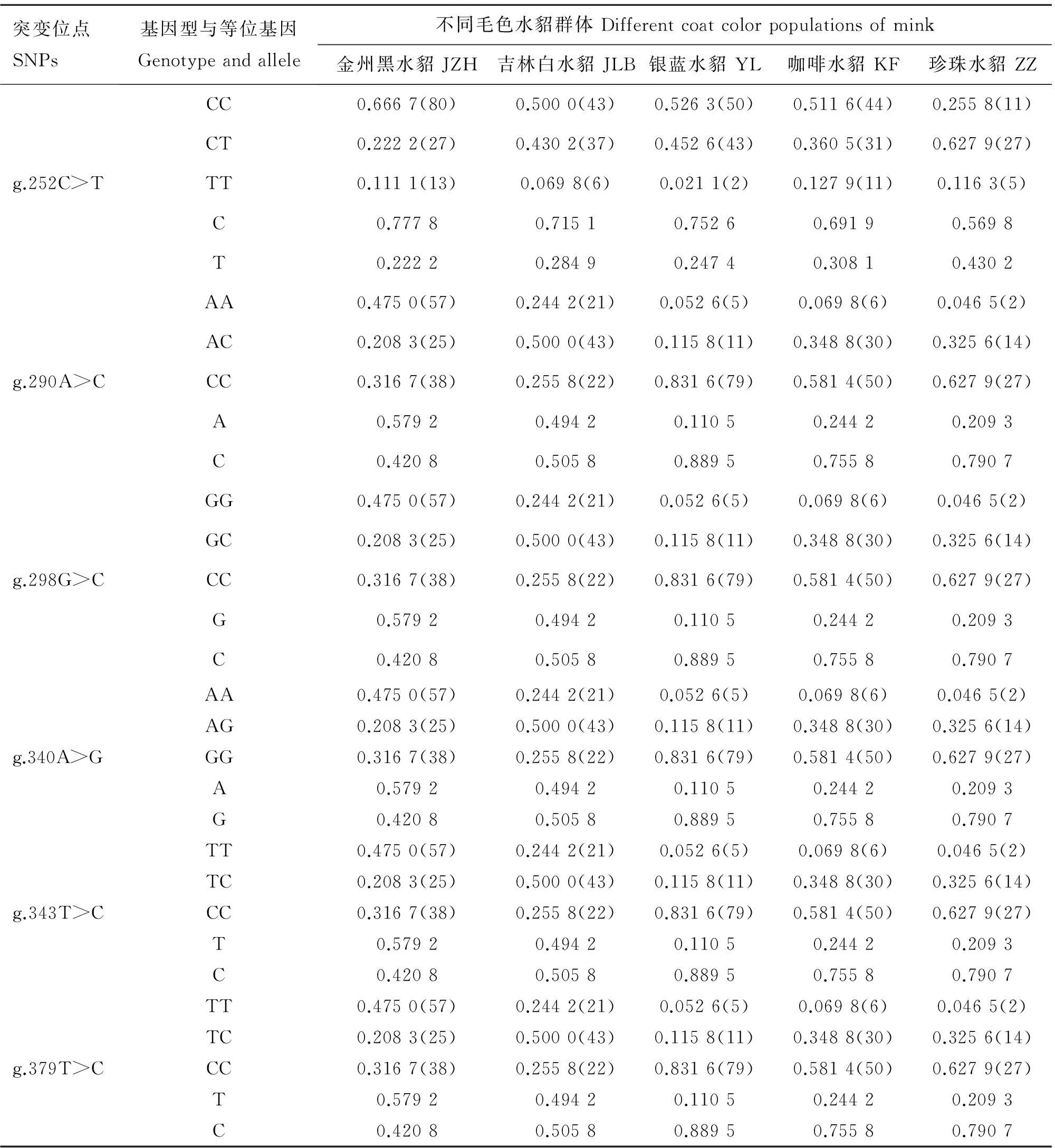
突变位点SNPs基因型与等位基因Genotypeandallele不同毛色水貂群体Differentcoatcolorpopulationsofmink金州黑水貂JZH吉林白水貂JLB银蓝水貂YL咖啡水貂KF珍珠水貂ZZg.252C>TCC0.6667(80)0.5000(43)0.5263(50)0.5116(44)0.2558(11)CT0.2222(27)0.4302(37)0.4526(43)0.3605(31)0.6279(27)TT0.1111(13)0.0698(6)0.0211(2)0.1279(11)0.1163(5)C0.77780.71510.75260.69190.5698T0.22220.28490.24740.30810.4302g.290A>CAA0.4750(57)0.2442(21)0.0526(5)0.0698(6)0.0465(2)AC0.2083(25)0.5000(43)0.1158(11)0.3488(30)0.3256(14)CC0.3167(38)0.2558(22)0.8316(79)0.5814(50)0.6279(27)A0.57920.49420.11050.24420.2093C0.42080.50580.88950.75580.7907g.298G>CGG0.4750(57)0.2442(21)0.0526(5)0.0698(6)0.0465(2)GC0.2083(25)0.5000(43)0.1158(11)0.3488(30)0.3256(14)CC0.3167(38)0.2558(22)0.8316(79)0.5814(50)0.6279(27)G0.57920.49420.11050.24420.2093C0.42080.50580.88950.75580.7907g.340A>GAA0.4750(57)0.2442(21)0.0526(5)0.0698(6)0.0465(2)AG0.2083(25)0.5000(43)0.1158(11)0.3488(30)0.3256(14)GG0.3167(38)0.2558(22)0.8316(79)0.5814(50)0.6279(27)A0.57920.49420.11050.24420.2093G0.42080.50580.88950.75580.7907g.343T>CTT0.4750(57)0.2442(21)0.0526(5)0.0698(6)0.0465(2)TC0.2083(25)0.5000(43)0.1158(11)0.3488(30)0.3256(14)CC0.3167(38)0.2558(22)0.8316(79)0.5814(50)0.6279(27)T0.57920.49420.11050.24420.2093C0.42080.50580.88950.75580.7907g.379T>CTT0.4750(57)0.2442(21)0.0526(5)0.0698(6)0.0465(2)TC0.2083(25)0.5000(43)0.1158(11)0.3488(30)0.3256(14)CC0.3167(38)0.2558(22)0.8316(79)0.5814(50)0.6279(27)T0.57920.49420.11050.24420.2093C0.42080.50580.88950.75580.7907
2.5Agouti基因SNPs位点与水貂毛色表型的关联分析
根据筛查到SNPs位点所形成的不同基因型及其在不同毛色群体中频率的差异,由于个别毛色群体在g.18G>A、g.159A>G和g.235G>T位点处的基因型数量<5,不具有统计学意义,且位点g.290A>C与g.298G>C、g.340A>G、g.343T>C、g.343T>C的等位基因频率完全一致,因此选取3个SNPs,即g.1189C>T、g.252C>T、g.290A>C,分别进行卡方独立性检验(表5),分析各位点基因型与毛色表型的相关性。结果表明,内含子2中1 189位、内含子3中252位、290位各基因型在不同毛色群体中差异极显著(P<0.000 1),另外,由于内含子3中g.298G>C、g.340A>G、g.343T>C和g.379T>C可能与g.290A>C位点处于紧密连锁状态,因此,笔者推测g.1189C>T、g.252C>T、g.290A>C、g.298G>C、g.340A>G、g.343T>C和g.379T>C位点均可能与水貂毛色表型存在一定的相关性。
表5Agouti基因SNPs位点的各基因型分布及其与毛色的关联分析
Table 5Association between genotype ofAgoutigene SNPs and coat color phenotype
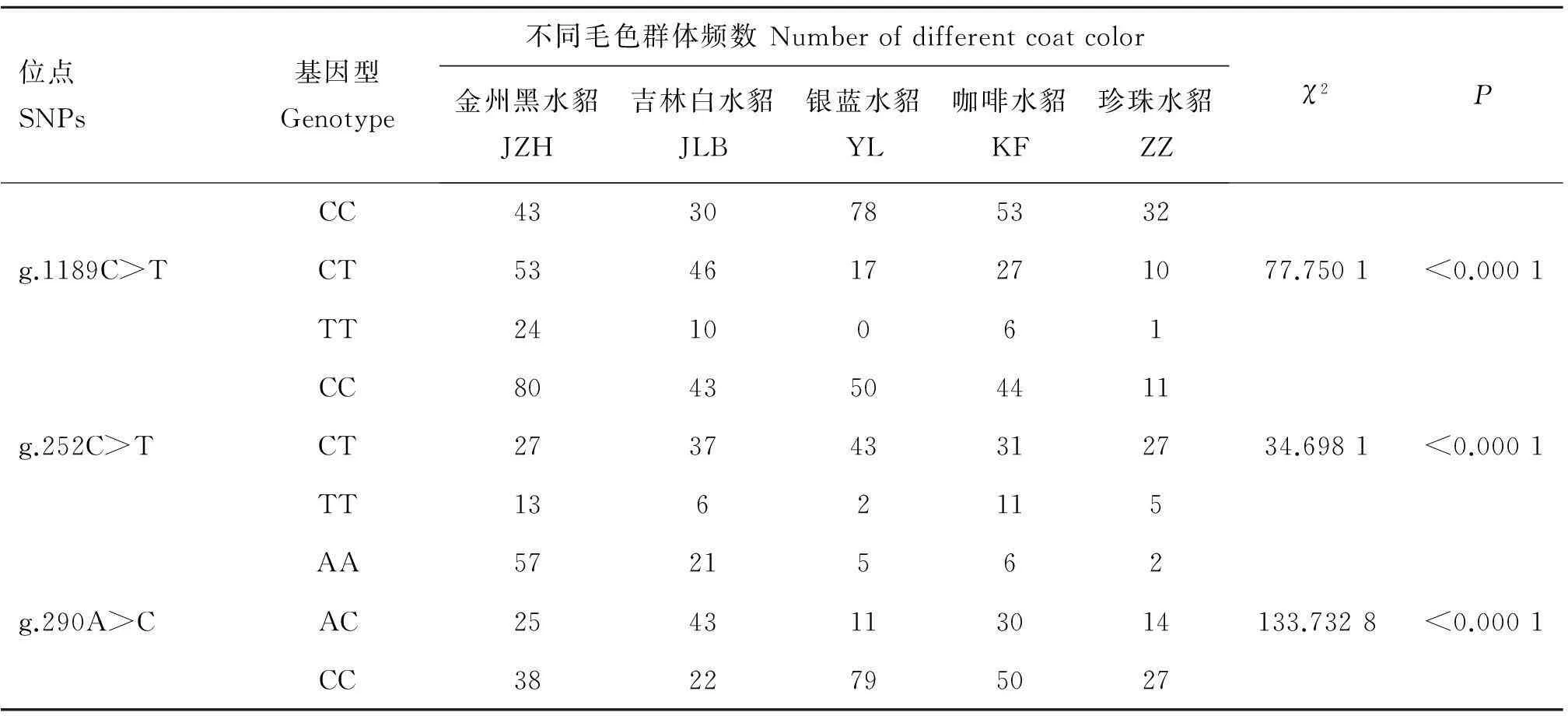
位点SNPs基因型Genotype不同毛色群体频数Numberofdifferentcoatcolor金州黑水貂JZH吉林白水貂JLB银蓝水貂YL咖啡水貂KF珍珠水貂ZZχ2PCC4330785332g.1189C>TCT534617271077.7501<0.0001TT2410061CC8043504411g.252C>TCT273743312734.6981<0.0001TT1362115AA5721562g.290A>CAC2543113014133.7328<0.0001CC3822795027
3讨论
随着测序成本的逐渐下降,在所有SNPs的检测方法中,对欲检测片段进行扩增、直接测序是最为准确的方法,该方法主要用于SNPs位点的检测及分型,通常情况下,纯合型SNPs位点的测序峰图为单一峰型,而杂合型SNPs位点的测序峰为套峰,因而很容易将其区分,通过直接测序方法进行SNPs筛查的检出率接近100%[13]。本试验采用PCR产物直接测序技术,对5个不同毛色水貂群体Agouti基因进行了单核苷酸多态性检测,在内含子2和部分内含子3区域共检测到10个SNPs位点。与非翻译区相比,5个毛色水貂群体Agouti基因外显子2和3未检测到变异位点,这与M.Girardot等[14]在牛上和X.L.Li等[15]在山羊中的研究结果一致。J.Voisey等[16]也未检测到人Agouti基因外显子2和3具有多态性。初步推断,Agouti基因外显子2和3在所选取的水貂样本中相对保守,应进一步增加样本量或检测更多的毛色类型个体,同时筛查其他外显子区域以确保水貂Agouti基因编码区是否存在与毛色表型相关的遗传标记位点。
在内含子2所检测到的4个SNPs位点中,g.18G>A和g.159A>G位点仅存在于吉林白水貂、银蓝水貂、咖啡水貂和珍珠色水貂群体中,且GG和AA为优势基因型,但是金州黑水貂群体中未见这两个变异位点。g.235G>T位点仅在金州黑和银蓝水貂群体中存在少量GT基因型,因此推测这3个SNPs位点与水貂的毛色表型关系不大,可能是在个体自然进化或品种选育过程中产生的稀有变异碱基。关于g.1189C>T位点,CT基因型在白色水貂群体频率最高,且经卡方独立性检验表明,该位点形成的基因型与水貂毛色表型极显著相关(P<0.000 1),所以g.1189C>T位点的CT基因型可能与美洲水貂的白色被毛性状存在关联,该位点或者是控制水貂白色被毛表型的主控位点,或者是与控制水貂白色表型的位点存在连锁关系,需要进一步试验验证。部分内含子3中的g.252C>T位点形成的CT基因型在珍珠色水貂群体中的频率最高(0.627 9),CT基因型可能与珍珠色水貂的毛色相关。g.290A>C、g.298G>C、g.340A>G、g.343T>C和g.379T>C位点的突变纯合子基因型频率(0.831 6)在银蓝水貂群体中的频率最高,与银蓝水貂的灰蓝色被毛表型存在关联(P<0.000 1),也可能与控制银蓝水貂毛色表型的位点存在连锁关系。
本研究检测到的水貂Agouti基因7个SNPs位点中,内含子2中与白色表型相关的g.1189C>T、内含子3中与珍珠色表型相关的g.252C>T位点以及与银蓝色表型相关的g.290A>C、g.298G>C、g.340A>G、g.343T>C和g.379T>C位点可能与某个等位基因连锁,从而表现出不同的基因型,对应不同的毛色表型。前人研究证实,Agouti基因表达的ASIP蛋白与α-MSH竞争性结合MC1R,进一步导致真黑色素合成数量减少,生成浅色被毛[17]。根据彩貂毛色遗传基因型可知[3],吉林白水貂(基因型:bbcc)和珍珠色水貂(基因型:ppkk)都属于两对纯合隐性基因组合色型,银蓝水貂的基因型为pp,这3种毛色均为浅色表型,与Agouti基因表达的ASIP蛋白拮抗α-MSH与MC1R相结合的理论相符。尽管本试验检测的SNPs存在于内含子中,但有研究表明Agouti基因内含子的变异可以导致其编码mRNA存在不同的剪接体,通过修复蛋白合成而影响相应蛋白的调控功能[18]。
4结论
本研究对美洲水貂Agouti基因的SNPs进行检测并分析了内含子2和3中的10个SNPs与水貂毛色性状的相关性,发现7个SNPs位点与水貂浅色被毛表型存在关联。该结果提示,Agouti基因可作为影响美洲水貂被毛颜色的主效候选基因或与决定毛色性状的主效基因连锁的分子遗传标记,为解析Agouti基因调控水貂毛色性状的分子遗传学机制奠定基础。
参考文献(References):
[1]李宁,方美英.家养动物驯化与品种培育[M].北京:科学出版社,2012.
LI N,FANG M Y.Animal domestication and breed development[M].Beijing:Science Press,2012.(in Chinese)
[2]佟煜仁,张志明.图说毛皮动物毛色遗传及繁育新技术[M].北京:金盾出版社,2009:18-27.
TONG Y R,ZHANG Z M.Figure for coat color genetics and new reproductive technology of fur animals[M].Beijing:Jindun Publishing House,2009:18-27.(in Chinese)
[3]华盛,华树芳.毛皮动物高效健康养殖关键技术[M].北京:化学工业出版社,2009:2-8.
HUA S,HUA S F.The key technologies for efficient and healthy farming in fur animal[M].Beijing:Chemical Industry Press,2009:2-8.(in Chinese)
[4]CIRERA S,MARKAKIS M N,CHRISTENSEN K,et al.New insights into the melanophilin(MLPH)gene controlling coat color phenotypes in American mink[J].Gene,2013,527(1):48-54.
[5]ANISTOROAEI R,FREDHOLM M,CHRISTENSEN K,et al.Albinism in the American mink(Neovisonvison)is associated with a tyrosinase nonsense mutation[J].AnimGenet,2008,39(6):645-648.
[6]宋兴超,徐超,岳志刚,等.美洲水貂(Neovisonvison)黑素皮质激素受体-1(MC1R)基因序列鉴定及生物信息学分析[J].畜牧兽医学报,2015,46(5):752-759.SONG X C,XU C,YUE Z G,et al.Identification and bioinformatic analysis on melanocortin-1 receptor gene(MC1R) of American mink(Neovisonvison)[J].ActaVeterinariaetZootechnicaSinica,2015,46(5):752-759.(in Chinese)
[7]VALVERDE P,HEALY E,JACKSON I,et al.Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans[J].NatGenet,1995,11(3):328-330.
[8]VOISEY J,VAN DAAL A.Agouti:from mouse to man,from skin to fat[J].PigmentCellRes,2002,15(1):10-18.
[9]EIZIRIK E,YUHKI N,JOHNSON W E,et al.Molecular genetics and evolution of melanism in the cat family[J].CurrBiol,2003,13(5):448-453.
[10]唐春娟,李祥龙,周荣艳,等.山羊Agouti基因第1内含子T128缺失在中国主要地方山羊品种中的变异[J].畜牧兽医学报,2009,40(3):320-326.
TANG C J,LI X L,ZHOU R Y,et al.Study on genetic diversity of T128 del inAgoutigene intron 1 in Chinese main indigenous goat breeds[J].ActaVeterinariaetZootechnicaSinica,2009,40(3):320-326.(in Chinese)
[11]ABITBOL M,LEGRAND R,TIRET L.A missense mutation in the agouti signaling protein gene (ASIP) is associated with the no light points coat phenotype in donkeys[J].GenetSelEvol,2015,47:28.
[12]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning(Third edition)[M].New York:Cold Spring Habor Laboratory Press,2002:461-512.
[13]王兴平,罗仍卓么,李峰,等.湘西黄牛Myf5和Pax7基因的SNPs检测及其与体尺性状的关联分析[J].畜牧兽医学报,2014,45(9):1531-1537.
WANG X P,LUORENG Z M,LI F,et al.Identification of SNPs inMyf5 andPax7 genes and association analysis with body measurement traits in Xiangxi cattle[J].ActaVeterinariaetZootechnicaSinica,2014,45(9):1531-1537.(in Chinese)
[14]GIRARDOT M,MARTIN J,GUIBERT S,et al.Widespread expression of the bovineAgoutigene results from at least three alternative promoters[J].PigmentCellRes,2005,18(1):34-41.
[15]LI X L,ZHAO J W,TANG C J,et al.Sequencing of part of the goatAgoutigene and SNP identification[J].BiochemGenet,2010,48(1-2):152-156.
[16]VOISEY J,BOX N F,VAN DAAL A.A polymorphism study of the humanAgoutigene and its association withMC1R[J].PigmentCellRes,2001,14(4):264-267.
[17]SUZUKI I,TADA A,OLLMANN M M,et al.Agouti signaling protein inhibits melanogenesis and the response of human melanocytes to α-melanotropin[J].JInvestDermatol,1997,108(6):838-842.
[18]张天.不同毛色山羊皮肤组织ASIP蛋白表达与Agouti基因剪接体类型研究[D].保定:河北农业大学,2014.
ZHANG T.Study on expression of ASIP protein andAgoutigene spliceosome types in skin tissue of different coat color goat[D].Baoding:Agricultural University of Hebei,2014.(in Chinese)
(编辑程金华)
Single Nucleotide Polymorphisms Detection of Agouti Gene and Its Association with Coat Color Phenotype in American Mink(Neovisonvison)
SONG Xing-chao,XU Chao,LIU Zong-yue,YUE Zhi-gang,CONG Bo,LIU Lin-ling,YANG Fu-he*
(StateKeyLaboratoryofSpecialEconomicAnimalMolecularBiology,InstituteofSpecialAnimalandPlantSciences,ChineseAcademyofAgriculturalSciences,Changchun130112,China)
Abstract:The aim of this study was to research single nucleotide polymorphisms of agouti signal protein(Agouti)gene and analyze the association of SNPs with coat color phenotype in American mink(Neovisonvison).The DNA of blood from 5 mink breeds(Jinzhou black,Jilin white,Silverblue,Coffee and Pearl mink)that possessed significant difference in coat color phenotype were selected as templates,SNP sites were screened by PCR and Sanger double chain termination sequencing technology,and then the relationship between the mutation sites ofAgoutigene and coat color phenotype were analyzed in 430 minks.The results showed that the obtained minkAgoutigene was 2 510 bp in length.Total 10 SNPs were screened from 430 individuals of 5 coat color breeds,of which 4 SNPs (g.18G>A,g.159A>G,g.235G>T and g.1189C>T)were located in intron 2 and 6 SNPs(g.252C>T,g.290A>C,g.298G>C,g.340A>G,g.343T>C and g.379T>C)were detected from partial intron 3 ofAgoutigene,while no SNPs was discovered in exon 2 and 3.Association analysis of 7 SNPs inAgoutigene with coat color phenotype indicated that all sites were very significantly(P<0.000 1)correlated with coat color phenotype of American mink.In addition,the 5 loci including g.290A>C,g.298G>C,g.340A>G,g.343T>C and g.379T>C might show closely linkaged phenomenon.Results of the present study indicated thatAgoutigene might be the candidate gene or linked with the major gene affecting the coat color phenotype of American mink.
Key words:American mink;Agoutigene;coat color phenotype;SNPs;correlation analysis
doi:10.11843/j.issn.0366-6964.2016.04.012
收稿日期:2015-06-08
基金项目:国家重点基础研究发展计划-973项目(2012CB722907);水貂优良种质资源及选育技术引进-948项目(2014-Z8)
作者简介:宋兴超(1982-),男,河北保定人,博士生,助理研究员,主要从事特种经济动物遗传育种研究,E-mail:songxingchao@caas.cn *通信作者:杨福合,研究员,博士生导师,主要从事特种经济动物种质资源收集、评价及遗传育种研究,E-mail:yangfh@126.com
中图分类号:S865.2+2.2
文献标志码:A
文章编号:0366-6964(2016)04-0723-10

