AD中REST的空间分布对神经元细胞凋亡与自噬的影响
方 珉, 张 佩, 金爱萍, 刘学源
(同济大学附属第十人民医院神经内科,上海 200072)
·基础研究·
AD中REST的空间分布对神经元细胞凋亡与自噬的影响
方 珉, 张 佩, 金爱萍, 刘学源
(同济大学附属第十人民医院神经内科,上海 200072)
目的 探讨Alzheimer病中抑制性因素1沉默作用转录因子(repressor element-1 silencing transcription, REST)的空间分布对神经元的凋亡与自噬的影响。方法 C57小鼠侧脑室注射Aβ25-35建造AD模型,以无菌生理盐水为对照,用荧光共聚焦显微镜观测REST蛋白在造模前后细胞内的定位的变化,并采用Real-Time PCR和Western印迹法检测小鼠神经元中凋亡与自噬相关基因的表达。结果 荧光共聚焦显微镜观测发现AD状态下REST基因入核受阻,Real-Time PCR和Western印迹法显示促进凋亡的BAX、CASP9表达增强,而抑制凋亡的BCL2基因表达下降。自噬标志基因LC-3的表达水平也增强。结论 AD状态下REST基因入核受阻,并引起凋亡与自噬相关基因的表达。
阿尔茨海默病; 抑制性因素1沉默作用转录因子; 细胞内定位; 细胞凋亡; 自噬
阿尔茨海默病(Alzheimer’s disease, AD)的发病机制复杂,涉及多种神经系统功能障碍[1-2],β淀粉样蛋白(β-amyloid protein, Aβ)在脑中的沉积是其发病的中心环节[3-4],然而,一些有着显著AD解剖和分子特征的老人,在其一生中几乎不表现出认知衰退症状,而另一些有着同样分子特征的老人却在数十年甚至几十年后形成AD。是否在脑内存在某种细胞或成分能够明显减弱Aβ的毒性?最新研究显示抑制性因素1沉默作用转录因子(repressor element -1 silencing transcription, REST),可以有效的保护神经元免于Aβ毒性损伤。REST是负调控的细胞转录因子,广泛表达于胚胎干细胞和神经干细胞,它在细胞分化、神经再生、神经保护和认知功能等多方面调节神经功能[5-7]。有研究证实,在老年鼠中REST蛋白大量进入细胞核,通过阻遏下游凋亡相关基因和自噬相关基因的启动,从而保护神经元免于Aβ损伤,而在AD状态下REST入核受阻[3,5-6];正常老年人,轻度认知功能障碍(mild cognitive impairment, MCI)患者和AD患者神经细胞核内REST含量依次递减[6]。由此推断,神经元细胞中REST在细胞中的定位可能会影响其活性,REST的核定位与认知功能的保持密切相关。本研究拟探讨REST在AD中入核受阻后是否影响神经元的凋亡与自噬。
1 材料与方法
1.1 动物分组及造模
取雄性C57小鼠,体质量18~22g。将小鼠随机分为AD组和正常对照组,每组10只。所有小鼠用3.5%的水合氯醛(10ml/kg)麻醉后,AD组小鼠经侧脑室一次性注入5μl凝聚态Aβ25-35(含Aβ25-355μg/ml,以无菌生理盐水溶解,37℃ 120h使其成凝聚态),留针1min,建造AD模型[9],对照组小鼠同侧脑室给予等体积无菌生理盐水。14d后采用Morris水迷宫试验[10],记录大鼠找到平台所需逃避潜伏期,检验造模是否成功。
1.2 TUNEL凋亡染色及半定量分析
选取海马、额叶、顶叶同时存在矢状断面切片,按TUNEL凋亡染色试剂盒(武汉博士德公司)进行TUNEL细胞凋亡染色。每只鼠脑染色2张切片,每一切片高倍视野(400×)下每部位取4个视野共计数100个神经元,计算凋亡神经元阳性百分率即神经元凋亡指数(NAI)=凋亡细胞数(N)/总统计细胞数(T)×100%。
1.3 REST免疫荧光染色
取上述脑组织进行冰冻切片,8μm厚度切片,贴片在防脱玻片上,室温放置30min,用1×PBS冲洗3次,每次3min。用2%的小牛血清(BSA)室温封闭1h。加入REST抗体(1∶100稀释),4℃孵育过夜。用1×PBS冲洗3次,每次3min。用FITC标记的山羊抗兔荧光二抗(IgG H&L,1∶500稀释),室温避光孵育1h。用DAPI染色液染色3min。用1×PBS冲洗3次,每次3min,用甘油封片,荧光显微镜下观察拍照。每只鼠脑染2张切片,每一染色片高倍视野(400×)下取3个视野,定位REST蛋白在细胞内的表达位置。
1.4 Western印迹法
使用RIPA液提取小鼠左侧海马组织中蛋白,Western印迹法检测相关蛋白的表达水平。采用以下方法配置匀浆液: Tris 0.158g,NaCl 0.18g,ddH2O 10ml,浓HCl调pH至7.4,加40μl 0.5mol/L高压灭菌过的EDTA定容至20ml,4℃保存。使用前每100ml加1mg/ml的Leupeptin 100μl;protinin 100μl;200mmol/L PMSF 500μl;200mmol/L的NaF 500μl;200mmol/L的Na3VO4500μl。加入1ml RIPA液后,冰上匀浆脑组织。4℃离心,82000r/min,离心半径10cm,离心20min留上清液,弃沉淀。转移上清至另一离心管中4℃离心,18000r/min,离心半径10cm,离心45min,保存上清液。用BCA的方法进行蛋白浓度测定(碧云天BCA检测试剂盒)。各取50mg总蛋白,进行SDS-PAGE电泳,电泳后转印硝酸纤维素膜(Pall公司,美国)。将膜在含5%脱脂奶粉的TBST(10mmol/L Tris-HCl,0.05%Tween-20 pH 7.5,150mmol/L NaCl)中室温下封闭1h,随后加入用一抗,Bax(1∶1 000)、Bcl2(1∶1 000),Casp9(1∶1 000)及LC3(1∶1 000)室温下摇床上孵育3h,加入山羊抗兔IgG-HRP二抗,室温孵育30min,ECL化学发光试剂检测(Santa Cruz)。用天能5200 ECL化学发光检测系统进行拍照和分析。
1.5 统计学处理
2 结 果
2.1 Morris水迷宫试验结果
对照组、AD组逃避潜伏期分别为(24.5±19.6)、(50.8±26.1)s,Aβ注射后潜伏期明显延长(P<0.01),小鼠学习记忆功能受损,提示造模成功,见图1。

图1 Morris水迷宫试验逃避潜伏期Fig.1 The escape latency of Morris water maze test
2.2 Aβ对脑内神经元凋亡的影响
TUNEL凋亡染色可见细胞核呈棕黄色的阳性凋亡细胞,对照组各脑区见个别散在凋亡细胞,细胞凋亡率仅为(1.53±0.85)%,而AD组海马区神经元凋亡显著增加,细胞凋亡率上升到(15.74±4.75)%,差异有统计学意义(P<0.01),见图2。
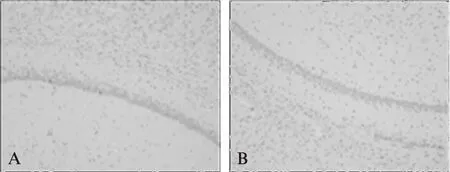
图2 Tunel检测海马区神经元凋亡Fig.2 Tunel detects the apoptosis of neuron in hippocampus regionA: 对照组;B: AD组
2.3 AD发生对脑内REST表达水平及位置的影响
REST免疫荧光染色于海马、额叶、顶叶、基底前脑均可见胞质及细胞核内有绿色的荧光信号,AD组可见细胞核中的REST信号显著降低,而细胞浆中的表达变化并不明显,见图3。提示在AD中REST的入核受阻。

图3 REST蛋白的表达与空间定位Fig.3 Expression and location of REST proteinA: 对照组;B:AD组;箭头示REST信号
2.4 REST入核受阻后凋亡与自噬相关蛋白的表达
Western印迹法检测两组中凋亡相关蛋白BAX、BCL2、Casp9及自噬相关蛋白LC-3的表达水平。结果显示,与正常对照组相比,REST入核受阻后AD组促进凋亡的BAX、Casp9表达增强(P<0.05,P<0.01),而抑制凋亡的BCL2蛋白表达下降(P<0.01)。自噬标志LC-3蛋白表达水平增强(P<0.01),见图4。
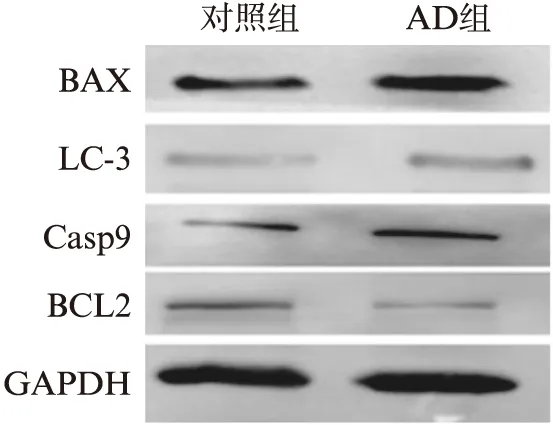
图4 凋亡及自噬相关蛋白的表达水平Fig.4 Expression of apoptosis and autophagy-related proteins
3 讨 论
本实验采用小鼠急性脑室内注射Aβ25-35,14d后,小鼠水迷宫试验表现逃避潜伏期显著延长,说明学习记忆能力明显下降,提示造模成功[11-12]。近年来,越来越多的证据表明,皮质和海马区的神经元减少是AD的主要病理特征,而神经细胞凋亡是AD神经元丢失的主要原因[13]。有研究指出,Aβ的异常沉积是AD发病的中心环节,Aβ对神经元的毒性作用主要表现在破坏细胞膜的完整性,扰乱细胞内环境的稳定,诱发中枢免疫炎性反应等方面[14]。Aβ沉积可能是导致神经元变性和突触丢失的重要原因。Zhao等[15]在研究中发现,Aβ沉积可能影响线粒体通透性,进而引起神经元细胞凋亡。此外还有一些研究发现凋亡基因p53与AD患者的脑内细胞凋亡活动密切相关。在转基因过表达Aβ的AD模型脑内,发现在Aβ沉积的同时,会伴有P53蛋白的广泛表达[16]。Da Pozzo等[17]则发现抑制TP53可以有效降低Aβ对人SH-SY5Y细胞的影响[17]。本实验通过Tunel检测造模与正常组中脑组织海马神经元的凋亡,结果显示,AD组中海马神经元凋亡水平显著高于正常对照组,这与其他人的研究相一致[15-17]。
在神经元的发育机制中,REST对基因表达的转录起着非常重要的负调控作用,可以调控多种神经元相关细胞因子的表达,可以影响神经元干细胞的分化,Lu等[8]在其研究中指出,REST这种蛋白质在老化大脑中表达量显著升高,REST的表达水平在患有轻度认知功能障碍和AD患者的神经元细胞中显著降低,进一步证实REST的表达水平与认知功能正相关。本研究也发现REST蛋白在AD时出现入核受阻的情况,进一步用Western印迹法检测了凋亡及自噬相关基因的表达,结果显示,在AD中REST入核受阻后,凋亡基因BAX及Casp9的表达显著上调,而凋亡抑制基因BCL2的表达则显著下降。这提示,Aβ诱导后会导致小鼠脑组织对神经元细胞内起保护作用的REST基因活性下降(入核受阻),进而导致凋亡相关基因BAX及Casp9等的异常活化,而凋亡抑制基因BCL2则失活,进而引发神经元细胞凋亡。这在TUNEL检测中也得到了证实。另外,本研究还分析了自噬相关的LC3基因的表达,发现在AD模型中自噬基因LC3的表达显著升高。Nixon等[18]通过电子显微镜观察了PS1/APP转基因AD小鼠的脑组织,结果发现了大量的自噬小体,这也与本研究一致。另外Yu等[19]还发现自噬溶酶体中含有Aβ40和Aβ42及其前体APP、βCTF等,随着自噬的增加,会加剧Aβ的积累[19]。提示REST入核受阻后,也可能会促进自噬的产生,进而进一步加剧Aβ积累和其毒性。
综上所述,本研究发现REST蛋白在Aβ诱导的小鼠AD模型脑组织神经元细胞中其入核受阻,并且可能影响了凋亡与自噬相关基因的表达改变。
[1] Malkki H. Alzheimer disease: Possible prion-like transmission of AD-like pathology in humans[J]. Nat Rev Neurol, 2015,11(11): 612.
[2] Birks JS, Chong LY, Grimley Evans J. Rivastigmine for Alzheimer’s disease[J]. Cochrane Database Syst Rev, 2015,9: CD001191.
[3] Bukhari SN, Jantan I. Syntheticcurcumin analogs as inhibitors of β -amyloid peptide aggregation: potential therapeutic and diagnostic agents for Alzheimer’s disease[J]. Mini Rev Med Chem, 2015,15(13): 1110-1121.
[4] Jhoo JH, Kim HC, Nabeshima T, et al. Beta-Amyloid(1-42)-induced learning and memory deficits in mice: involvement of oxidative burdens in the hippocampus and cerebral cortex[J]. Behal Brain Res, 2004,155(2): 185-196.
[5] Dols-Icardo O, Vilaplana E, Sampedro F, et al. Effect of REST on brain metabolism in the Alzheimer disease continuum[J]. Ann Neurol, 2015,78(4): 661-662.
[6] Li K, Jiang Q, Xu A, et al. REST rs3796529 variant does not confer susceptibility to Alzheimer’s disease[J]. Ann Neurol, 2015,78(5): 835-836.
[7] Yankner BA. REST and Alzheimer disease[J]. Ann Neurol, 2015,78(3): 499.
[8] Lu T, Aron L, Zullo J, et al. REST and stress resistance in ageing and Alzheimer’s disease[J]. Nature, 2014,507(7493): 448-454.
[9] Guo CN, Sun L, Liu GL, et al. Protective effect of nicotine on the cultured rat basal forebrain neurons damaged by β-Amyloid (Aβ)25-35 protein cytotoxicity[J]. Eur Rev Med Pharmacol Sci, 2015,19(16): 2964-2972.
[10] 先宇飞,屈婵,吴哲,等.国产和加拿大产西洋参茎叶总皂苷的促智作用的比较[J].沈阳药科大学学报,2006,23(1): 43-47.
[11] Fernandez F, Garner CC. Object recognition memory is conserved in Ts1Cje, a mouse model of Down syndrome[J]. Neurosci Lett, 2007,421(2): 137-141.
[12] Orta-Salazar E, Aguilar-Vzquez A, Martínez-Coria H, et al. REST/NRSF-induced changes of ChAT protein expression in the neocortex and hippocampus of the 3x Tg-AD mouse model for Alzheimer’s disease[J]. Life Sci, 2014,116(2): 83-89.
[13] Vecchio F, Babiloni C, Lizio R, et al. Resting state cortical EEG rhythms in Alzheimer’s disease: toward EEG markers for clinical applications: a review[J]. Suppl Clin Neurophysiol, 2013,62: 223-236.
[14] Rosenberg RN. Translational research on the way to effective therapy for Alzheimer disease[J].Arch Gen Psychiatry, 2005,62(11): 1186-1192.
[15] Zhao LI, Wang JL, Wang YR,et al. Apigenin attenuates copper-mediated β-amyloid neurotoxicity through antioxidation, mitochondrion protection and MAPK signal inactivation in an AD cell model[J]. Brain Res, 2013,1492: 33-45.
[16] Calissano P, Matrone C, Amadoro G. Apoptosis and in vitro Alzheimer disease neuronal models[J].Commun Integr Biol, 2009,2(2): 163-169.
[17] Da Pozzo E, La Pietra V, Cosimelli B, et al. p53 functional inhibitors behaving like pifithrin-β counteract the Alzheimer peptide non-β-amyloid component effects in human SH-SY5Y cells[J].ACS Chem Neurosci, 2014,5(5): 390-399.
[18] Nixon RA, Wegiel J, Kumar A, et al. Extensive involvement of autophagy in Alzheimer disease: an immuno-electron microscopy study[J].J Neuropathol Exp Neurol, 2005,64(2): 113-122.
[19] Yu WH, Kumar A, Peterhoff C, et al. Autophagic vacuoles are enriched in amyloid precursor protein-secretase activities: implications for beta-amyloid peptide over-production and localization in Alzheimer’s disease[J]. Int J Biochem Cell Biol, 2004,36(12): 2531-2540.
Effect of REST spatial distribution on apoptosis and autophagy of neurons in mouse Alzheimer’s disease model
FANGMin,ZHANGPei,JINAi-ping,LIUXue-yuan
(Dept. of Neurology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To investigate the effect of repressor element-1 silencing transcription (REST) spatial distribution on apoptosis and autophagy of neurons in mouse Alzheimer’s disease (AD) model. Methods C57 mice were randomly divided into AD group and normal control group. Mouse AD model was established by injection of Aβ25-35through lateral cerebral ventricle. The location of REST protein in cell was monitored by confocal microscope. The mRNA and protein expressions associated with neuronal apoptosis and autophagy were tested by Real-Time PCR and Western blotting, respectively. Results REST factor was blocked into nuclear in AD mice. Compared with normal group, the expression of pro-apoptotic genes BAX and CASP9 were increased significantly, while the expression of apoptosis-inhibiting gene BCL2 was decreased significantly. Meanwhile expression of autophagy gene LC-3 was enhanced. Conclusion REST protein is blocked for nuclear transfer in Aβ- induced mouse AD model, which may induce the changes of apoptosis and autophagy-related gene expression.
Alzheimer’s disease; repressor element silencing transcription factor; intracellular localization; apoptosis; autophagy
10.16118/j.1008-0392.2016.02.002
2015-12-02
上海市卫生和计划生育委员会面上项目(201540063)
方 珉(1973—),女,副主任医师,博士.E-mail:fangmin_dr@126.com
R 749.16
A
1008-0392(2016)02-0005-05

