大熊猫粪便类固醇激素的保存时效性及检测准确性研究
毕温磊,杨志松,陈 鹏,陈 超,冯菲菲, ,侯 蓉,张志和,李明喜,齐敦武
(1.成都大熊猫繁育研究基地 四川省濒危野生动物保护生物学省部共建实验室,四川 成都 610861;2.西华师范大学 生命科学学院,四川 南充 637009)
大熊猫粪便类固醇激素的保存时效性及检测准确性研究
毕温磊1,杨志松2,陈鹏1,陈超1,冯菲菲1,JacobROwens1,侯蓉1,张志和1,李明喜1,齐敦武1
(1.成都大熊猫繁育研究基地 四川省濒危野生动物保护生物学省部共建实验室,四川 成都610861;2.西华师范大学 生命科学学院,四川 南充637009)
摘要:对大熊猫类固醇激素的监测有助于了解其生存环境的状况,然而,野外采集的粪便样品的时间尚缺乏准确估计,因此,样品中有效保存的时间与分析量是否对检测结果具有影响尚不得而知。为评估样品分析量和保存时间对野生大熊猫粪便样品类固醇激素结果的影响,我们设置0.5g和0.2g两种样品分析量,以及模拟野外温度(13±2℃)环境下,进行连续360 h的检测分析。结果表明:不同样品分析量(即0.5g和0.2g)间差异显著(p=0.000),且分析量越大检测结果越准确。雄性大熊猫的皮质醇可稳定保存48h(F=6.08,P<0.05),睾酮未出现显著性变化(F=0.813,P>0.05),结果在360 h内具有可比性;雌性大熊猫的皮质醇可稳定保存72 h(F=5.96,P<0.05),孕酮可稳定保存48 h(F=2.365,P<0.05)。在实际应用中,对于非新鲜的大熊猫粪便样品应根据不同检测目的在样品保存的有效期内进行类固醇激素的准确检测。
关键词:大熊猫粪便;类固醇激素;野外环境;保存时效性;准确性
近年来,许多研究通过分析濒危野生动物类固醇激素的含量和变化情况实现对其繁殖、应激等生理水平的监测[1-6]。与传统采集动物血液[7]、组织样品等方法相比,利用非损伤性取样方法(Noninvasivesamplingmethods)[5,8]获取动物粪便样品,对动物的干扰最小[9,10],成为分析动物类固醇激素水平的重要、可行途径[11-13]。从动物粪便样品中检测到的一般都是类固醇激素的代谢物,而不是源激素[14],这些代谢物容易受到微生物的降解[15],野外环境的降雨、雪、日晒等均会加快降解反应[16,17]。因此,随着样品在环境中滞留时间的增加,会使得其中的类固醇激素含量发生变化,影响动物粪便内的类固醇激素含量。而明确粪便样品中类固醇激素含量随时间变化的情况,可以有效指导野外粪便样品的正确采集,从而得到更为准确科学的实验结果。
在动物粪便类固醇激素的提取中,研究者通常取用少量的样品量进行类固醇激素提取的统计分析(0.2g)[18]。通过取用0.2g棕熊(Ursus arctos horribilis)粪便样品来验证季节、食物等对棕熊粪便糖皮质醇激素的影响[19],取用0.2g猎豹(Acinonyx jubatus)粪便样品进行样品保存方式的研究[20],取用0.2g的样品量验证不同储存条件对野生狒狒(Papio cynocephalus)粪便样品中类固醇激素的影响,从而得出-20℃冷冻是最佳条件的结论[21]。也有0.5g大熊猫湿粪样品进行有关雄性大熊猫(Ailuropoda melanoleuca)肾上腺皮质激素随季节变化的研究[22]。在鸟类等研究中,则仅能取用更少的样品量(0.02g),然而这可能给结果带来一定的误差[23]。
濒危野生动物的非损伤性生理研究面临着新鲜样品较难获取的问题[18]。首先,野外采集的粪便样品通常并不是非常新鲜[24],往往只能通过辨别其物理形态特征如粪便表层粘膜的新鲜程度等大致确定排出时间[25],其次,采集到的样品也不能及时的进行检测,通常要经过一定时间的运输和有效保存到实验室后方能进行检测分析[26],这会对诸如类固醇激素等生理激素水平的研究造成一定的影响。有研究发现,梅花鹿(Cervus nippon)的粪便类固醇激素在常温(20℃)下只能有效保存24h[27]。圈养林麝(Moschus berezovskii)粪便孕酮及其代谢物在室温条件下48h有明显的上升趋势,雌二醇、睾酮和皮质醇及其代谢物在18h均出现显著变化[28]。大熊猫(Ailuropoda melanoleuca)是我国特有的一级重点保护物种,也是国际动物保护的旗舰物种[29]。野外大熊猫种群稀少,总数量约1 864只[30],生活在高海拔地区等独特的生活特性使得针对该濒危物种开展野外研究时同样会面临样品获取的问题。
为明确不同样品分析量对检测结果的影响,我们对比0.5g和0.2g两个采样量对检测结果的影响。同时,为了解野外大熊猫粪便样品中类固醇激素随时间增加的变化情况,我们选取成都大熊猫繁育研究基地25只健康大熊猫个体为研究对象,采集新鲜粪便样品,在模拟一定野外温度环境下,对样品在15d内进行类固醇激素的连续检测和分析。本项研究旨在为野外环境下大熊猫粪便类固醇激素的研究提供参考。
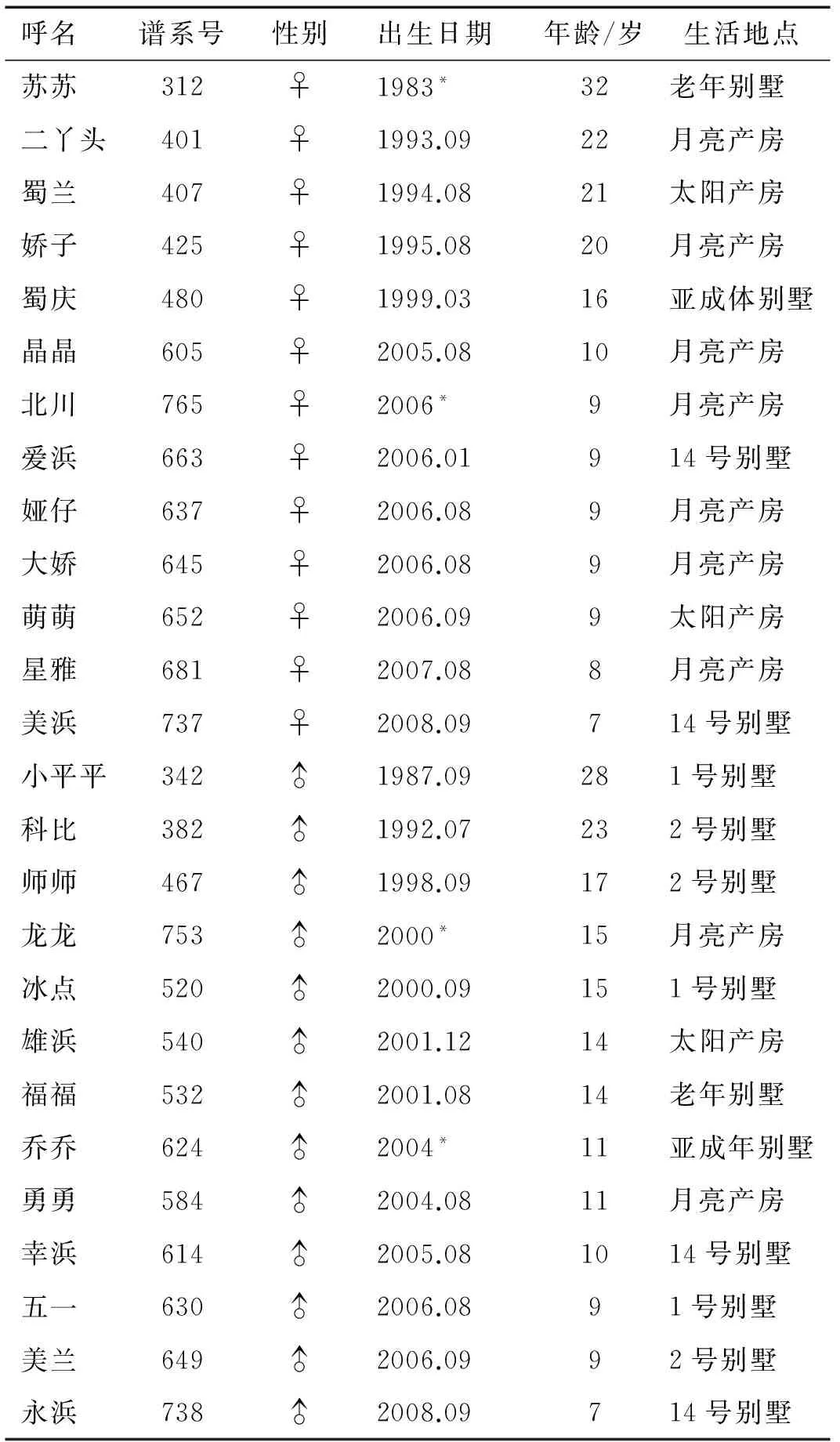
表1 研究对象的基本信息
标注:“*”表示野外救助大熊猫个体的估测出生日期。
1研究对象
以成都大熊猫繁育研究基地的25只健康大熊猫个体作为研究对象(见表1)。其中雄性12只,雌性13只。每只研究对象均单独圈养,早晨从夜晚室内笼舍处交换至户外活动场自由活动,每日均以新鲜竹笋、竹子为食,并辅食有苹果和其它人工精饲料(由牛奶和由豆粉、麸皮、鸡蛋和胡萝卜混合后蒸制所成)。研究期间,所有动物均健康状况良好。
2研究方法
2.1样品采集和处理
为验证取样量对结果的影响,我们选取大熊猫个体“北川”作为研究对象,采集其相邻2个时间(分别为9∶30和10∶20)排出的全部新鲜粪便,其中先排出2团粪便,随后排出另外2团粪便,分别标记为A1、A2、A3、A4等四个组,然后分别采用0.5g和0.2g两种分析量各3次,并立即提取皮质醇激素。
同时,为验证类固醇激素随时间的变化情况,我们于2013年5月24日到 8月5日,每天早6∶00—9∶00,连续5 次等候采集全部25只大熊猫的新鲜粪便,一般为2 团或 2 团以上。为避免样品污染,利用PE手套采集样品后立即放入密封袋,记录采集对象的名称、日期、时间、地点,用冰盒带回实验室后,立即将采集到的样品进行称重和分装(每份5g)放入-20℃冰箱。每研究对象的样品选用160份,首先取其中10份充分混合,雄性测定皮质醇、睾酮值,雌性测定皮质醇和孕酮值。同时,将余下的150份放于恒定温度的贮藏室内(13±2℃),通风放置6h、12h、18h、24h、36h、48h、72h、96h、120h、144h、168h、216h、264h、360h后,并测定各时间点的激素值。
2.2类固醇激素提取与测定
不同取样量对比分析实验中,皮质醇激素的提取参照崔媛媛等[31]的方法,利用放射免疫分析法(Radioimmuoassay,RIA)进行皮质醇激素的检测,放射性免疫分析试剂盒来自北京科美东雅有限公司生产的类固醇激素放射性免疫分析测定盒。试剂盒的主要技术参数为:(1)测定范围为10—500ng/mL;(2)灵敏度<1ng/mL;(3)批内变异系数<5%,批间变异系数<10%。
类固醇随时间变化情况的实验中,激素的提取参考Nie等[26]的方法,步骤如下:解冻粪便,剪碎使其充分混匀;称取0.5g放入15mL离心管;加入6mL甲醇溶液(甲醇∶水 = 8∶1);振荡3min,充分溶解;在25℃,2 500g下离心15min;转移2mL甲醇萃取液至5mL玻璃管;70℃干燥至甲醇溶液完全蒸发;加2mL磷酸盐缓冲液(0.1M,pH7.0)重新溶解;将磷酸盐缓冲液的提取液存放在-20℃的冰箱中冷冻待测定。激素的测定采用酶联免疫吸附检测法(Enzyme-LinkedImmunosorbentAssay,ELISA),并参照大熊猫粪便样品较为稳定成熟的检测程序,如[7]。具体步骤如下:首先,用抗体包被酶标板,然后,配制标准液,稀释样品并用洗液清洗包被过的酶标板,依次加入标准液、样品、酶反应物(cortisol-horseradisperoxidase),1h后,取出洗板,加酶免反应底物,最后在酶标仪上进行读数。
2.3数据分析
在对数据的正态分布及方差齐性检验后,运用spss20.0[32]对不同放置时间下的粪便中的皮质醇水平进行单因素方差(One-WayANOVO)分析,显著性水平为P<0.05,测定结果表示为平均值±标准误差(X±SE)。

表2 不同样品分析量皮质醇结果
3结果
3.1不同分析量皮质醇水平
分别对两种分析量(0.5g和0.2g)皮质醇水平进行独立样本t检验,发现二者间具有差异显著(P<0.001,见表2),且0.5g稳定性较高,即分析量为0.5g的标准差和标准误差(分别为5.480、1.582)均小于0.2g的结果(分别为13.176、3.804)。
3.2不同时间的皮质醇变化
随时间增加,雌性和雄性的皮质醇都出现下降趋势,且在360h都达到最低值(分别为0.41±0.08ng/g和2.76±0.46ng/g)。雄性在48h后出现明显差异(F=6.08,P<0.05,见图1),而雌性则在96h后出现显著下降(F=5.96,P<0.05,见图2)。

3.3雄性睾酮随时间的变化
随时间增加,雄性睾酮呈现先下降后上升的趋势,但无明显差异(F=0.813,P>0.05,见图3)。相对于0h(3.62±0.64ng/g),6h睾酮的水平降至3.45±0.84ng/g,并在18h降至最小水平2.31±0.66n/g,但随后逐渐上升,在144h达到3.99±0.42ng/g,而在360h时为2.60±0.40ng/g。

3.4雌性孕酮随时间的变化
相比较雄性,雌性孕酮水平在72h(3.42±0.28ng/g)和96h(3.07±0.34ng/g)时与0h(2.15±0.43ng/g)呈现显著差异(F=2.365,P<0.05,见图4),而在其它时间则未有差异(P>0.05)。
4讨论
本研究首次探讨分析两种不同样品分析量对大熊猫粪便类固醇激素检测分析的影响,结果表明0.5g和0.2g分析量之间差异显著,且分析量大者检测结果更稳定。这与横斑林鸮(Strix occidentalis)等一些鸟类的相关研究类似,因为很多鸟类(尤其鸣禽)粪便样品的量少,因此,粪样量会对检测产生影响,甚至结果准确性较差[33,34]。对于大型哺乳动物来说,尽管粪便比较大,但是有时为了取样方便,节省样品存放空间,常常只收集部分粪便样品[35]。然而,由于粪便样品中类固醇激素的分布是不均匀的,造成其取用部位对检测结果有很大的影响[36]。当然,影响粪便样品测定结果的因素较多,不同时间排出的以及同一时间排出的大熊猫粪便激素值均是不同的,它们之间的关系还需要进一步实验探索。
在相同条件下,不同类型类固醇激素水平在不同时间下会出现不同的变化规律[37]。非洲黄狒狒(Macaca nemestrina)的粪便直接置于室温保存时,雌二醇和孕酮的含量会在6h左右发生变化,雌二醇含量明显下降,而孕酮的含量则明显上升[15]。当我们将新鲜大熊猫粪便样品置于相对恒定条件下(13±2℃),雄性睾酮在120h内未出现显著性变化,皮质醇可稳定保存48h;而雌性皮质醇可稳定保存72h,孕酮可稳定保存48h。基于野外气候方面考虑,四川作为主要分布区域其栖息地属于以亚热带季风气候为基带的山地气候,年均气温约0.8—13℃[38]。因此,我们选择13±2℃的模拟温度,或许对野外大熊猫的类固醇激素了解具有一定的参考意义。当然,野外环境天气多变,以及食物的不同、季节的不同等等因素,这些都会使得粪便中类固醇代谢物的浓度发生变化。
尽管如此,利用非损伤性手段进行濒危野生濒危动物的研究也越来越多[39],然而,目前研究对于粪便样品采集,特别对于野外环境下,其样品采集的随机性较大,仅根据经验来判断[40]。我们就发现随着放置时间的增加,大熊猫的皮质醇、孕酮的平均测定值与冷冻保存的0h对照样间均出现了显著差异,说明皮质醇和孕酮在测定时应严格控制样品时间。究其原因,可能与动物的排泄物中含有大量的胃肠细菌,以及外界的微生物将会分解粪便样品所含的类固醇激素的代谢产物有关[41,42]。但野外动物的新鲜粪便的获得却并不容易,即便像全国大熊猫数量调查这样大型的大熊猫野外调查活动,获取的粪便大部分为陈旧粪便和并不是很新鲜的样品[43],因此,充分利用采集到的样品进行实验分析也是十分重要的。
参考文献:
[1]SANDSJ,CREELS.Socialdominance,aggressionandfaecalglucocorticoidlevelsinawildpopulationofwolves,Canislupus[J].AnimalBehaviour,2004,67(3):387-396.
[2]吴 锋,孙 强,许建中,等.猎豹粪样皮质醇代谢研究[J].四川动物,2008,27(6):986-988.
[3]曹婷婷,胡德夫,于小杰,等.冬季圈养和放归普氏野马成年雄性应激状态研究[J].干旱区研究,2009,26(2):234-237.
[4]FREEMANEW,ABBONDANZAFN,MEYERJM,etal.AsimplifiedmethodformonitoringprogestogensinAfricanelephantsunderfieldconditions[J].MethodsinEcologyandEvolution,2010,1(1):86-91.
[5]KERSEYDC,WILDTDE,BROWNJL,etal.Risingfecalglucocorticoidconcentrationstrackreproductiveactivityinthefemalegiantpanda(Ailuropoda melanoleuca)[J].GeneralandComparativeEndocrinology,2011,173(2):364-370.
[6]YENAK,EUNHAK,SUSANL,etal.ChangesinfecalestrogenlevelsandsexualbehaviorincaptiveSichuanSnub-nosedmonkeys(Rhinopithecus roxellana)followingamalereplacement[J].ZooBiology,2013,32(3):342-346.
[7]李 俊. 大熊猫(Ailuropod melanoleuca)应激初步研究[D].四川:四川农业大学动物科学技术学院,2005.
[8]GOYMANNW.Ontheuseofnon-invasivehormoneresearchinuncontrolled,naturalenvironments:theproblemwithsex,diet,metabolicrateandtheindividual[J].MethodsinEcologyandEvolution,2012,3(4):757-765.
[9]李秦豫,艾斯卡尔·买买提,肖白桦,等.分子粪便学在濒危野生动物研究中的应用[J].河南科技学院学报(自然科学版),2010,38(3):42-46.
[10]KUMMROWMS,GILMANC,MACKIEP,etal.Noninvasiveanalysisoffecalreproductivehormonemetabolitesinfemaleveiledchameleons(Chamaeleo calyptratus)byenzymeimmunoassay[J].ZooBiology,2011,30(1):95-115.
[11]WASSERSK,HUNTKE,BROWNJL,etal.Ageneralizedfecalglucocorticoidassayforuseinadiversearrayofnondomesticmammalianandavianspecies[J].GeneralandComparativeEndocrinology,2000,120(3):260-275.
[12]刘炳万,蒋志刚.粪样在野生动物研究中的作用[J].动物学研究,2002,23(1):71-76.
[13]李春, 魏辅文,李明,等.粪便类固醇激素研究简史及其在野生动物研究中的应用[J].四川动物,2003,22(4):272-276.
[14]PALMER,RETTENBACHERS,TOUMAC,etal.Stresshormonesinmammalsandbirds:comparativeaspectsregardingmetabolism,excretion,andnoninvasivemeasurementinfecalsamples[J].AnnalsoftheNewYorkAcademyofSciences,2005,1040(1040):162-171.
[15]WASSERSK,RISLERL,STEINERRA.Excretedsteroidsinprimatefecesoverthemenstrualcycleandpregnancy[J].BiologyofReproduction,1988,39(4):862-872.
[16]ZIEGLERTE,WITTWERDJ.Fecalsteroidresearchinthefieldandlaboratory:improvedmethodsforstorage,transport,processing,andanalysis[J].AmericanJournalofPrimatology,2005,67(1):159-174.
[17]STETZJ,HUNTK,KENDALLKC,etal.EffectsofExposure,Diet,andThermoregulationonFecalGlucocorticoidMeasuresinWildBears[J].PlosOne,2013,8(2):858-860.
[18]MILLSPAUGHJJ,WASHBURNBE.Useoffecalglucocorticoidmetabolitemeasuresinconservationbiologyresearch:considerationsforapplicationandinterpretation[J].Generalandcomparativeendocrinology,2004,138(3):189-199.
[19]CHRISTINAG,WASSERSK,HUNTKE,etal.FactorsassociatedwithfecalglucocorticoidsinAlaskanbrownbears(Ursus arctos horribilis)[J].PhysiologicalandBiochemicalZoology,2004,77(2):313-320.
[20]TERIOKA,BROWNJL,MORELANDR.Comparisonofdifferentdryingandstoragemethodsonquantifiableconcentrationsoffecalsteroidsinthecheetah[J].ZooBiology,2002,21(3):215-222.
[21]LYNCHJW,KHANMZ,ALTMANNJ,etal.Concentrationsoffourfecalsteroidsinwildbaboons:short-termstorageconditionsandconsequencesfordatainterpretation[J].GeneralandComparativeEndocrinology,2003,132(2):264-271.
[22]KERSEYDC,WILDTDE,BROWNJL,etal.Parallelandseasonalchangesingonadalandadrenalhormonesinmalegiantpandas(Ailuropoda melanoleuca)[J].JournalofMammalogy,2010,91 (6):1496-1507.
[23]WASHBURNBE,MILLSPAUGHJJ,SCHULZJH,etal.Usingfecalglucocorticoidsforstressassessmentinmourningdoves[J].TheCondor,2003,105(4):565-573.
[24]胡锦矗,SCHALLERGB,潘文石,等.卧龙的大熊猫[M].成都:四川科学技术出版社,1985.
[25]于小杰,胡德夫,唐勇清,等.大熊猫粪便类固醇激素研究进展[J].生物学通报,2011,46(5):1-2.
[26]NIEY,SWAISGOODR,ZHANGZ,etal.Reproductivecompetitionandfecaltestosteroneinwildmalegiantpandas(Ailuropoda melanoleuca)[J].BehavioralEcologyandSociobiology,2012,66(5):721-730.
[27]YAMAUCHIK,HAMASAKIS,TAKEUCHIY,etal.Applicationofenzymeimmunoassaytofecalsteroidanalysisinsikadeer(Cervus nippon)[J].JournalofReproductionandDevelopment,1999,45(6):429-434.
[28]郎冬梅,刘文华,胡德夫,等.圈养林麝粪便类固醇激素保存时效性研究[J].四川动物,2011,30(3):357-361.
[29]胡锦矗.大熊猫研究[M].上海:上海科技教育出版社,2001.
[30]国家林业局.国家林业局全国第四次大熊猫调查结果新闻发布会[R/OL].(2015-02-28)[2015-11-3].http://www.scio.gov.cn/xwfbh/gbwxwfbh/fbh/Document/1395514/1395514.htm.
[31]崔媛媛,胡德夫,张金国,等.黄金周游客干扰对圈养大熊猫应激影响初探[J].四川动物,2009,28(5):647-651.
[32]张文丹,匡春伟.SPSS统计分析基础教程(第2版)[M].北京:高等教育出版社,2011.
[33]HAYWARDLS,BOOTHRK,WSSSERSK.Eliminatingtheartificialeffectofsamplemassonavianfecalhormonemetaboliteconcentration[J].GeneralandComparativeEndocrinology,2010,169(2):117-122.
[34]TEMPELDJ,GUTIRREZR.FactorsrelatedtofecalcorticosteronelevelsinCaliforniaSpottedOwls:Implicationsforassessingchronicstress[J].ConservationBiology,2004,18(2):538-547.
[35]张 肖,丁长青.粪便类固醇激素检测准确性的影响因素[J].动物学杂志,2012,47(05):143-151.
[36]于小杰,胡德夫,唐永清,等.大熊猫粪团表层和内部类固醇激素含量比较[J]. 经济动物学报 ,2010, 14(4):187-189.
[37]MASUNDAB,MUTISIC,HAMUDIKUWANDAH,etal.TheconcentrationoffaecalprogestinsduringtheoestrouscycleinNkoneCowsandtheeffectofdurationofstorageoffaecalsamplesatroomtemperatureonfaecalprogestinlevels[J].TropicalAnimalHealthAndProduction,1999,31(6):373-381.
[38]王锐婷,范雄,刘庆,等.气候变化对四川大熊猫栖息地的影响[J].高原山地气象研究,2010,30(4):57-60.
[39]李春旺,蒋志刚,房继明,等.麋鹿繁殖行为和粪便样品激素水平变化的关系[J].兽类学报, 2000,20(2):88-100.
[40]聂永刚.秦岭大熊猫繁殖生态学研究[D].北京:中国科学院研究生院,2012.
[41]TERIOKA,BROWNJL,MORELANDR,etal.Comparisonofdifferentdryingandstoragemethodsonquantifiableconcentrationsoffecalsteroidsinthecheetah[J].ZooBiology,2002,21(3):215-222.
[42]GALAMAWT,GRAHAMLH,SAVAGEA.Comparisonoffecalstoragemethodsforsteroidanalysisinblackrhinoceroses(Diceros bicornis)[J].Zoobiology,2004,23(4):291-300.
[43]国家林业局.全国第三次大熊猫调查报告[R].北京:科学出版社,2006.
ResearchontheEffectiveStoragePeriodandSampleQuantityforFecalSteroidsofGiantPandas
BIWenlei1,YANGZhisong2,CHENPeng1,CHENChao1,FENGFeifei1,JACOBROwens1,HOURong1,ZHANGZhihe1,LIMingxi1,QIDunwu1
(1.ChengduResearchBaseofGiantPandaBreeding,Chengdu610081,China;2.CollegeofLifeSciences,ChinaWestNormalUniversity,NanchongSichuan637009,China)
Abstract:Monitoring fecal steroid metabolites helps us understand the breeding ecology of wildlife,and,as a result,can improve the conservation and management of endangered species.However,the precision of the analyses used to detect-and the effective storage period of-fresh fecal steroids remain unclear.To determine the influence of sample mass on the results of steroid metabolite analyses,we compared between samples of 0.2 g and 0.5 g.To test the influence of time on the results,we collected feces from 25 pandas at the Chengdu Research Base of Giant Panda Breeding,which we studied under simulated field conditions(13±2℃),and tested steroid hormone daily for 360 hours.Our results showed that there were significantly different cortisol values between the 0.2g and 0.5g subsamples (p=0.000),and that the 0.5 g subsamples were more stable.The results of the fecal age sampling analysis indicate that the cortisol of the male panda was viable for 48 hours,however testosterone did not change significantly over the 360-hour period(F=0.813,P>0.05).For females,cortisol was viable for 72 hours(F=5.96,p<0.05),while progesterone remained stable for 48 hours(F=2.365,P<0.05).However,for the not fresh samples,we should detect the fecal steroid hormone in the effective period.
Keywords:giant panda feces;steroids;field conditions;effective storage period;precision
文章编号:1673-5072(2016)02-0131-06
收稿日期:2015-10-27
基金项目:国家自然科学基金项目(31101649;31372223);成都大熊猫繁育基金会项目(CPF 2013-17CPF2014-11,CPF 2014-03);成都市科技局项目(2015-HM01-00265-SF)
作者简介:毕温磊(1988—),男,内蒙赤峰人,硕士研究生,主要从事濒危动物生理生态学研究。 通讯作者:齐敦武(1978—),男,山东菏泽人,研究员,主要从事动物生态学方面研究。E-mail:qidunwu@163.com
中图分类号:Q955;Q959.838
文献标志码:A
DOI:10.16246/j.issn.1673-5072.2016.02.002

