响应曲面法优化β-葡萄糖苷酶固定化的研究
马慧玲,李笑梅
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
响应曲面法优化β-葡萄糖苷酶固定化的研究
马慧玲,李笑梅
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
摘要:以黑曲霉β-葡萄糖苷酶作为研究对像,采用交联-包埋的试验方法,以酶活力回收率作为评价的指标,选取海藻酸钠、壳聚糖、海藻酸钠-壳聚糖为载体,对β-葡萄糖苷酶固定化效果进行比较,结果显示海藻酸钠-壳聚糖固定化效果最好.再进行固定化条件单因素响应曲面试验,得到的最优条件为,海藻酸钠-壳聚糖的混合载体中海藻酸钠溶液的质量分数为1.91%、壳聚糖-醋酸溶液的质量分数为1.94%,温度为40.20 ℃,交联时间为0.98 h.此时酶活力为112 400 IU/mL,酶活力回收率为66.18%.经过三次回收试验,酶活力回收率分别为65.61%、64.48%、64.16%.
关键词:β-葡萄糖苷酶;固定化;酶活力回收率;海藻酸钠;壳聚糖
β-葡萄糖苷酶广泛的存在于自然界各种生物体内,对生物的生长、繁殖、代谢均起着重要作用[1-2].β-葡萄糖苷酶能够水解结合于末端非还原性的β-D-葡萄糖键,同时释放出β-D-葡萄糖和相应的配基[3].虽然β-葡萄糖苷酶有着巨大的应用价值,但是由于市场价格十分昂贵而且保存时间短,不可回收利用.酶的固定化是把酶束缚或者限制在一定的区域范围内,但是却仍然能够使它的催化特性得以保留,让它能够连续的反应,并且可以回收重复使用的一项技术.本文研究意旨在探讨筛选出有效的固定化酶载体,使游离酶更易于与载体结合乃至于后续大豆异黄酮水解,进而提高苷元转化率,为苷元制备技术的进一步开发及成果转化提供参考数据.
1材料与方法
1.1试验试剂
对硝基苯酚(天津市光复精细化工研究所);对硝基苯酚-β-D吡喃葡萄糖苷(上海金穗生物科技有限公司);β-葡萄糖苷酶(黑曲霉来源,南京生物科技有限公司);壳聚糖(国药集团化学试剂有限公司);海藻酸钠(天津市福晨化学试剂厂).
1.2试验仪器
722型光栅分光光度计(上海精密科学仪器有限公司);循环水式真空泵(巩义市予华仪器有限公司);一次性注射器(1 mL沈阳奉达医疗器械有限公司).
1.3实验方法
1.3.1对硝基苯酚标准曲线的绘制
用pH为5.0的磷酸氢二钠—柠檬酸缓冲溶液配置浓度为0、10、20、30、40、50、60 μmol/L的对硝基苯酚溶液,分别取2 mL上述稀释液,于45 ℃水浴锅中水浴30 min后,加入2 mL 0.5 mol/L的碳酸钠溶液,混合均匀,于试管架中冷却至室温(n=3).使用722型分光光度计在400 nm处测定吸光光度值(A),绘制标准曲线.
1.3.2游离酶活力的测定
酶活力定义:每分钟水解生成1 μmol/L对硝基苯酚所需要的酶量为一个酶活力单位.定义单位IU/ mL[4-5].
吸取1 mL稀释的酶液于比色管中再分别加入1.5 mL pH5.0的缓冲液,0.4 mL 50 mmol/L对硝基苯酚-β-D吡喃葡萄糖苷溶液.混合均匀后将其置于45 ℃水浴锅中30 min,其余步骤同1.3.1项下.
空白试验:以1 mL蒸馏水代替酶液,酶活力计算见公式(1).
(1)
其中:X为β-葡萄糖苷酶的活性,IU/mL;C为浓度,μmol/L;N为试样溶液反应前的总稀释倍数;t为反应时间,min;V为游离酶液反应用量,mL;m为固定化酶质量,g.
1.3.3固定化酶的制备和活力的测定
吸取稀释的酶液,加入到的固定化载体溶液中并充分混合均匀.逐滴添加到已配置好的相关溶液中进行制球并硬化处理,然后再在戊二醛溶液中进行交联反应得到固定化酶.用1.3.2 法测定固定化酶活力,并做相应的平行试验(n=3),酶活力回收率见式(2).
(2)
其中:W为酶活力回收率,%;M1为固定化酶的酶活力,IU/g;M0为游离酶的酶活力,IU/mL.
1.3.4三种不同固定化载体的比较筛选
1 )以海藻酸钠为载体固定化β-葡萄糖苷酶
准确吸取1 mL稀释的酶液,添加到质量分数为2%的海藻酸钠水溶液中,并充分混合均匀.用注射器逐滴缓慢的加入到4 g/L CaCl2溶液中去.在常温下硬化2 h.然后用真空抽滤机进行抽滤.在0.2%的戊二醛中交联1h[6].用蒸馏水洗涤3遍,冲去未结合的游离酶以及固定化酶表面的戊二醛,得到固定化酶(n=3).
2) 以壳聚糖为载体固定化β-葡萄糖苷酶
以质量分数为0.5%的醋酸溶液将壳聚糖溶解,使之形成质量分数为2%的壳聚糖溶液.搅拌均匀[7].将酶液与壳聚糖-醋酸溶液搅拌均匀.用注射器将酶与壳聚糖的混合液滴入混有15%的氢氧化钠溶液和95%乙醇的溶液中,制成壳聚糖微球放置于4 ℃条件下固定化2 h.其余步骤同上.
3) 以海藻酸钠-壳聚糖为载体固定化β-葡萄糖苷酶
吸取稀释的酶液与2%的海藻酸钠水溶液混合均匀.用注射器缓慢的滴入到2%的壳聚糖-醋酸溶液和2%的CaCl2溶液的混合液中,形成微胶囊.然后将其放入4 ℃的冰箱中硬化2 h.其余步骤同上.
1.3.5酶固定化条件的单因素试验
在所筛选出最适宜载体下,选定载体溶液的浓度、交联时间、反应温度进行单因素试验.基础条件分别为海藻酸钠质量分数为2%、壳聚糖质量分数为2%、交联时间为1 h、反应温度为45 ℃,评价指标为酶活力回收率.
1)海藻酸钠质量分数对酶活力回收率的影响
考察海藻酸钠质量分数分别为1%、1.5%、2%、2.5%、3%时,对酶活力回收率的影响.
2)壳聚糖质量分数对酶活力回收率的影响
考察壳聚糖质量分数分别为1%、1.5%、2%、2.5%、3%时,对酶活力回收率的影响.
3)交联时间对酶活力回收率的影响
考察交联时间分别为0.5、1、1.5、2、2.5 h时,对评价指标的影响.
4)反应温度对酶活力回收率的影响
考察反应温度分别为35、40、45、50、55 ℃时,对评价指标的影响.
1.3.6响应曲面法确定最优固定化条件
根据单因素试验结果进行响应曲面的试验设计,因子编码及水平如表1.
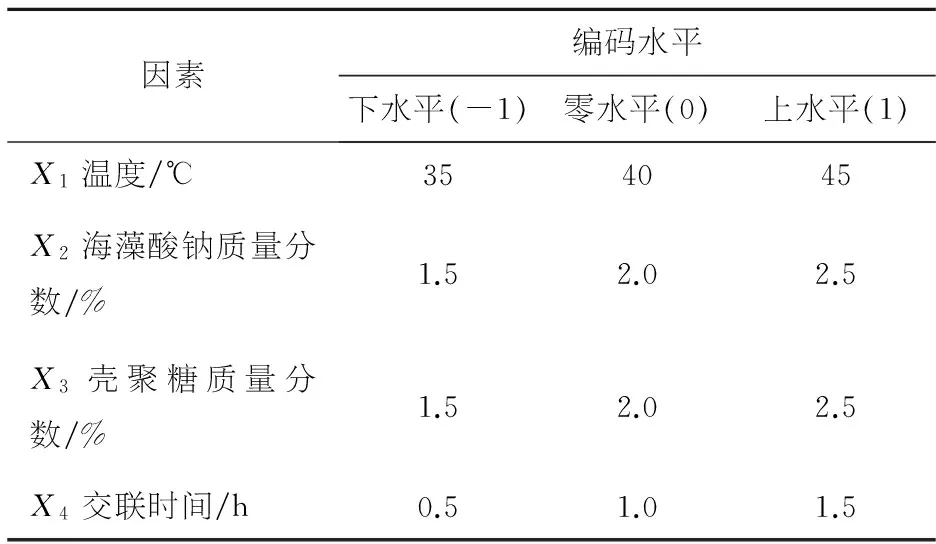
表1 试验设计因素水平及编码
1.3.7最优条件的验证试验
通过响应曲面试验得到最优化条件后,在此最优化条件下,重新制定最优的固定化酶,并进行此时固定化酶的酶活以及酶活力回收率的测定.将反应过后的固定化酶进行回收,用蒸馏水冲洗干净,进行酶解反应(n=3),计算酶活力回收率,与之前各组酶活力回收率比较,验证最优条件.
2结果与讨论
2.1对硝基苯酚标准曲线的制定结果
以对硝基苯酚的浓度值作为横坐标,吸光光度值作为纵坐标,得到的标准曲线的回归方程为y=0.009 8x-0.001 7,相关系数R2=0.999 2.
2.2最适宜固定化载体的筛选结果
从表2中可以看出,以海藻酸钠-壳聚糖作为固定化β-葡萄糖苷酶的载体时,得到的酶活力回收率为61.43%,比分别以海藻酸钠或者是壳聚糖作为固定化载体的回收率都要高.结论与周亚军[8]相同.认为壳聚糖和海藻酸钠共用的新型复合载体(ACA)固定化酶的活性更高,更适合作为载体.

表2 不同载体对固定化酶的酶活力回收率的影响
2.3单因素条件的试验结果与分析
2.3.1壳聚糖质量分数对酶活力回收率的影响
由图1可以看出,壳聚糖溶液的适宜质量分数为1.5%~2.5%.这是因为当壳聚糖溶液质量分数<2%时,制备的交联微球可提供更多游离醛基,用以共价连接酶.所以会使得固定化酶的活力不断增大.但当质量分数>2%时,随着其再次不断增大,会使网状的连接越来越紧密,而使微球的空隙越来越小.这样使得酶进入微球的难度逐渐增大,固定化酶的结合率降低,从而降低固定化酶的催化活力,使得酶活力回收率又开始不断的下降.

图1 壳聚糖质量分数对固定化结果的影响
2.3.2海藻酸钠质量分数对固定化效果的影响
由图2可以看出,酶活力回收率随着海藻酸钠的质量分数的增大而增大,直至质量分数达到2%.当海藻酸钠的质量分数为2%时,此时酶活力回收率的值最大,为68.15%.当海藻酸钠的质量分数再次增加时,酶活力回收率不再增加,反而出现下降的现象.所以海藻酸钠最佳的质量分数在1.5%~2.5%之间.

图2 海藻酸钠质量分数对固定化结果的影响
2.3.3交联时间对酶活力回收率的影响结果与分析
由图3可以看出,最佳的交联时间在0.5~1.5 h之间,当交联时间较短,小于1 h时,固定化不完全.当交联时间在0.5~1 h时,随着时间的延长,使固定化酶很好的结合,凝胶效果也越来越好,酶分子流失的较少,所以使得酶活力回收率会逐渐的增大.当交联时间为1 h时,凝胶效果最好,固定化结果最佳.但当交联时间大于1 h时,交联程度会逐渐变高,凝胶所形成的网络结构会越来越紧密,从而限制酶促反应的效率,部分酶也会因此失活.
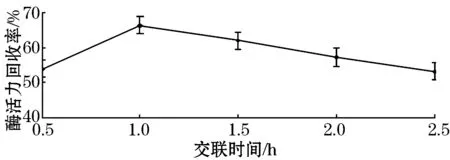
图3 交联时间对固定化结果的影响
2.3.4反应温度对酶活力回收率的影响结果
由图4可以看出,当温度为35~40 ℃时,随着温度的升高,酶活力回收率会逐渐的变大.当温度为40 ℃时,酶活力回收率达到最大值.但当温度再逐渐升高时,酶活力回收率会逐渐降低,所以最佳的反应温度为35~45 ℃之间.
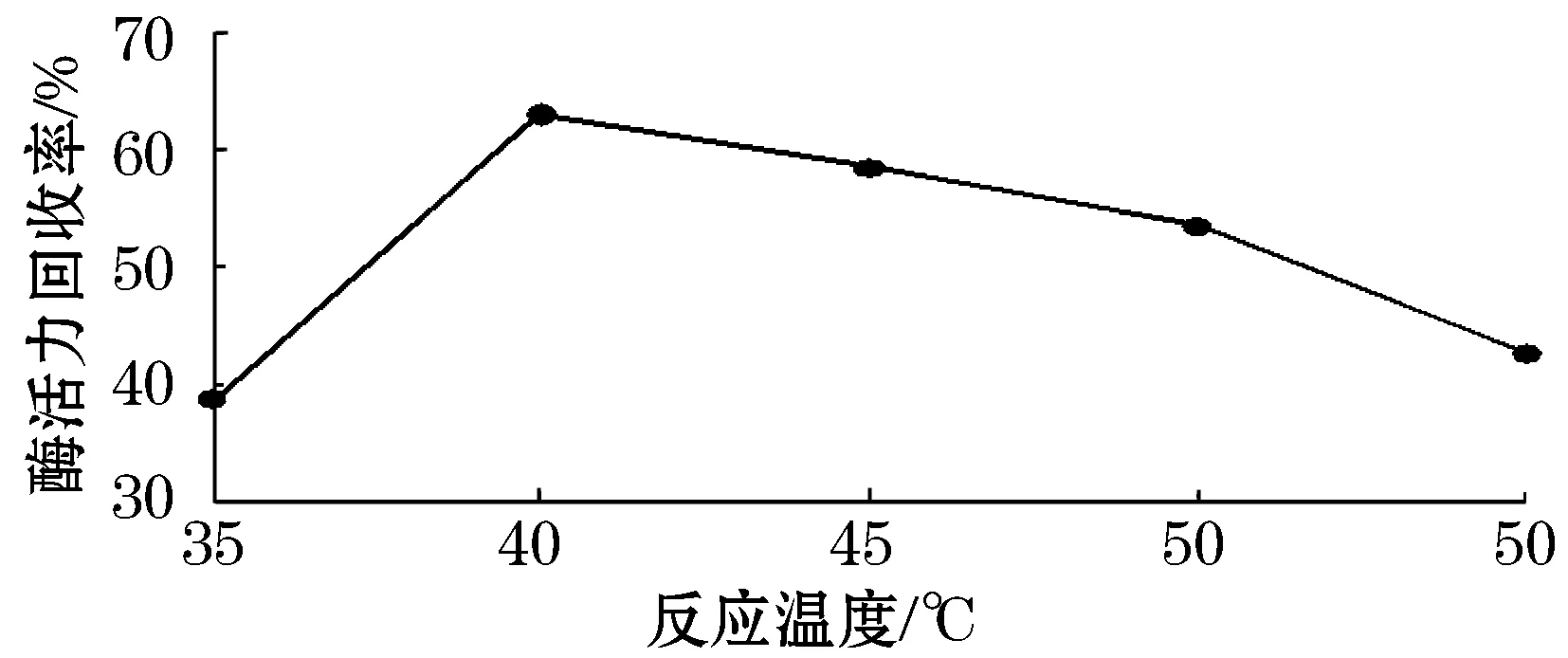
图4 反应温度对固定化结果的影响
2.4响应曲面法确定最优固定化条件的结果
2.4.1响应曲面法优化固定条件的结果
见表3.利用Design Expert 软件对表3响应曲面法试验设计结果的数据进行了多元回归拟合分析,得到了酶活力回收率的回归方程:
Y=65.77+0.81X1-4.93X2-3.15X3+0.80X4+1.32X1X2-0.61X1X3-1.57X1X4-4.28X2X3+0.40X2X4+1.34X3X4-14.86X12-13.44X22-13.78X32-11.84X42

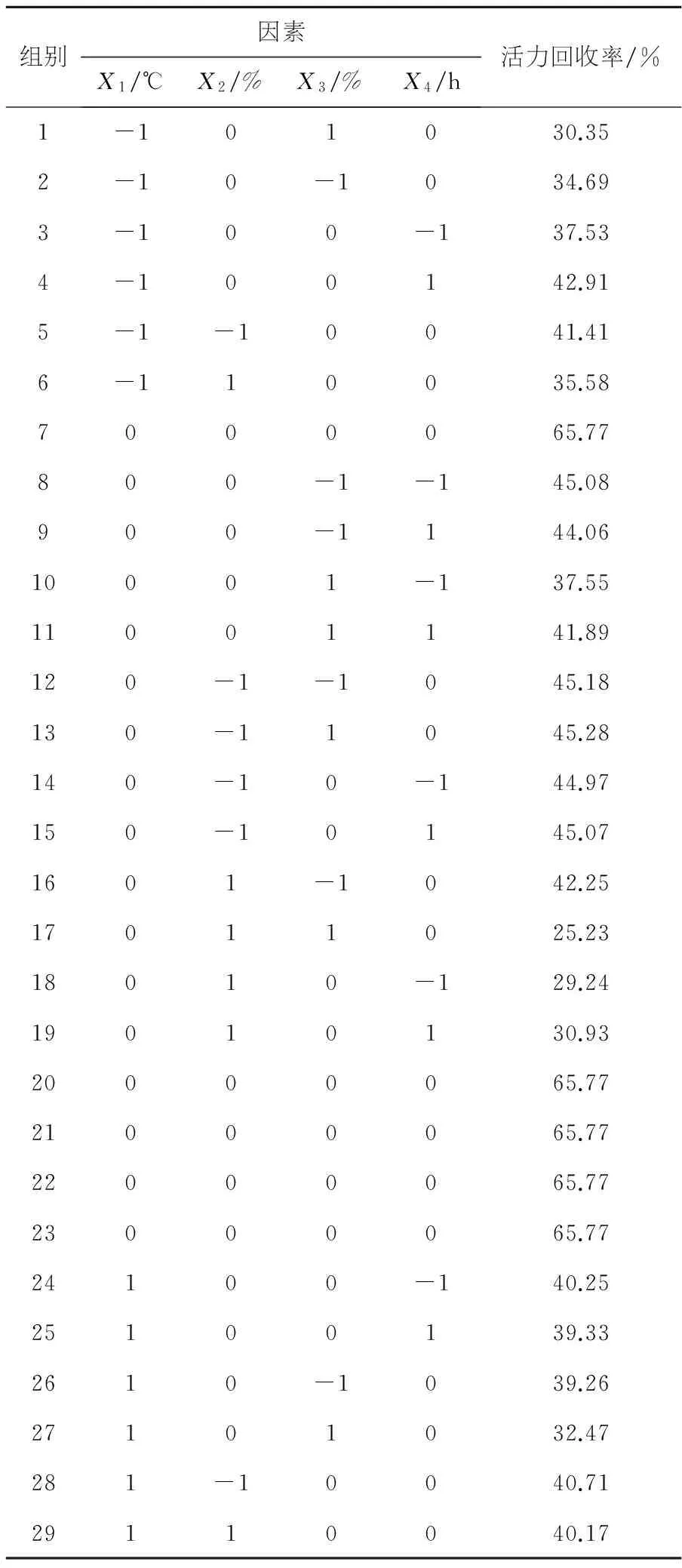
表3 响应曲面法试验设计结果
2.4.2酶活力回收率模型及回归方程系数的显著性检验


表4 酶活力回收率回归方程系数
2.4.3酶活力回收率的响应面分析
见图5~10.得出的最优化固定条件为海藻酸钠质量分数为1.91%、壳聚糖质量分数为1.94%、反应温度为40.20 ℃、交联时间为0.98 h.且海藻酸钠质量分数、壳聚糖质量分数和海藻酸钠壳聚糖交互作用为本试验的显著因素.在此最优化固定条件下,酶活力回收率为66.18%.试验结果具有显著性,可作为工业生产或研究试验的条件.
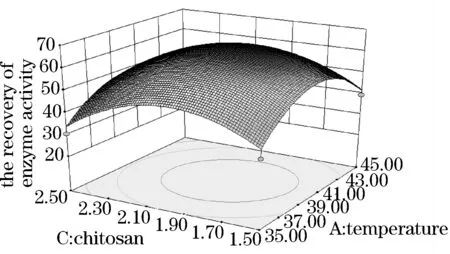
图5 反应温度与海藻酸钠质量分数的交互作用
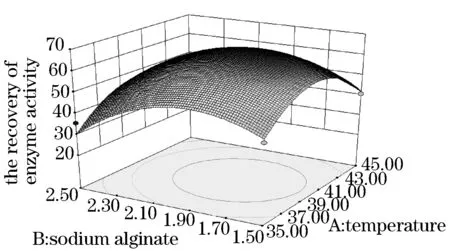
图6 反应温度与壳聚糖质量分数的交互作用

图7 反应温度与交联时间的交互作用

图8 海藻酸钠质量分数与壳聚糖质量分数的交互作用
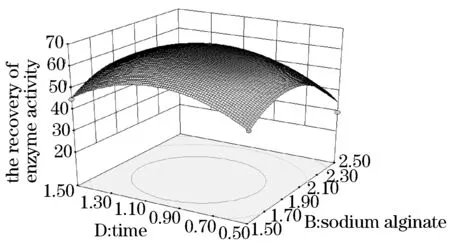
图9 海藻酸钠质量分数与反应时间的交互作用
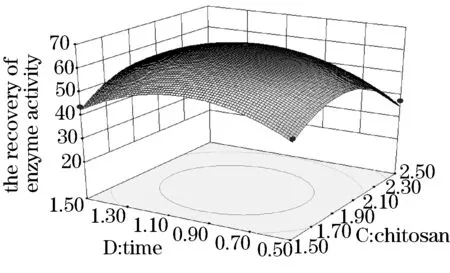
图10 海藻酸钠质量分数与反应时间的交互作用
2.5验证试验结果
在最优化矫正条件下壳聚糖质量分数2%,海藻酸钠质量分数2%,交联时间1 h,反应温度40 ℃下,进行最优结果的测定,并把反应过后的固定化酶反复回收3次进行回收试验,具体试验结果如表5所示.
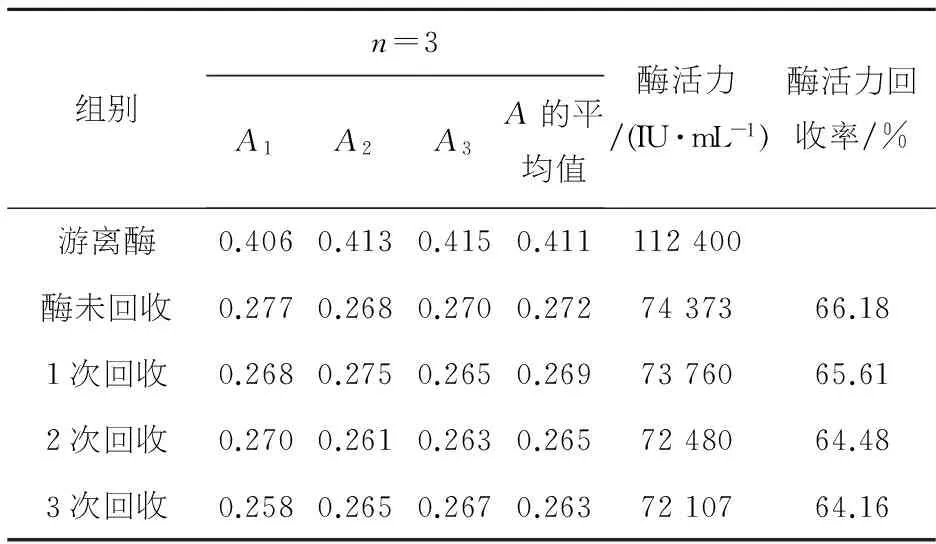
表5 最优条件下以及固定化酶的回收试验结果
由表5可以看出,在响应曲面试验优化反应条件后,在最优化条件下,得到的酶活力回收率为66.18%.在进行29组响应曲面试验时,最好的酶活力回收率为65.77%(P<0.0001),具有极显著性.将反应过后的固定化酶反复回收,得到的酶活力回收率分别为65.61%、64.48%、64.16%.
3结 论
本试验先对游离酶进行包埋,后进行交联反应,使固定化效果更好.选取载体浓度、反应温度、交联时间为单因素条件.且得到最适宜的固定化条件为海藻酸钠质量分数为2%、壳聚糖质量分数为2%、反应温度为40 ℃、交联时间为1 h.在此条件下,酶的固定化效果最好、酶活力回收率的值最大,为61.43%.然后进行响应曲面条件优化试验时,得出的最优化固定条件为海藻酸钠质量分数为1.91%、壳聚糖质量分数为1.94%、反应温度为40.20 ℃、交联时间为0.98 h.且海藻酸钠质量分数和壳聚糖质量分数为本试验的显著因素.在此最优化固定条件下,做验证试验,酶活力回收率为66.18%.试验结果具有显著性,可作为工业生产或研究试验的条件.将反应过后的固定化酶进行重复回收试验,分别得出酶活力回收率为65.61%、64.48%、64.16%.固定化效果浮动不大,所以固定化效果较好.
参考文献:
[1]张庆华, 李世杰, 涂国全, 等. 细菌HGS-3产β-葡萄糖苷酶发酵条件的优化[J]. 中国酿造, 2007(11): 12-16.
[2]石彩蕊, 王义强, 陈介南, 等. 产β-葡萄糖苷酶微生物育种研究进展[J].生物技术通报, 2011(3): 59-65.
[3]李英波,吴国林.β-葡萄糖苷酶及酶固定化研究进展[J]. 茶叶通报, 2004, 26(1): 21-22.
[4]张正竹, 李英波, 苏二正, 等.β-葡萄糖苷酶的蚕丝素蛋白膜固定化及其性质研究[J]. 食品与发酵工业, 2004, 30(6): 6 -9.
[5]YAN T R. LIN C L. Purification and characterization of a glucose-tolerant beta-glucosidase from Aspergillus niger CCRC 31494 [J]. Biosc.i Biotech. Biochem, 1997, 61(6): 965 -970.
[6]CHANG M Y, JUANG R S. Use of chitosan-clay composite as immobilization support for improved activity and stability ofβ-glucosidase [J].Biochem.Eng.J, 2007, 35: 93 -98.
[7]JUANG R S, WU F C, TSENG R L. Use of chemically modified chitosan beads for sorption and enzyme immobilization [J]. Advances in Environmental Research, 2002, 6: 171 -177.
[8]周亚军, 王淑杰, 苏丹, 等.β-葡萄糖苷酶ACA微胶囊固定化实验研究[J]. 现代化工, 2009, 29(10): 51-54.
Optimization of immobilizatiedβ-glucosidase with response surface methodology
MA Hui-ling, LI Xiao-mei
(Key Laboratory of Food Science and Engineering, School of Food Engineering, Harbin University of Commerce, Harbin 150076, China)
Abstract:The entrapped immobilization method was used with Aspergillus niger β-glucosidase as a research object and the enzyme activity recovery rate as evaluation index. Sodium alginate, chitosan and sodium alginate-chitosan chitosan were selected as the carriers, and the effects of the entrapped immobilization were compared. The Results showed that sodium alginate chitosan was the best supporter. Immobilization conditions of single factor and response surface experiment were performed, and the optimal conditions were obtained: the alginate mass fraction of the mixed carriers was 1.91%, the chitosan mass fraction of the mixed carriers was 1.94%, the temperature was 40.20 ℃, and the crosslinking time was 0.98 h. At this time, the enzyme activity was 112 400 IU/mL, and the recovery of the enzyme activity was 66.18%. After the three recovery experiments the recoveries of the enzyme activity were 65.61%, 64.48% and 64.16%.
Key words:β- glycosides; immobilization;enzyme activity recovery;sodium alginate; chitosan
收稿日期:2015-08-20.
基金项目:黑龙江省科技厅应用技术项目(G013B203);黑龙江省高校科技创新团队建设计划项目(2010td04)
作者简介:马慧玲(1988-),女,硕士,研究方向:食品科学.
中图分类号:S2
文献标识码:A
文章编号:1672-0946(2016)03-0357-06

