百里醌抑制乳腺癌血管生长的实验研究*
吴志豪, 李香利, 郑 敏
(温州医学院附属第二医院乳腺外科,浙江 温州 325000)
百里醌抑制乳腺癌血管生长的实验研究*
吴志豪△,李香利,郑敏
(温州医学院附属第二医院乳腺外科,浙江 温州 325000)
[摘要]目的: 探讨百里醌对乳腺癌血管生长的作用于及其机制。方法: 不同浓度百里醌作用于人脐静脉内皮细胞(HUVECs)及人乳腺癌细胞株MCF-7后,应用CCK-8法检测细胞活力,流式细胞术检测细胞凋亡,小管形成实验检测内皮细胞体外小管形成能力,Western blot法检测内皮细胞中cleaved caspase-3、p-ERK及p-AKT的蛋白水平;建立裸鼠乳腺癌移植瘤模型,完全随机法分成对照组和百里醌组,免疫组织化学法检测乳腺肿瘤组织中CD31的表达,TUNEL法检测移植瘤细胞凋亡。结果: 百里醌(20~80 nmol/L)对MCF-7细胞生长无明显抑制作用,20 nmol/L、40 nmol/L和80 nmol/L百里醌作用于内皮细胞24 h后,细胞存活率分别为(74.3±5.9)%、(68.7±5.6)%和(47.9±4.3)%;20 nmol/L、40 nmol/L和80 nmol/L百里醌作用于MCF-7细胞24 h后,细胞凋亡率分别为(2.6±0.3)%、(2.4±0.3)%和(4.6±0.4)%,而相应的内皮细胞凋亡率分别为(21.5±3.7)%、(23.8±2.9)%和(27.8±3.1)%,内皮细胞较乳腺癌细胞对百里醌反应更敏感(P<0.05);20 nmol/L、40 nmol/L和80 nmol/L百里醌作用于内皮细胞1 h后,内皮细胞小管形成长度分别为(0.88±0.12)mm、(0.76±0.10)mm和(0.54±0.08)mm,与对照组相比,差异有统计学意义(P<0.05);80 nmol/L百里醌作用于内皮细胞24 h后,内皮细胞中cleaved caspase-3的水平上调, AKT和ERK磷酸化被抑制,与对照组比较差异有统计学意义(P<0.05);免疫组化检测移植瘤组织中CD31结果显示,百里醌组IA值明显少于对照组(P<0.05);TUNEL检测结果显示,百里醌组IA值明显增大(P<0.05)。结论: 百里醌可抑制体内外乳腺癌血管生长,降低p-ERK及p-AKT的水平可能是其作用机制之一。
[关键词]乳腺肿瘤; 百里醌; 内皮细胞; 肿瘤血管生成
肿瘤血管生成与恶性肿瘤发生发展密切相关,血管生成在肿瘤的起始到转移的过程中均起重要作用[1]。新生血管形成是由一系列步骤组成的生物学过程,包括内皮细胞增殖和迁移、血管管腔的形成与存活[2-3]。以肿瘤内皮细胞为靶点的抗血管生成治疗,具有高效、低毒及不易耐药等优点。
百里醌(thymoquinone, TQ)是一种生长于地中海和印度边界地带的草本植物-黑种草籽中提取出来的具有生物活性的成份,已有大量动物实验研究表明它的抗癌效果显著,目前已将其用于临床Ⅰ期试验[4-6]。但目前尚未有百里醌对肿瘤血管生长作用的系统性研究报道,因此,本研究将探讨低剂量百里醌对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)活力及体外小管生成的影响以及对人乳腺癌血管生长的影响及其可能机制。
材料和方法
1实验动物、主要药品和试剂
4~6周龄雌性BALB/c-nu/nu品系裸小鼠,无特定病原体级,体重(18.56±0.85) g,购自中科院上海动物实验中心,动物质量合格证号SCXK(沪)2007-0005。均在温州医学院动物实验中无特殊病原菌条件下分笼饲养。
百里醌购自Sigma;胎牛血清(fetal bovine se-rum,FBS)、含EDTA胰酶和RPMI-1640培养基购自Gibco;CCK-8细胞活性检测试剂盒购自Dojindo;人工基底膜购自BD;Ki-67和CD31多克隆抗体购自武汉博士德生物工程有限公司;ABC免疫组化检测试剂盒和AEC染色试剂盒购自华美生物工程公司;cleaved caspase-3、磷酸化的细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase,p-ERK)、p-AKT和β-actin抗体购自Epitomics;TUNEL试剂盒购自深圳晶美生物技术有限公司。百里醌用无水乙醇配制成10 mmol/L,-20 ℃保存,用时用不含血清的RPMI-1640培养基稀释成所需浓度。
2细胞分组及药物干预
人脐静脉内皮细胞和人乳腺癌细胞株MCF-7均购自ATCC,细胞生长于含10%胎牛血清的RPMI-1640培养基中,含1%的青-链霉素,在5% CO2、37 ℃培养箱内孵育,胰蛋白酶消化传代,取对数生长期细胞为实验对象。实验分组如下:对照组(1%乙醇)和百里醌低、中、高剂量(20 nmol/L、40 nmol/L和80 nmol/L)组,将上述细胞培养24 h后,再加入不同剂量百里醌作用,测定各项实验指标。
3实验方法
3.1细胞活力检测各组细胞经百里醌作用24 h后以0.05 %胰蛋白酶消化收集贴壁细胞,调整细胞浓度为5×108/L,接种于96孔细胞培养板中,每孔10 μL。同时设置空白调零组(不加细胞加入等量的无水乙醇),以及阴性对照组(加细胞加入等量的无水乙醇)。分组培养24 h、48 h和72 h后,更换新鲜培养液,每孔加入10 μL CCK-8试剂,于37 ℃孵育4 h,酶标仪450 nm下读取吸光度(A)值。细胞存活率(%)=(实验组A450值-空白调零组A450值)/(对照组A450值-空白调零组A450值)×100%。
3.2流式细胞术检测细胞凋亡将百里醌作用24 h后的细胞用胰酶消化,冷PBS洗涤2次后重悬并计数,1 000 r/min离心5 min,用500 μL binding buffer重悬细胞,加入5 μL Annexin V-FITC和5 μL PI,轻轻混匀后室温避光反应20 min,随即用流式细胞仪检测细胞凋亡。
3.3小管形成实验小管形成实验参照Yi等[7]的方法,4 ℃下在24孔板内用无血清RPMI-1640培养基及人工基底膜制备底层凝胶,铺平后置37 ℃培养箱内固定5 h。收集不同浓度百里醌作用1 h后的HUVECs,重悬后以每孔4×104个细胞接种于底层凝胶上,每组设5个复孔,24 h后在倒置显微镜下观察小管形成情况,以显微镜下能观察到完整连续的管状结构为小管形成判定标准,随机选取5个视野,应用ImageJ软件计算有效管腔结构的平均长度,并统计分析。
3.4Western blot检测蛋白的表达胰酶消化各组处理24 h后的细胞,经PBS洗涤后加入RIPA裂解液裂解细胞,提取上清液。用Bradford法测量蛋白浓度后取等量蛋白质样品(每孔20 μg),常规8% SDS-PAGE,半干转膜仪转膜,5%脱脂奶粉封闭,加入 I 抗(1∶1 000)于4 ℃下孵育过夜,HRP标记的羊抗兔IgG为 II 抗(1∶2 500)室温孵育1 h,ECL发光,条带曝光强度用Quantity One 4.6.2(Bio-Rad)软件分析,以β-actin为内参照,通过与内参照的灰度比,得出目的条带的相对表达水平。
3.5裸鼠乳腺癌移植瘤模型制备及分组参照刘岸等[8]的方法制备裸鼠移植瘤模型,共制备20只裸鼠,移植术后第3周将实验动物按完全随机法分成对照组和百里醌组,每组10只。手术后第3周开始给药,每周经灌胃给药3次,共2周。对照组给予溶媒(1%乙醇)每只0.2 mL;百里醌组给予百里醌10 mg/kg体重。术后第8周处死裸鼠,尸检裸鼠证实乳腺移植瘤成瘤率为100%,完整切除乳腺肿瘤组织后置4%多聚甲醛中固定,石蜡包埋,进行连续切片,烘干备用。
3.6免疫组织化学法检测裸鼠乳腺肿瘤组织中CD31的表达按照EnVision法的操作步骤进行免疫组化实验,每组选取5个标本经正常羊血清封闭非特异性抗原,加入 I 抗孵育过夜后,加入生物素标记的 II 抗,DAB显色,苏木精复染,脱水后封片。低倍镜(×100)下随机选择20个视野,图片结果用Image-Pro Plus 6.0 图像处理软件进行分析。
3.7 TUNEL法检测移植瘤细胞凋亡按TUNEL试剂盒说明书操作,在显微镜下观察,凋亡细胞判定标准为细胞核发生固缩、染色体凝集成块或边集、呈棕褐色染色,低倍镜(×100)下随机选择20个视野,图片结果用Image-Pro Plus 6.0 图像处理软件进行检测积分吸光度(integral absorbance,IA)值。
4统计学处理
实验所得计量数据均以均数±标准差(mean±SD)的形式表示,采用SPSS 11.0统计软件进行统计分析,两组间比较采用t检验,多组间比较采用单因素方差分析及SNK-q法进行统计分析,以P<0.05为差异有统计学意义。
结果
1百里醌对体外人脐静脉内皮细胞和人乳腺癌细胞株MCF-7活力的影响
百里醌(80 nmol/L)作用于MCF-7细胞24 h、48 h和72 h后,细胞存活率分别为(97.2±6.2)%、(95.7±7.7)%和(93.8±7.3)%,与对照组相比较,均无统计学差异;而不同浓度百里醌(20 nmol/L、40 nmol/L和80 nmol/L)作用于内皮细胞24 h后,细胞存活率分别为(74.3±5.9)%、(68.7±5.6)%和(47.9±4.3)%;作用48 h后,细胞存活率分别为(66.1±8.3)%、(53.7±3.4)%和(41.6±4.9)%;作用72 h后,细胞存活率分别为(54.4±4.6)%、(42.8±3.9)%和(38.7±4.1)%,与阴性对照组相比均有显著差异(P<0.05),呈明显剂量依赖性和时间依赖性,见图1。

Figure 1.HUVECs were treated with different concentrations of thymoquinone (TQ) for 24 h, 48 h and 72 h and analyzed for viable cells by CCK-8 assay. Mean±SD.n=3.*P<0.05vscontrol group.
图1不同浓度百里醌对人脐静脉内皮细胞存活率的影响
2百里醌对体外人脐静脉内皮细胞和人乳腺癌细胞株MCF-7凋亡的影响
流式细胞术结果表明,百里醌(20 nmol/L、40 nmol/L和80 nmol/L)作用MCF-7细胞24 h后,仅百里醌浓度为80 nmol/L时才对乳腺癌细胞凋亡有明显影响(P<0.05);不同浓度百里醌作用于内皮细胞24 h后,细胞凋亡率均显著高于MCF-7细胞(P<0.05),见图2。
3百里醌对内皮细胞体外小管生成的影响
如图3所示,百里醌短时间(1 h)作用于内皮细胞不仅可减少内皮细胞体外小管形成数量,而且影响内皮细胞管腔连续性,百里醌(20 nmol/L、40 nmol/L和80 nmol/L)作用于内皮细胞1 h后,内皮细胞小管形成长度分别为(0.88±0.12) mm、(0.76±0.10) mm和(0.54±0.08) mm,与对照组比较差异有统计学意义(P<0.01)。为排除百里醌抑制内皮细胞小管形成作用是由于百里醌的增殖抑制作用,本研究预实验表明,百里醌(80 nmol/L)作用于内皮细胞1 h对内皮细胞生长无明显影响。
4百里醌对内皮细胞中蛋白表达的影响
不同浓度百里醌作用内皮细胞24 h后cleaved caspase-3的蛋白水平随着百里醌浓度的增加而上调;而百里醌可呈浓度依赖性抑制HUVECs中AKT和ERK的磷酸化水平,与对照组相比较,差异均有统计学意义(P< 0.05),见图4。

Figure 2.The effects of thymoquinone (TQ) on the apoptosis of MCF-7 cells and HUVECs detected by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsMCF-7.
图2流式细胞术检测百里醌对人脐静脉内皮细胞和人乳腺癌细胞株MCF-7凋亡的影响
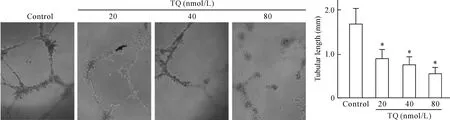
Figure 3.Thymoquinone (TQ) inhibited the tube formation of HUVECs (×200). Mean±SD.n=3.*P<0.05vscontrol group.
图3显微镜下观察内皮细胞小管形成

Figure 4.The effects of thymoquinone (TQ) on the protein levels of cleaved caspase-3, p-ERK and p-AKT in the HUVECs detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图4Western blot检测百里醌对内皮细胞中cleaved caspase-3、p-AKT和p-ERK蛋白水平的影响
5百里醌对裸鼠乳腺肿瘤组织中CD31的表达以及对细胞凋亡的影响
如图5所示,CD31阳性细胞表现呈胞膜为棕褐色;TUNEL染色阳性细胞表现为胞核呈棕褐色。免疫组化图片经过Image-Pro Plus 6.0 图像处理软件分析后,用IA表示染色阳性细胞的比例。与对照组相比较,百里醌组裸鼠肿瘤组织中CD31的阳性表达强度明显低于对照组,而百里醌组TUNEL阳性细胞明显高于对照组,差异均有统计学意义(P<0.05)。
Figure 5.Histology of the MCF-7 xenograft tumors upon staining with CD31 and TUNEL (×200). Mean±SD.n=3.*P<0.05vscontrol group.
图5免疫组化检测裸鼠肿瘤组织中CD31的表达和TUNEL检测细胞凋亡
讨论
新生血管形成即内皮细胞增殖并重新排列成新的血管的过程,抑制内皮细胞增殖并抑制其管腔形成可明显抑制肿瘤生长和转移,从而成为一种新的治疗恶性肿瘤的手段[9]。本课题组前期研究发现,百里醌对内皮祖细胞体外小管形成有一定抑制作用,同时百里醌对乳腺癌有一定抑制作用,并推测内皮细胞可能在百里醌抑制乳腺癌生长中发挥了一定作用,但作用机制尚不明确,为此本课题进一步探讨内皮细胞在百里醌调控乳腺癌血管生长中的作用。体外实验结果表明,百里醌可有效抑制体外内皮细胞增殖和小管形成,同时促进内皮细胞凋亡,显示出百里醌具有一定的抑制体外血管生成的作用,与文献报道相仿[5]。为了证实百里醌抑制恶性肿瘤生长是否主要通过抑制新生血管形成而实现,我们检测了相同浓度的百里醌对人脐静脉内皮细胞和乳腺癌细胞的作用效果,细胞活力和凋亡实验结果表明,内皮细胞10倍敏感于乳腺癌细胞对于百里醌的生长抑制和凋亡诱导作用。另外对体外内皮细胞中cleaved caspase-3的蛋白水平进行分析结果表明,百里醌可浓度依赖性促进内皮细胞中cleaved caspase-3的水平,从而首次表明百里醌可在较低浓度时抑制体外人脐静脉内皮细胞生长,增加cleaved caspase-3的水平可能是其抑制内皮细胞生长的作用机制之一。
在体内实验中,笔者建立起裸鼠乳腺癌皮下移植瘤模型,并使用相对低剂量(10 mg/kg体重)百里醌作用荷瘤裸鼠,实验表明百里醌可诱导肿瘤组织细胞凋亡;另外在百里醌给药期间,裸鼠无一例出现明显毒副反应,表明低剂量百里醌在对机体无明显影响的前提下可诱导肿瘤细胞凋亡,与文献报道相仿[7]。CD31作为黏附分子免疫球蛋白超家族的主要成员,可黏附于肿瘤细胞和血管内皮细胞上,从而在恶性肿瘤的新生血管形成和发展中发挥着重要作用[10]。在本研究中,对CD31进行免疫组化实验结果表明百里醌作用后裸鼠肿瘤组织中血管生成数量明显减少,从而表明抑制血管生长在百里醌抑制乳腺癌移植瘤生长中发挥了一定的作用,证实低剂量百里醌作为一种血管生成抑制剂的有效性和安全性。
当前已经证实通过抑制肿瘤血管生长可抑制肿瘤生长和转移,从而改善病人预后[11],而当前发现的血管抑制剂如COX-2抑制剂塞来昔布可引起粒细胞减少和贫血等毒副作用[12]。同时乳腺癌作为一种高度恶性肿瘤,治疗效果差,化疗药物剂量越小对患者的毒副作用越小,本研究体外实验表明脐静脉内皮细胞更敏感于乳腺癌细胞对百里醌的细胞毒作用,同时体内实验进一步表明低剂量百里醌作用裸鼠后对裸鼠无明显毒副作用,从而为临床应用极低剂量百里醌治疗乳腺癌奠定了一定理论基础。
AKT是一种丝氨酸/苏氨酸特异性蛋白激酶,在调控内皮细胞一系列重要功能诸如迁移、生长、增殖、凋亡以及新陈代谢中发挥了重要调控作用;同时AKT可调控内皮型一氧化氮合酶活性,从而刺激血管舒张、血管重塑以及新生血管形成[13];另外,AKT还可刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)和其它重要血管调控因子的分泌[14];同时活化的ERK可调控NF-κB和c-Jun等底物从而进一步调控血管生长[15];而ERK也同时为内皮型一氧化氮合酶激活所必须[16]。在本研究中,Western blot实验表明AKT和ERK在人脐静脉内皮细胞中磷酸化程度较高,而低剂量百里醌可部分抑制体外内皮细胞中p-AKT和p-ERK的水平,同时百里醌还能有效抑制内皮细胞增殖和小管形成,从而首次表明百里醌可能通过抑制AKT和ERK的激活从而抑制乳腺肿瘤中血管生成。
总之,本次实验系统性表明低剂量百里醌可明显抑制人脐静脉内皮细胞生长和小管形成,同时低剂量百里醌还可抑制体内乳腺癌血管生成,而百里醌抑制AKT/ERK信号通路可能是其抗血管生成效应的作用机制之一,展示了百里醌作为一种低毒高效的抗血管生长抑制剂的广阔前景。
[参考文献]
[1]Garofalakis A, Dubois A, Thézé B, et al.Fusion of [18F] FDG PET with fluorescence diffuse optical tomography to improve validation of probes and tumor imaging[J]. Mol Imag Biol, 2013, 15(3):316-325.
[2]左朝晖,邱晓昕,林劲冠,等. α干扰素和环氧合酶2抑制剂对裸鼠肝癌移植瘤生长和肿瘤血管生成的抑制作用[J]. 中华普通外科杂志, 2013, 28(12):956-960.
[3]高文宏,钟渝,乔璐,等. 微泡双重击破效应对裸鼠HepG2肿瘤微血管的损伤作用[J]. 中华超声影像学杂志, 2013, 22(2):166-169.
[4]木海琦,杨森,王怡君,等. 百里醌对人膀胱癌细胞体内外作用及其机制的研究[J]. 中华医学杂志, 2012, 92(6):392-396.
[5]沈为栋,尚雷,刘岸,等. 百里醌对人骨肉瘤SaOS-2细胞生长的抑制作用[J]. 中华实验外科杂志, 2011, 28(7):1054-1056.
[6]Alhosin M, Ibrahim A, Boukhari A, et al. Anti-neoplastic agent thymoquinone induces degradation of α and β tubulin proteins in human cancer cells without affecting their level in normal human fibroblasts[J]. Invest New Drugs, 2012, 30(5):1813-1819.
[7]Yi T, Cho SG, Yi Z, et al. Thymoquinone inhibits tumor angiogenesis and tumor growth through suppressing AKT and extracellular signal-regulated kinase signaling pathways[J]. Mol Cancer Ther, 2008, 7(7):1789-1796.
[8]刘岸,罗江,张坚红. 大黄素联合吉西他滨抑制体内外胰腺癌生长及其机制研究[J]. 中国中西医结合杂志, 2012, 32(5):652-656.
[9]Arafa el-SA, Zhu Q, Shah ZI, et al. Thymoquinone up-regulates PTEN expression and induces apoptosis in doxorubicin-resistant human breast cancer cells[J]. Mutat Res, 2011, 706(1-2):28-35.
[10]Jian W, Levitt JM, Lerner SP, et al. The angiopoietin-TIE2 pathway is a potential therapeutic target in urothelial carcinoma[J]. Anticancer Res, 2014, 34(7):3377-3382.
[11]Kerbel RS. Tumor angiogenesis[J]. New Engl J Med, 2008, 358(19): 2039-2049.
[12]Dragovich T, Burris H 3rd, Loehrer P, et al. Gemcitabine plus celecoxib in patients with advanced or metastatic breast adenocarcinoma: results of a phase Ⅱ trial[J]. Am J Clin Oncol, 2008, 31(2):157-162.
[13]刘俊,裘正军,江弢,等. Akt和磷酸化Akt在乳腺癌组织中的表达及意义[J]. 中华乳腺病杂志, 2010, 10(2):128-130.
[14]王晓燕,周永静,龚丹丹,等.VEGF基因沉默对乳腺癌细胞化疗敏感性和Akt信号通路的影响[J]. 中华乳腺病杂志, 2011, 11(2):95-97.
[15]Huang D, Ding Y, Luo WM, et al. Inhibition of MAPK kinase signaling pathways suppressed renal cell carcinoma growth and angiogenesisinvivo[J]. Cancer Res, 2008, 68(1):81-88.
[16]Wang H, Zhu HQ, Wang F, et al. MicroRNA-1 prevents high-fat diet-induced endothelial permeability in apoE knock-out mice[J]. Mol Cell Biochem, 2013, 378(1-2):153-159.
(责任编辑: 陈妙玲, 罗森)
Anti-angiogenic effect of thymoquinone on breast cancer
WU Zhi-hao, LI Xiang-li, ZHENG Min
(DepartmentofBreastSurgery,SecondAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:hosrml@qq.com)
[ABSTRACT]AIM: To investigate the anti-angiogenic effect of thymoquinone on human breast cancer and the possible mechanism. METHODS: The activities of human umbilical vein endothelial cells (HUVECs) and human breast cancer MCF-7 cells were assessed by CCK-8 assay. The apoptotic rate was measured by flow cytometry. Furthermore, the assay of capillary tube formation was used to observe the effect of thymoquinone on the tube formation of HUVECs. The protein levels of cleaved caspase-3, p-ERK and p-AKT were detected by Western blot. MCF-7 cells were subcutaneously injected into nude mice to establish breast xenograft tumors. After 3 weeks of implantation, the mice were randomized into control group and thymoquinone group. After the mice were sacrificed, immunohistochemistry was used to detect the expression of CD31 in the tumors, and the TUNEL test kit was used to explore cell apoptosis in the tumor tissues. RESULTS: Thymoquinone at concentrations of 20~80 nmol/L exerted no growth inhibitiory effect on MCF-7 cells. However, the cell viability of HUVECs were (66.1±8.3)%, (53.7±3.4)% and (41.6±4.9)% when the concentrations of thymoquinone were 20, 40 and 80 nmol/L, respectively. The apoptotic ratio of MCF-7 cells were (2.6±0.3)%, (2.4±0.3)% and (4.6±0.4)% and the apoptotic ratio of HUVECs were (21.5±3.7)%, (23.8±2.9)% and (27.8±3.1)% when the concentrations of thymoquinone were 20, 40 and 80 nmol/L, respectively. HUVECs were more sensitive to thymoquinone-induced apoptosis and inhibition in the cell activity than MCF-7 cells. Incubation of HUVECs with diffe-rent concentrations of thymoquinone (20, 40 and 80 nmol/L) for 1 h decreased their tube formation capacity (P<0.05). The protein level of cleaved caspase-3 was up-regulated, but the phosphorylation of AKT and ERK were inhibited in a concentration-dependent manner. The immunohistochemical analysis of CD31 showed significant difference of the integral absorbance between control group and thymoquinone group, and the TUNEL-positive cells in thymoquinone group was significantly more than that in control group. CONCLUSION: Thymoquinone has the anti-angiogenic effect on breast cancer both in vitro and in vivo, which may be related to the decreases in p-ERK and p-AKT.
[KEY WORDS]Breast neoplasms; Thymoquinone; Endothelial cells; Tumor angiogenesis
[文章编号]1000- 4718(2016)01- 0106- 06
[收稿日期]2015- 06- 23[修回日期] 2015- 10- 12
*[基金项目]温州市科技计划(No. Y20130278)
通讯作者△Tel: 0577-88002616; E-mail: hosrml@qq.com
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.018

