一种非手术性小鼠胚胎移植技术
段新崇,李阳,邸科前,黄勇,李相运
1 河北农业大学 动物科技学院,河北 保定 071001 2 河北大学 医学部实验动物中心,河北 保定 071001 3 重庆市畜牧科学院畜牧工程研究所,重庆 402460
一种非手术性小鼠胚胎移植技术
段新崇1,李阳1,邸科前2,黄勇3,李相运1
1 河北农业大学 动物科技学院,河北 保定071001 2 河北大学 医学部实验动物中心,河北 保定071001 3 重庆市畜牧科学院畜牧工程研究所,重庆402460
段新崇, 李阳, 邸科前, 等. 一种非手术性小鼠胚胎移植技术. 生物工程学报, 2016, 32(4): 440–446.
Duan XC, Li Y, Di KQ, et al. A nonsurgical embryo transfer technique in mice. Chin J Biotech, 2016, 32(4): 440–446.
摘要:为了提高非手术性小鼠胚胎移植技术的成功率,利用塑料移植导管模拟非手术胚胎移植过程,通过观察染料在子宫角的分布而评估胚胎移植效果,并在此基础上将自然妊娠3.5 d的小鼠囊胚经子宫颈移植受体小鼠。结果表明:将CD-1小鼠囊胚移植假孕2.5 d小鼠单侧子宫角,平均70.9%的胚胎能够发育至成活新生仔鼠,建立了高效非手术性小鼠胚胎移植技术。该方法简便快捷、不易污染、费用低,无需专业的手术器械,且符合实验动物伦理原则,完全可以取代手术法胚胎移植技术,更重要的是,它为人类和其他大动物的胚胎移植提供了研究模型。
关键词:小鼠,非手术性胚胎移植,囊胚,子宫损伤,胚胎丢失
Received: July 20, 2015; Accepted: October 10, 2015
Supported by: Natural Science Foundation of Hebei Province (No. C2012204047), Young Scientist Foundation of Hebei Province (No. C2014201186).
Yong Huang. Tel: +86-23-46792355; E-mail: huangyongcqbb@126.com
小鼠是发育生物学和生殖生物学研究的重要模式动物,其胚胎移植技术是体外受精、嵌合体、转基因、克隆、胚胎冷冻种子库等研究的关键环节[1]。小鼠胚胎子宫移植技术包括手术法和非手术法,手术法通过皮肤和肌肉的切口暴露子宫,然后将胚胎移植并缝合切口[2]。该方法繁琐费时且需要专用的手术器械,术后易感染并增加小鼠痛苦,而非手术法简单易行,节约时间,节约费用,对小鼠损伤小,不易感染,恢复快,对操作者专业技能的要求大大降低,同时也符合实验动物福利原则[3]。
早在1951年Beatty等就报道了非手术性小鼠胚胎移植技术[4],试图将胚胎移植导管穿过小鼠子宫颈而将胚胎植入子宫角,但受当时技术水平的制约,将59枚囊胚移植到13只受体小鼠,仅出生了5只小鼠,其移植成功率非常低,但却证明了小鼠非手术胚胎移植的可能性。1974年Marsk首次采用微量注射装置进行移植,以及1980年我国王培生也采用Marsk的移植装置进行移植,除了装置繁琐不易操作外,移植时易造成胚胎丢失,成功率为40%。1981 年Davis使用外径0.4 mm玻璃管进行移植,移植管进入受体鼠子宫角的长度为4 cm左右,对其损伤较大,成功率仅为30%。此后,多位研究人员对此方法不断进行改进[5-9],这些改进包括移植导管的材质、管径、质地、注射装置以及移植技术等方面,但移植成功率始终维持在35%左右,且结果不稳定。2009年,美国科学家申请了一项关于小鼠非手术胚胎移植技术的发明专利,且商业生产销售小鼠非手术胚胎移植导管NSET (Nonsurgical embryo transfer device),但该专利产品的致命缺陷依旧是胚胎移植成功率低且结果不稳定[10],这严重制约了该技术的推广和应用。本研究从移植导管的材质、质地、形状、管径、移植深度、胚胎数量、移植培养基体积、麻醉剂、假孕鼠天数以及移植技术等环节对该方法进行改进,以期建立高效小鼠非手术胚胎移植技术。
1 材料与方法
1.1小鼠
实验小鼠CD-1品系购自北京维通利华实验动物技术有限公司。所有小鼠均采用12 L:12 D循环光照 (6∶00−18∶00光照),清洁级小鼠房,温度22–25 ℃,湿度50%−60%,小鼠自由采食和饮水。
1.2胚胎与受体小鼠
通过观察外阴部的变化,挑选处于发情期的雌鼠 (4−8周龄) 与公鼠或者结扎公鼠在下午18∶00点合笼,次日清晨检查阴道栓,与公鼠合笼见栓的雌鼠当天记作妊娠0.5 d,在3.5 d时从子宫收集囊胚;与结扎公鼠合笼见栓的雌鼠当天记做假孕0.5 d,作为胚胎移植的受体。
1.3胚胎移植导管和移植溶液
小鼠非手术法胚胎移植导管由英国德萨生物科技有限公司 (Tirzah Biotech Limited, Oxford, United Kingdom) 提供,使用方法参照该公司的产品使用说明。胚胎移植液选择M2溶液[2]。
1.4非手术胚胎移植
将2.5 μL的移液器与胚胎移植导管连接,在显微镜下轻压移液器,缓慢将6–10枚囊胚吸入移植导管中。将受体小鼠置于鼠笼上,使其前爪紧抓住笼子,拇指和食指抓住小鼠尾根,轻轻提起。将开膣器插入小鼠阴道,在纤维冷光源下观察子宫颈口。将吸有胚胎的移植导管插入子宫颈并缓慢推入子宫角,当移植导管全部进入子宫后,迅速按压移液器按钮将胚胎移入子宫角,此时抓住尾根的拇指和食指同时抓住移植导管,另一只手缓慢旋转移液器,将移植导管和移液器分开,移植导管在小鼠子宫内保持 3 min后再取出 (图1)。并且以假孕2.5 d受体鼠的手术法囊胚移植作对照[2],并将不同时间的实验数据累计。

图1 小鼠非手术胚胎移植Fig. 1 Nonsurgical embryo transfer in mice. (A) An anesthetized recipient mouse. (B) Grasp the base of the tail using thumb and forefinger and speculum was inserted into vagina. (C) The device of transcervical embryo transfer were inserted into a uterine horn. (D) The device was keeping in the body of recipient for 3 min.
2 结果与分析
2.1移植导管造成子宫内膜损伤
在非手术法胚胎移植过程中,当移植导管穿过子宫颈进入子宫角时,很可能会对子宫内膜造成损伤,甚至扎穿子宫壁而进入腹腔。我们利用45只假孕2.5 d小鼠,模拟非手术胚胎移植过程,观察移植导管是否造成子宫内膜损伤。实验表明:45只小鼠单侧子宫角都出现不同程度的损伤,肉眼和显微镜下观察,子宫内膜出现一条红色的划痕 (图2A),划痕长度约0.6 cm,其中5只小鼠的子宫角被扎穿,且扎穿部位都位于子宫角后约1/3处子宫系膜的对侧(图3)。

图2 非手术胚胎移植造成小鼠子宫损伤Fig. 2 Uterine injury caused by nonsurgical embryo transfer catheter in recipient mice. The transfer device caused severe uterine injury (arrow) in nonanesthetized recipient (A) than that of anesthetized recipient (B).

图3 非手术胚胎移植导管在子宫系膜对侧扎穿子宫角Fig. 3 An antimesometrial puncture caused by nonsurgical embryo transfer catheter in recipient mice (2×).
2.2麻醉减轻移植导管对子宫内膜的损伤
胚胎移植导管对子宫内膜造成的损伤很可能会影响胚胎的着床和发育。将移植导管插入妊娠3.5 d的小鼠的任一侧子宫角,故意造成子宫内膜不同程度的损伤,10 d后观察胎儿发育状况。移植导管插入子宫的次数越多,造成子宫内膜的损伤越严重,从而导致胎儿发育严重受阻,并出现大量死胎 (图4)。因此,在胚胎移植过程中,应尽量减少移植导管反复插入子宫的次数。如果小鼠处于麻醉状态,子宫松弛,子宫壁的紧张程度降低,可能会减轻移植导管对子宫的损伤。利用1.25%阿佛丁麻醉剂,小鼠每10克体重腹腔注射0.2 mL进行麻醉,通过对18只假孕2.5 d小鼠麻醉实验发现:麻醉显著减轻移植导管对子宫内膜的损伤 (图2B),且没有出现移植导管扎穿子宫壁的现象。

图4 非手术胚胎移植导管影响小鼠胎儿发育Fig. 4 Nonsurgical embryo transfer catheter caused uterine injury and then impaired fetal development. For catheter, single insert in uterine horn slightly impaired fetal development (A, right horn), and three time inserts caused severe fetal death (B, left horn).
2.3胚胎在子宫内的迁移运动
胚胎移入子宫后,随着移植导管的后退,胚胎是否会溢出子宫角而迁移至子宫颈或者阴道内,这是影响胚胎着床发育的重要因素。为了评估胚胎移入后在子宫内的迁移状况,我们利用移植导管将1%的台盼蓝染液移入36只假孕2.5 d的小鼠单侧子宫,通过观察染液在子宫内的分布状况而推测胚胎的迁移运动范围。实验发现:在36只小鼠中都存在染液伴随移植导管后退而向后迁移的现象 (图5A):只有3只小鼠的染料靠近子宫中段,16只染料充满子宫中后段,9只染料在子宫后段并且将子宫颈也染成了蓝色,8只染料在整个子宫角均有分布。据此我们推断,胚胎移入子宫后也会伴随移植导管的后退而向后迁移,增加胚胎迁移至子宫颈和阴道的可能性,降低胚胎着床率。提高胚胎移入子宫后向卵巢方向迁移的可能性肯定会提高胚胎的着床和发育,不仅因为胚胎着床位置适宜,更重要的是靠近卵巢方向的子宫角没有受到移植导管的损伤,正如图2所示,移植管对子宫角的损伤大多都是在子宫系膜对侧靠近子宫颈一端1/3处。

图5 胚胎移植导管延迟退出抑制染料向子宫颈方向迁移Fig. 5 Migration of Trypan Blue dye to cervix was inhibited by delayed catheter withdrawal. After a mimical embryo transfer with trypan blue dye was completed, the dye can migrated to cervix while the catheter was immediately withdrawn from uterine horn (A). Contrary, the dye can significantly move to uterine oviduct end while the catheter was delayed to withdraw for three minutes from uterine horn (B).
2.4延迟移植导管退出促进胚胎向子宫卵巢端迁移
胚胎伴随移植导管的后退而向后迁移很可能会影响胚胎的着床和发育,为了阻止胚胎向后迁移,当注射胚胎后,将移植导管在子宫内停留3 min,这样可使胚胎因子宫收缩而向子宫角卵巢端迁移或者向移植导管内迁移,迁移到移植导管内的胚胎可再次被收集并移植另外受体小鼠,避免胚胎丢失。而迁移至子宫角卵巢端的胚胎由于不存在子宫内膜损伤而促进了其着床和发育。通过32只假孕2.5 d小鼠染料模拟胚胎移植过程发现:延迟移植导管退出可显著促进染料向子宫角卵巢端迁移 (图5B),相应地也会促进胚胎向子宫角卵巢端迁移。
2.5假孕鼠天数影响非手术性小鼠胚胎移植
利用染料模拟非手术胚胎移植过程,优化每个操作细节,减少移植导管对子宫的损伤,阻止胚胎伴随移植导管的后退而后移,防止胚胎丢失或者着床位置异常,然后,在此基础上,收集3.5 d小鼠囊胚分别移植假孕1.5 d、2.5 d、3.5 d和4.5 d受体小鼠,从表1可以看出,虽然不同天数假孕鼠都有仔鼠出生,但出生率差异显著,其中,2.5 d假孕鼠受体的移植成功率最高,将206枚囊胚移植到30只假孕2.5 d小鼠子宫内,有28只小鼠妊娠,妊娠率93.3%,共出生小鼠146只,出生率70.9%。作为对照组,利用手术法移植150枚囊胚至15只2.5 d受体子宫内,13只小鼠妊娠,共出生113只小鼠,出生率75.3%。
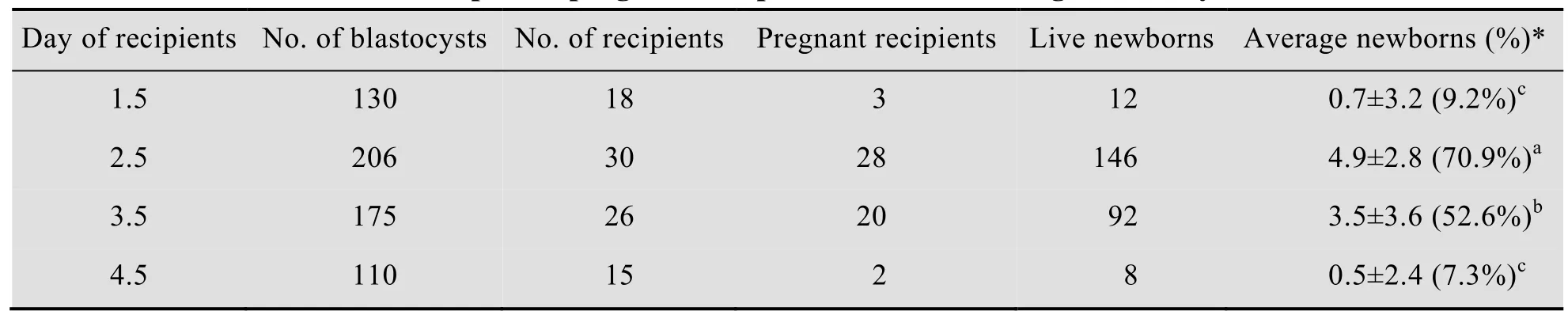
表1 不同假孕鼠对非手术性小鼠胚胎移植的影响Table 1 Influence of different pseudopregnant recipient mice on nonsurgical embryo transfer
3 讨论
本研究综合考虑移植导管、受体鼠、胚胎丢失、子宫损伤等因素,成功建立了高效简便的非手术性小鼠胚胎移植技术。利用该胚胎移植导管,将自然妊娠3.5 d小鼠囊胚经子宫颈移植假孕2.5 d受体小鼠子宫角,平均70.9%的囊胚能够发育至成活新生仔鼠,与手术法胚胎移植技术相比,该方法简便快捷、效率高、不易污染、费用低,且对小鼠损伤小,符合实验动物伦理法则,而且,该方法还为研究大动物和人类非手术胚胎移植技术建立了合适的模型。
非手术性小鼠胚胎移植技术早在1951年就有报道[4],其移植成功率始终徘徊在35%左右,且结果不稳定,这严重限制了该技术的推广应用[5-10]。与2009年Green发明的名为NSET小鼠非手术胚胎移植器相比[10],本研究的移植成功率 (70.9%) 显著高于NSET的移植成功率(45%)。为了排除胚胎自身质量对移植技术的影响,本研究仅将形态正常的自然妊娠3.5 d的小鼠囊胚移植到假孕鼠子宫角内,没有移植体外操作胚胎,如体外受精胚胎、体外培养培养、嵌合胚胎、冷冻和转基因胚胎等。本研究以及前期研究表明:不论是体内正常胚胎还是体外操作胚胎,非手术法和手术法胚胎移植的效率相当,小鼠非手术法胚胎移植技术完全可以替代手术法胚胎移植技术[9-13]。除胚胎移植外,还可利用该技术向小鼠子宫移植其他试验材料,如精液、药物等[14-15]。
小鼠子宫内膜非常脆弱,插入移植导管很容易造成内膜损伤,导管经过之处出现明显的淤血划痕,这必然影响胚胎着床[16-18],甚至造成着床后的胚胎早期死亡。如果将移植导管的前端烤至钝园,并结合移植手法和小鼠保定方法,即可最大限度减少子宫损伤。玻璃管和特氟龙管比较,后者比较软,可以减少移植过程中对子宫的损伤。根据小鼠子宫平均长度和所选导管的材质,确定移植导管长度为2.5 cm,若长度增加导致硬度不够会使移植导管不易进入子宫颈口,若长度减小导致硬度加大会使移植导管刺穿子宫的几率增加。根据小鼠子宫角在体内的位置,将移植导管弯曲30°的弧度,显著减小对子宫内膜的损伤及刺穿子宫角的可能性。
受体鼠体重在28−30 g合适,其子宫较大,子宫壁较厚,移植管造成的损伤较小且刺穿子宫壁的可能性降低,有利于提高胚胎移植成功率。虽然假孕1.5、2.5、3.5、4.5 d的母鼠都可以作为受体,但以假孕2.5 d的受体成功率最高[19-20]。非手术法胚胎移植由于很难分辨小鼠左右子宫角,所以只是随机单侧子宫角移植。同时,也无法排除子宫畸形或者异常的受体小鼠。本研究所用小鼠为CD-1品系,每胎平均产仔12只,依此确定非手术法移植胚胎的数目为每只受体6−8枚。
移植过程中胚胎丢失是造成移植成功率低下的重要原因,经过大量模拟研究发现:造成胚胎丢失的原因主要有三方面。一是由于子宫收缩蠕动将胚胎挤出子宫角造成丢失;二是由于移植导管后退而将胚胎带出子宫角;三是由于子宫颈粘液堵塞移植导管导致胚胎丢失。本研究相应地采用麻醉、延迟、疏通三种措施很好地解决了这些问题:受体鼠麻醉后减轻了子宫收缩并进而减轻移植导管对子宫造成的损伤;延迟移植导管退出子宫角阻滞了移入子宫角胚胎的后移;移植前先用另外一个不含胚胎的移植导管疏通子宫颈去除粘液,并且在移植导管的前端做一个1 mm的气泡保护胚胎,减少了胚胎丢失。
REFERENCES
[1] Nakagata N. Production of normal young following transfer of mouse embryos obtained by in vitro fertilization between cryopreserved gametes. J Reprod Fertil, 1993, 99(1): 77–80.
[2] Nagy A, Gertsenstein M, Vintersten K, et al.Manipulating the Mouse Embryo: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2003: 263–300.
[3] Zurlo J, Rudacille D, Goldberg AM. The three Rs: the way forward. Environ Health Perspect, 1996, 104(8): 878–880.
[4] Beatty RA. Transplantation of mouse eggs. Nature, 1951, 168(4284): 995.
[5] Marsk L, Larsson KS. A simple method for non-surgical blastocyst transfer in mice. J Reprod Fert, 1974, 37(2): 393–398.
[6] Wang PS, Yang XQ, Rong RZ. Study on the technology of early mouse embryo transfer. Hereditas, 1980, 2(5): 42–43 (in Chinese).王培生, 杨秀琴, 荣瑞章. 小鼠早期胚胎移植技术的研究. 遗传, 1980, 2(5): 42–43.
[7] Davis T. Nonsurgical transfer of mouse embryos. Bios, 1981, 52(3): 127–133.
[8] Van Der Hoeven FA, Schouten M, De Boer P. Embryo survival in pseudopregnant and in pregnant but genetically semi-sterile recipients after nonsurgical embryo transfer in the mouse. Theriogenology, 1991, 36(3): 463–475.
[9] Ali RB, Van Der Ahé F, Braumuller TM, et al. Improved pregnancy and birth rates with routine application of nonsurgical embryo transfer. Transgenic Res, 2014, 23(4): 691–695.
[10] Green MA, Bass S, Spear BT. A device for the simple and rapid transcervical transfer of mouse embryos eliminates the need for surgery and potential post-operative complications. BioTechniques, 2009, 47(5): 919–924.
[11] Cui LF, Zhang ZN, Sun FY, et al. Transcervical embryo transfer in mice. J Am Assoc Lab Anim Sci, 2014, 53(3): 228–231.
[12] Kaufman MR, Albers RE, Keoni C, et al. Important aspects of placental-specific gene transfer. Theriogenology, 2014, 82(7): 1043–1048.
[13] Steele KH, Hester JM, Stone BJ, et al. Nonsurgical embryo transfer device compared with surgery for embryo transfer in mice. J Am Assoc Lab Anim Sci, 2013, 52(1): 17–21.
[14] Stone BJ, Steele KH, Fath-Goodin A. A rapid and effective nonsurgical artificial insemination protocol using the NSET™ device for sperm transfer in mice without anesthesia. Transgenic Res, 2015, 24(4): 775–781.
[15] Barrette VF, Adams MA, Croy BA. Endometrial decidualization does not trigger the blood pressure decline of normal early pregnancy in mice. Biol Reprod, 2012, 86(3): 66–74.
[16] Goto Y, Noda Y, Shiotani M, et al. The fate of embryos transferred into the uterus. J Assist Reprod Genet, 1993, 10(3): 197–201.
[17] Dain L, Ojha K, Bider D, et al. Effect of local endometrial injury on pregnancy outcomes in ovum donation cycles. Fertil Steril, 2014, 102(4): 1048–1054.
[18] Li R, Hao GQ. Local injury to the endometrium: its effect on implantation. Curr Opin Obstet Gynecol, 2009, 21(3): 236–239.
[19] McGowen MR, Erez O, Romero R, et al. The evolution of embryo implantation. Int J Dev Biol, 2014, 58(2/4): 155–161.
[20] Han ZM, Cheng Y, Liang CG, et al. Nuclear transfer in mouse oocytes and embryos. Methods Enzymol, 2010, 476: 171–184.
(本文责编陈宏宇)
A nonsurgical embryo transfer technique in mice
Xinchong Duan1, Yang Li1, Keqian Di2, Yong Huang3, and Xiangyun Li1
1 College of Animal Science and Technology, Hebei Agricultural University, Baoding 071001, Hebei, China 2 Centre of Laboratory Animal Faculty of Medicine, Hebei University, Baoding 071001, Hebei, China 3 Institute of Animal Husbandry Engineering, Chongqing Academy of Animal Sciences, Chongqing 402460, China
Abstract:Although efficient nonsurgical transfer of embryos in mice would provide many advantages over a surgical method, the low success rate of nonsurgical transfer has hampered its acceptance and use. Here, a plastic catheter was usedto mimic embryo transfer process and then the transfer efficiency was evaluated by intrauterine trypan blue dye dispersion. Also 3.5-day blastocysts from natural pregnant mice were transferred through cervix into uterine horns. The results show that 70.9% of CD-1 mouse 3.5-day blastocysts transferred into unilateral uterine horns of pseudopregnant 2.5-day recipients can be developed to live newborns, and an efficient mouse nonsurgical embryo transfer technique was established. The technique was simple, rapid, inexpensive, unlikely to get contaminated, ethical and do not need specialized apparatus, and can completely replace surgical embryo transfer techniques. Moreover, the mouse nonsurgical embryo transfer technique provides a research model for human and other large animal embryo transfer.
Keywords:mouse, nonsurgical embryo transfer, blastocysts, uterine injury, embryo lost
DOI:10.13345/j.cjb.150333
Corresponding authors: Xiangyun Li. Tel: +86-312-7528459; E-mail: Lxyun@hebau.edu.cn

