比较溶液中微粒浓度大小
◇ 安徽 李 昆
比较溶液中微粒浓度大小
◇安徽李昆
电解质溶液中微粒大小比较的问题是高中化学的热点问题,也是高考化学复习的重难点.此类试题,由于涉及电离理论、水解理论、守恒思想、平衡思想、元素观、微粒观、定量观等理论知识和化学核心观念,可以有效测试综合应用能力和处理图表信息能力,因此已成为高考命题的热门.下面通过一个具体实例来分析:
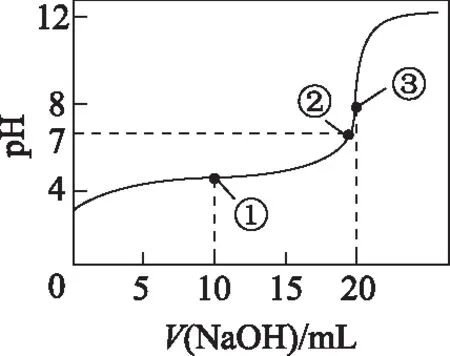
图1

(1)在此过程中,溶液中的溶质可能是什么?
(2)溶液的酸碱性如何?分析溶液中微粒浓度的大小关系.
(3)溶液中存在哪些微粒?分析醋酸钠溶液中的等量关系.
分析(1) 溶质为CH3COOH和CH3COONa(对应图中①、②点),溶质为CH3COONa(对应图中③点), 溶质为CH3COONa和NaOH(对应图中③点以后).
(2)① 酸性.
c(CH3COO-)>c(H+)>c(Na+)>c(OH-);
c(CH3COO-)>c(Na+)=c(H+)>c(OH-);
c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
② 中性.
c(Na+)=c(CH3COO-)>c(OH-)=c(H+).
③ 碱性.
c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
c(Na+)>c(OH-)=c(CH3COO-)>c(H+);
c(Na+)>c(OH-)>c(CH3COO-)>c(H+).
由上述可知,滴加NaOH溶液后,Na+和OH-浓度在溶液中逐渐变大,整个滴定过程呈现渐变量关系.
(3) 溶液中存在微粒CH3COOH、H2O、CH3COO-、Na+、H+、OH-,在醋酸钠溶液中存在的等量关系如下.
① 电荷守恒关系式
c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
② 物料守恒关系式
c(Na+)=c(CH3COO-)+c(CH3COOH);
③ 水电离的氢离子和氢氧根离子守恒关系式
c(OH-)=c(CH3COOH)+c(H+).

1) 分辨不清电解质溶液中的微粒是电离程度大还是水解程度大.单一弱酸酸式盐;若是NaHSO3、NaH2PO4等溶液,弱酸酸式根的电离程度大于其水解程度,溶液呈酸性;若是NaHCO3、NaHS等溶液,弱酸酸式根的水解程度大于其电离程度,溶液呈碱性.混合溶液:若是CH3COOH与CH3COONa、NH3·H2O与NH4Cl的混合溶液,CH3COOH或NH3·H2O的电离程度分别大于CH3COONa或NH4Cl的水解程度,溶液呈酸性;若是HCN与NaCN、HClO与NaClO的混合溶液,NaCN或NaClO的水解程度分别大于HCN或HClO的电离程度,溶液呈碱性.
2) 三大守恒分辨不清.电荷守恒的本质是电解质溶液总是呈电中性,电荷守恒式的直观识别方法是等号一侧全是阴离子,另一侧全是阳离子.物料守恒的本质就是元素守恒,可以理解为某粒子发生水解或电离后,微粒种类增多,但元素总是守恒的,物料守恒式的直观识别方法是等号两侧的微粒中分别含有同种元素.质子守恒(又称水的电离守恒)的本质就是水电离出来的H+浓度等于OH-浓度,质子守恒式的直观识别方法是等号一侧仅是H+或仅是OH-,质子守恒也可理解为电解质溶液中的粒子电离出的H+总数等于粒子接收的H+总数再加上游离的H+总数.
(作者单位:安徽省阜阳市临泉县第二中学南校)

