猫须草不同部位主要营养成分及抗氧化能力比较
薛惠琴,蔡 旋,熊慧慧,杭怡琼,肖长峰,卢永红
(上海市农业科学院畜牧兽医研究所,上海201106)
猫须草不同部位主要营养成分及抗氧化能力比较
薛惠琴,蔡 旋,熊慧慧,杭怡琼,肖长峰,卢永红*
(上海市农业科学院畜牧兽医研究所,上海201106)
摘 要:为比较猫须草不同部位的营养成分及抗氧化能力,采用常规方法测定猫须草根、茎、叶的基本营养成分及抗氧化成分含量,用比色法测定猫须草根、茎、叶50%乙醇浸提液体外抗氧化能力,用荧光探针法检测IPEC-J2细胞胞内NO自由基含量。结果表明:猫须草根、茎、叶基本营养成分及抗氧化成分含量差异较大;猫须草根、茎、叶50%乙醇浸提得率分别为9.52%、16.64%和16.70%,浸提液均具有良好的体外铁离子还原能力、超氧阴离子自由基及羟基自由基清除能力;对过氧化氢诱导的肠道上皮细胞NO自由基升高有缓解作用。猫须草叶体外抗氧化能力及清除胞内NO自由基能力优于根及茎。结果提示:根据猫须草各器官特点,针对性综合利用猫须草资源十分必要。
关键词:猫须草;营养成分;氧化应激;自由基
猫须草,又被称作“肾茶”,广泛种植于南亚、澳大利亚[1]及中国南部地区[2]。猫须草在南亚作为一种传统的茶饮而深受人们喜爱,但在中国,猫须草则更多是作为一种中草药用于治疗肾脏疾病、炎症、痛风以及糖尿病[3],其中以治疗肾病的报道尤为多见。近年来的研究发现,猫须草具有很好的抗氧化效果[4],而许多药用植物的药理作用都与其具有抗氧化效果相关[5]。
猫须草为多年生草本植物。叶片重量在整个植株中所占比例较小,且采摘不易,市场上所售的猫须草成品多为叶、茎混合品,而根部在加工切短环节即被抛弃。事实上,茎、叶混合品既不利于消费者泡饮和提高猫须草成茶品相,也无助于猫须草中有效成分的浸出。我国使用中草药饲料添加剂的历史由来已久。长期生产实践表明,一些中草药饲料添加剂能提高畜禽的生产性能,并起到免疫防病和改良品质的作用[6]。猫须草低廉的价格、良好的抗氧化性能和被广泛证实的安全性正是其作为良好的中草药饲料添加剂的基本保障。MALAHUBLAN等[7]将猫须草提取物在肉鸡饲料中添加,发现猫须草提取物添加能够增加肉鸡的日增重,并改善肉品品质。饲料添加剂对口感、品相的要求也较保健品低很多,猫须草保健茶饮加工后的副产物完全可以满足需求。因此,提升猫须草保健茶饮品质,并将其生产副产物作为动物饲料添加剂使用,将是一件既充分利用资源,又能获得良好经济效益的举措。
但是,目前尚未见到分别研究猫须草各个器官的报道,这对于猫须草的深加工和饲料资源利用均是不利的。对猫须草根、茎、叶的基本营养成分进行系统研究,比较各部分的活性,对于深入了解猫须草的性质,及猫须草各个部分的加工具有重要意义。本研究通过比较分析猫须草不同部位的主要营养成分、抗氧化成分及其水醇提取物的抗氧化能力,并分析其对氧化损伤的动物肠道细胞的修复作用,初步探讨猫须草加工副产物作为动物饲料添加剂的前景,为开发猫须草副产物动物饲料添加剂提供支持。
1 材料与方法
1.1猫须草样品及预处理
猫须草样品购自广西玉林中草药市场,为2015年新采植株。整株猫须草经自然晒干后,轻拍去除泥土,手工分离叶片、茎秆和根部,采用多功能高速粉碎机粉碎,过0.5 mm(32目)筛网,干燥器中保存待用。
1.2主要试剂
没食子酸标准品及芦丁标准品购自上海源叶生物有限公司;过氧化氢、2-脱氧-D-核糖、吩嗪硫酸甲酯(PMS)、还原型辅酶Ⅰ(NADH)、氯化硝基四氮唑蓝(NBT)购自Sigma公司;2-硫代巴比妥酸(TBA)购自阿拉丁试剂有限公司;DAF-FM DA购自碧云天生物研究所有限公司;DMEM培养基购自GE公司;胎牛血清购自Thermo公司。其他试剂均为国产分析纯,购自国药化学有限公司。
1.3细胞及培养方法
IPEC-J2细胞取自新生仔猪肠道上皮,由河南农业大学魏占勇教授馈赠。IPEC-J2细胞采用以DMEM/F12为基础培养基培养,添加10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素于37℃,5% CO2培养箱中培养。当细胞生长较密集时,胰酶消化传代。
1.4主要营养成分的测定
采用1.1处理的风干样进行主要营养成分的测定。水分采用直接干燥法测定;粗灰分采用灼烧法测定;粗纤维采用酸碱消煮法测定;粗脂肪采用索氏抽提法测定;粗蛋白采用凯氏定氮法测定。无氮浸出物经计算得出:无氮浸出物%=100%-(水分%+粗脂肪%+粗纤维%+粗蛋白质%+粗灰分%)。
1.5抗氧化成分的测定
酚类物质通常被认为是植物中主要抗氧化成分。
猫须草根、茎、叶样品按1∶20的固液比,加入50%乙醇,55℃超声波浸提30 min,中速定量滤纸抽滤,滤渣同样方法再次浸提,共提取3次。合并3次的滤液,旋转蒸发浓缩,真空冷冻干燥。提取物刮取后称重计算得率,猫须草根、茎、叶提取率分别为9.52%、16.64%和16.70%。采用50%乙醇复溶以进行总黄酮和总多酚的测定。
猫须草根、茎、叶中总黄酮含量的测定采用亚硝酸钠-硝酸铝法,以芦丁为标准品测定[8],总酚含量采用福林酚法,以没食子酸为标准品测定[9]。
1.6体外抗氧化能力测定
1.6.1还原能力 猫须草对铁离子的还原能力采用蔡旋等[10]的方法测定。还原力测定以普鲁士蓝Fe4(Fe(CN)6)的生成量作为指标,抗氧化剂将铁氰化钾还原,然后利用亚铁离子生成普鲁士蓝,在700 nm处此物质具有最大吸收峰。吸光值越大,说明样品还原力越强。采用传统比色法测定。20 μg/mL VC被作为对照。
1.6.2超氧阴离子自由基清除能力 猫须草对超氧阴离子的清除能力采用蔡旋等[10]的方法,超氧离子自由基在PMS-NADH系统中收集并通过NBT还原法检测。20 μg/mL VC被作为对照。超氧离子自由基清除率由以下公式表示:

式中A对照表示溶剂对照的吸光度;AOS表示不同浓度猫须草添加的吸光度,A空白为溶剂对照且不加NBT组。
1.6.3羟基自由基清除能力 猫须草对羟基自由基的清除能力采用蔡旋等[10]的方法,将脱氧核糖作为·OH攻击靶,利用Fe3+-EDTA-抗坏血酸-过氧化氢体系产生·OH,脱氧核糖在受到·OH攻击后会裂解,同TBA产生反应生成红色化合物。羟基自由基清除率由以下公式表示:

式中A对照表示溶剂对照的吸光度;AOS表示不同浓度猫须草添加的吸光度,A空白为溶剂对照且不加脱氧核糖组。
1.7胞内氮自由基清除能力
经方法1.5制得的提取物采用PBS溶解并滤菌待用。参照CAI等[11]的方法,IPEC-2细胞以2× 104/孔的密度种植于96孔黑色细胞培养板中,培养12 h使之贴壁,加入不同浓度的猫须草提取物。共同孵育12 h后,试验孔加入1 mmol/L过氧化氢,作用1 h,吸去培养基,37℃预温PBS洗2次,加入20 μL稀释好的DAF-FM DA探针,20 min后洗去,并立即采用荧光酶标仪测定荧光强度。以PBS代替提取物仅加入过氧化氢处理(H组)为阴性对照组,以PBS代替过氧化氢和提取物加入处理(C组)为空白对照组。结果以一氧化氮自由基清除百分率表示:

1.8数据分析
所有试验均进行3次重复,数据采用平均值±标准误表示。通过SPSS 22.0软件,利用Duncan法进行单因素方差分析,以P<0.05为差异显著性标志。曲线拟合采用Origin 8.0软件进行。
2 结果与分析
2.1猫须草根、茎、叶主要营养成分如表1所示,猫须草根和茎的营养成分相对接近,与叶的相差较大。根、茎中粗纤维含量极高,但粗蛋白、粗脂肪等含量相对较低,猫须草叶片中粗纤维含量不高,但粗蛋白含量达19.53%。三者粗灰分的含量亦有差异,以茎中含量最低(4.93%),叶中含量最高(9.07%)。提示在猫须草的使用及加工时需要根据其物理及营养成分来确定其适合的方案。
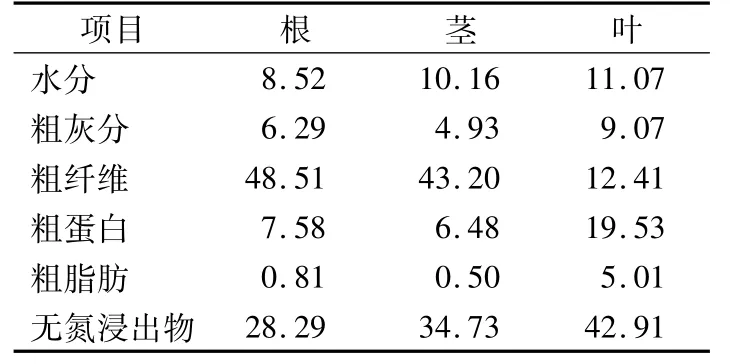
表1 猫须草(风干)主要营养成分含量Table 1 Contents of main nutrient components of Orthosiphon stamineus(dry) %
2.2猫须草根、茎、叶中多酚及黄酮含量
多酚及黄酮被认为是植物中主要的抗氧化成分。猫须草根、茎、叶中多酚(以没食子酸含量计)及总黄酮(以芦丁作为标准品)含量见表2。由表2可知,猫须草叶中多酚及黄酮含量均为最高,而茎中多酚及黄酮含量最低,根、茎、叶中多酚及总黄酮含量均存在显著差异(P<0.05)。

表2 猫须草中抗氧化成分含量Table 2 Content of antioxidant components in Orthosiphon stamineus mg·g-1干物质
2.3猫须草不同部位体外抗氧化能力的比较
猫须草根、茎、叶都有一定的铁离子还原能力,其中叶的铁离子还原能力较强,而茎和根的还原能力十分接近(图1)。猫须草根、茎、叶对超氧阴离子自由基有较强的清除能力(图2),其中叶的清除效果最佳,根、茎、叶对超氧阴离子自由基清除的半数有效剂量(EC50)分别为2 032.03 mg/kg、2 934.98 mg/kg、2 103.41 mg/kg;对于羟基自由基的清除能力,在低浓度(<150 μg/mL)同样是叶的清除效果最佳,但在高浓度(>200 μg/mL)下茎提取物的羟基自由基的清除能力较优,根提取物的羟基自由基的清除能力最低(图3)。综合还原能力、超氧阴离子自由基清除能力、羟基自由基的清除能力的结果可知,猫须草叶的体外抗氧化能力最佳,而根次之,茎最弱。因为本结果是已经换算成猫须草风干样后进行比较的,而叶、茎提取率较高,根的提取率远低于叶和茎,所以在提取物中的体外抗氧化能力以猫须草根提取物为最高,叶次之,而茎的抗氧化能力最弱。

图1 猫须草根、茎、叶的还原能力Fig.1 Reducting Power of roots,stems and leaves of Orthosiphon stamineus
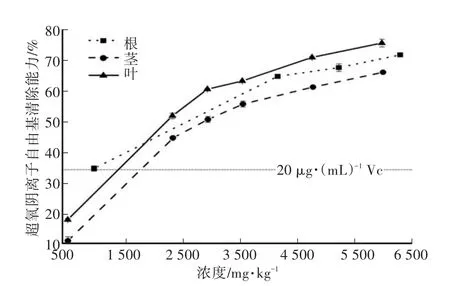
图2 猫须草根、茎、叶的超氧阴离子自由基清除能力Fig.2 Scavenging Oon the roots,stems and leaves of Orthosiphon stamineus
2.4猫须草提取物对肠道上皮细胞胞内氮自由基的清除作用
一氧化氮自由基既是一种重要的氮自由基,又是一种信号分子,NO自由基含量的增多往往关系到炎症的产生。如图4所示,300 mg/kg的猫须草根、茎、叶中所含成分对1 mmol/L过氧化氢诱导的IPEC-J2细胞中NO自由基均有一定清除作用。猫须草叶提取物的胞内NO自由基显著高于根和茎提取物。
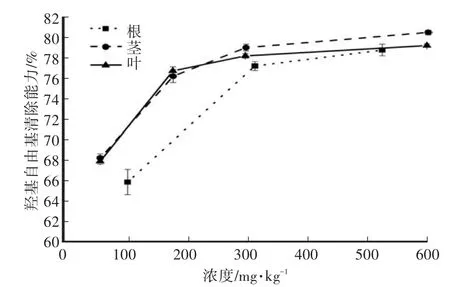
图3 猫须草根、茎、叶的羟基自由基清除能力Fig.3 Radical scavenging of OH on the roots,stems and leaves of Orthosiphon stamineus

图4 猫须草根、茎、叶的对IPEC-J2细胞胞内NO自由基的清除能力Fig.4 Radical scavenging of NO by IPEC-J2 cell on the roots,stems and leaves of Orthosiphon stamineus
3 讨论与结论
本试验研究表明,猫须草根、茎、叶的基本营养成分和抗氧化成分含量相差较大,叶片中蛋白含量丰富,总酚含量、总黄酮含量均较高,且叶片质地柔软,纤维素含量低,所含成分易溶出。以热水浸泡叶片时观察到茶汤呈淡黄色,有特殊香味,茶汤微苦,偏酸,但回味甘甜,适合作为日常的茶饮。本研究发现猫须草叶的体外铁离子还原能力、超氧阴离子自由基清除能力及羟基自由基清除能力均高于茎和根,可能与叶片中酚含量较高有关。同时胞内NO自由基清除能力也显著高于茎和根提取物。动物肠道上皮处于一个包含食糜、肠道微生物和各种消化液的高度复杂的微环境中,极易受到氧化应激和炎症影响[12]。上皮细胞IPEC-J2细胞是一种典型的非肿瘤化的传代上皮细胞,适合作为肠道上皮细胞氧化应激模型研究[13]。本研究也表明,猫须草提取物具有保护肠道上皮的作用。
猫须草茎秆部分在日常售卖的猫须草成品中所占比例极大,本研究在广西玉林中草药市场上随机购买了三份猫须草,通过手工分拣叶片后发现,其茎秆重量均占总重量的90%以上。但目前少有专门针对猫须草茎的研究,本研究表明,猫须草茎秆的粗纤维含量高达43.20%,为叶片含量的3倍以上,但蛋白含量仅为叶片的1/2。体外抗氧化能力分析表明,猫须草茎有一定的自由基清除能力,但清除率较叶和根的略低。同样以热水浸泡猫须草茎秆,发现茶汤色泽较淡,溶出较少,提示猫须草茎秆更适合提取加工使用。
我国使用猫须草作为药物的历史悠久[14],但多以茎、叶入药[15],东南亚各国,尤其马来西亚、菲律宾等国喜以猫须草叶为日常茶饮[2],未见猫须草根的研究报道。猫须草的根多在加工中被抛弃,市场上难以购买到,因此易被研究者所忽略。本研究发现,猫须草根中抗氧化成分含量较高,远高于茎中多酚及黄酮的含量,剔除提取率影响,则猫须草根提取物的体外抗氧化能力(铁离子还原能力、超氧阴离子自由基清除能力、羟基自由基清除能力)高于猫须草叶的体外抗氧化能力,对IPEC-J2细胞胞内自由基的清除能力也高于猫须草茎提取物。但本研究中,猫须草根采用50%乙醇提取的得率仅为9.52%,远低于茎(16.64%)和叶(16.70%)的提取率,这可能与猫须草根部木质化程度高,粗纤维含量较高(表1)有关。猫须草根经热水浸泡后色泽较等量茎浸泡后所得茶汤色泽更淡,基本无香味,且猫须草根部泥土难以除净,因此并不适合泡饮。该研究提示猫须草根是一种值得开发的资源,但提取方式应重新进行摸索,以提高提取率。
目前人类衰老、疾病及许多动物生产问题均已被证实与自由基代谢失衡相关,肠道氧化应激与炎症问题也是困扰动物生产的一大障碍,本研究已证实猫须草根、茎、叶提取物均具有自由基清除能力及肠道上皮细胞保护作用。但由于根、茎、叶的物理性质和营养成分的差异,不加区分的统一进行加工可能会不利于猫须草有效成分的充分利用和资源的合理配置。本研究提示,分离猫须草叶片作为日常茶饮,将茎秆、根部用作保健食品或饲料添加剂加工原料,并对茎秆、根分别采取针对性的提取工艺是一种更高效、合理的资源利用方式。
本试验表明,猫须草根、茎、叶基本营养成分及抗氧化成分含量差异较大,叶中粗蛋白、多酚及黄酮含量最高,而根和茎中纤维素含量较高。猫须草根、茎、叶50%乙醇浸提得率分别为9.52%,16.64%和16.70%,浸提液均具有良好的体外铁离子还原能力,超氧阴离子自由基及羟基自由基清除能力,对过氧化氢诱导的肠道上皮细胞NO自由基升高有缓解作用,猫须草叶体外抗氧化能力及清除胞内NO自由基能力优于根及茎。根据猫须草各器官特点,针对性综合利用猫须草资源十分必要。
参 考 文 献
[1]HSU C L,HONG B H,YU Y S,et al.Antioxidant and anti-inflammatory effects of Orthosiphon aristatus and its bioactive compounds[J].J.Agric.Food Chem.,2010,58(4):2150-2156.
[2]许娜,许旭东,杨峻山.猫须草的研究进展[J].中草药,2010,41(5):848-852.
[3]YAM M F,BASIR R,ASMAWI M Z,et al.Antioxidant and hepatoprotective effects of Orthosiphon stamineus benth.standardized extract[J].Am.J.Chin.Med.,2007,35(1):115-126.
[4]YAM M F,LIM C P,ANG L F,et al.Antioxidant and toxicity studies of 50%methanolic extract of Orthosiphon stamineus Benth[J].Biomed Research International,2013,2013(2):431-448.
[5]ABDELWAHAB S I,MOHAN S,ELHASSAN M M,et al.Antiapoptotic and antioxidant properties of Orthosiphon stamineus Benth(Cat’s Whiskers):Intervention in the Bcl-2-Mediated apoptotic pathway[J].Evidence-Based Complementary and Alternative Medicine,2011,2011:1-11.
[6]郑继方,刘汉儒.中草药饲料添加剂的配制与应用[M].北京:金盾出版社,2012.
[7]MALAHUBBAN M,ALIMON A R,SAZILI A Q,et al.Effects of andrographis paniculata and Orthosiphon stamineus supplementation in diets on growth performance and carcass characteristics of broiler chickens[J].Int.J.Agric.Biol.,2013,15(5):897-902.
[8]汤须崇,叶静,徐伟,等.猫须草总黄酮的超声提取工艺[J].食品与发酵工业,2011,37(11):229-234.
[9]WEI X L,CAI X,XIONG S L,et al.Hypoglycemic effect of oral crude tea flower polysaccharides on alloxan modeling Sprague-Dawley rats and the possible mechanism[J].CyTA-Journal of Food,2012,10(4):325-332.
[10]蔡旋,陈小连,杨帆,等.微生物源性抗氧化剂体外抗氧化能力的初步研究[J].生物技术,2011,21(6):84-87.
[11]CAI X,CHEN X L,WANG X C,et al.Pre-protective effect of lipoic acid on injury induced by H2O2in IPEC-J2 cells[J].Mol Cell Biochem,2013,378(1-2):73-81.
[12]蔡旋.基于自由基理论的仔猪肠道屏障断奶应激损伤机理研究[D].上海:上海交通大学,2015.
[13]蔡旋,王静娴,陈小连,等.肠道上皮氧化应激细胞模型的研究进展[J].畜牧兽医学报,2014,45(3):337-346.
[14]任文辉,洪俪芳.猫须草的药理作用研究进展[J].中草药,2013,44(20):2946-2950.
[15]蔡华芳,罗砚曦,钟宇森.民间传统药用植物肾茶(雅娜妙)的研究[C]//北京:中药药效提高与中药饮片质量控制交流研讨会论文集,2009:120-123.
(责任编辑:张睿)
Main nutrients and antioxidant capacity of Orthosiphon stamineus in different parts
XUE Hui-qin,CAI Xuan,XIONG Hui-hui,HANG Yi-qiong,XIAO Chang-feng,LU Yong-hong*
(Institute of Animal Husbandry & Veterinary Science,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China)
Abstract:In order to compare the nutritional components and antioxidant capacity of Orthosiphon stamineus in different parts.Basic nutritional components and antioxidant content in root,stem and leaf of Orthosiphon stamineus were determined by using conventional ways.Antioxidant capacity of Orthosiphon stamineus’s root,stem and leaf dissolved with 50%ethanol were extracted and determined by colorimetry.Nitric oxide free radical in IPEC-J2 cells content were determined by Steady-State Fluorescence.The results showed that the basic nutritional components and antioxidant components of Orthosiphon stamineus’s root,stem and leaf were obviously different.The extraction rate was 9.52%,16.64%and 16.70%.The extraction solution has good ability of iron ion reduction in vitro,and scavenging capacity of hydroxyl radical and superoxide radical.The effects of hydrogen peroxide on the NO free radical of intestinal epithelial cells were alleviated.The in vitro antioxidant capacity and the NO radical scavenging activity of leaves were superior to that of root and stem.The results suggested that the comprehensive utilization of Orthosiphon stamineus resources in the light of the characteristics of various organs was necessary.
Key words:Orthosiphon stamineus;Nutrients;Oxidative stress;Free radical
中图分类号:S567.23
文献标识码:A
文章编号:1000-3924(2016)03-030-06
DOI:10.15955/j.issn1000-3924.2016.03.06
收稿日期:2016-2-29
基金项目:上海市农委重点攻关项目[沪农科攻字(2013)第2-5号]资助
作者简介:薛惠琴(1970—),女,本科,实验师,研究方向:动物营养。E-mail:huiqinx888@qq.com
*通信作者,Tel:021-62207862,E-mail:luyonghong@163.com

