米曲霉葡聚糖酶基因(AoEGLAI)在毕赤酵母中的表达研究及其酶学特性分析
何永梅,王 波,李大伟,田永生,彭日荷*,姚泉洪*
(1上海海洋大学食品学院,上海201306;2上海市农业科学院生物技术研究所,上海201106)
米曲霉葡聚糖酶基因(AoEGLAI)在毕赤酵母中的表达研究及其酶学特性分析
何永梅1,王 波2*,李大伟1,田永生2,彭日荷2**,姚泉洪2**
(1上海海洋大学食品学院,上海201306;2上海市农业科学院生物技术研究所,上海201106)
摘 要:采用PTDS方法人工合成米曲霉葡聚糖酶基因(AoEGLAI),通过电击将其转化到毕赤酵母中表达,并采用DNS法对重组酶的酶学性质进行分析。结果表明:该酶耐酸但不耐热,最适反应温度为50℃,最适pH 为3.0,在30—45℃和pH 4—8时内切葡聚糖酶可保持90%以上酶活力,在底物CMC存在时其热稳定性有一定的提高。10 mmol/L的金属离子Cu2+、Ca2+、Zn+、Gr3+、Fe2+和Fe3+对酶有激活作用,Mn2+对酶则起抑制作用。该酶对胰蛋白酶有一定的抗性,对胃蛋白酶抗性相对较差。
关键词:米曲霉;内切葡聚糖酶;毕赤酵母;酶学性质
*共同第一作者
**通信作者,Tel:021-62203180,E-mail:pengrihe69@yahoo.com;E-mail:yao.quanhong65@yahoo.com
随着微生物食品生物工程技术的蓬勃发展,米曲霉(Aspergillus oryzae)作为发酵工业和食品加工业的重要菌种,日益受到广泛关注。米曲霉是一种好气性真菌,常见于粮食、发酵食品、腐败有机物、土壤等处[1]。米曲霉在调味品行业主要用于酿造酱油、豆豉、米酒等发酵食品,在酶制剂行业实现了工业化生产,部分用作食品添加剂;也用于生产天冬氨酸蛋白酶、嗜热碱性脂肪酶等异源蛋白及人溶菌酶和乳铁蛋白等医药蛋白[2]。此外,米曲霉及其提取物(如艾美福Amaferm)对牲畜、家禽的消化功能、生产性能有很大影响[3]。
2005年,米曲霉RIB40(ATCC42149)基因组测序工作由日本几家科研机构和企业联合完成,该菌株是研究米曲霉生理调控的模式菌株,测序结果表明米曲霉基因组有8条染色体[2]。常淑君等[4]于2014年成功构建了米曲霉RIB40的全长cDNA表达文库,为米曲霉功能基因的开发以及次生代谢产物合成途径相关基因的筛选与克隆奠定了基础。
米曲霉是一类产生复合酶的菌株,能分泌纤维素酶、蛋白酶、果胶酶、植酸酶等多种酶类[5]。纤维素酶是一个多组分酶系,包括内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶[6-7]。其中,内切β-葡聚糖酶能特异作用于β-1,4-糖苷键,水解纤维素分子内部的非晶体区或羧甲基纤维素中的长链纤维分子,进而产生大量小分子纤维素,所以内切葡聚糖酶是重要的工业用酶,不仅是提高酱油膳食纤维含量的一个关键酶[8],也可以作为饲料添加剂,除去饲料中的抗营养因子葡聚糖,提高饲料的转化率和动物的生长性能[9-10]。
常见的产β-葡聚糖酶的霉菌有康氏木霉、里氏木霉、瑞氏木霉和黑曲霉等[11]。β-葡聚糖酶在食品和饲料工业等方面有着广阔的应用前景,正逐渐成为当前研究的热点。近年来,国内有许多关于纤维素酶基因克隆与表达的报道,但对米曲霉产内切葡聚糖酶的研究较少。为此,本试验对来源于米曲霉的β-1,4-内切葡聚糖酶的酶学性质进行研究,以期为进一步探索酸性纤维素在食品工业中的应用奠定基础。
1 材料与方法
1.1材料
1.1.1菌株和质粒
大肠杆菌(Escherichia coli)DH5α菌株由本实验室保存;毕赤酵母Pichia Pastoris GS115和pPIC9K分泌型表达载体购自Invitrogen公司。
1.1.2酶和试剂
TaqDNA聚合酶、T4 DNA连接酶等工具酶购自上海生工;限制性内切酶、蛋白Marker购自TaKaRa公司;CMC-Na购自Sigma公司。
1.1.3培养基
LB、YPD、BMGY和BMMY培养基。
1.2方法
1.2.1AoEGLAI基因的合成和载体构建
按照毕赤酵母密码子偏爱,采用PTDS(PCR-based two-step DNA synthesis)方法进行米曲霉葡聚糖酶基因AoEGLAI的化学合成及优化[12],其信号肽及引物位置如图1所示。PCR扩增结束后将PCR产物凝胶回收并连接到pMD18-T载体上,转化大肠杆菌DH5α进行序列测定。测序正确的AoEGLAI经Bam HI和Sac I酶切后,连接到含有AOX启动子的毕赤酵母表达载体pPIC9K,得到重组质粒pYR1721进行毕氏酵母转化。

图1 AoEGLAI序列中信号肽及引物Fig.1 Signal peptide and primers in sequence of AoEGLAI
1.2.2毕赤酵母重组表达载体的电击转化
毕赤酵母菌株GS115于50 mL YPD培养基中30℃培养至OD600为1.1—1.3,离心收集菌体。用预冷的无菌水洗菌体,4℃、8 000 r/min离心去上清液,用20 mL预冷的山梨醇悬浮菌体,再离心收集菌体并用0.5 mL预冷的山梨醇悬浮。取80 μL菌液,加入2 μL经Sal I线性化的重组质粒pYR1721,冰浴5 min后电击,结束后立即加入0.8 mL预冷的0.6 mol/L山梨醇,混合后取200 μL菌液涂布于山梨醇平板上,30℃培养2—4 d直至转化子出现。
1.2.3重组毕赤酵母工程菌株的诱导表达
将阳性转化子接种于含25 mL BMGY培养基的250 mL摇瓶中,30℃、220 r/min摇床培养48 h。离心收集菌体,用无菌水洗3次,将菌体转移至25 mL BMMY诱导培养基中,30℃、220 r/min继续培养,每24 h补加250 μL 100%甲醇至终浓度为1%。将培养基于4℃、8 000 r/min离心5 min,收集上清,即为粗酶液。
1.2.4重组AoEGLAI的纯化及分析
取2 mL诱导后的粗酶液,首先通过由缓冲液A(50 mmol/L Tris-HCl,pH 7.5,300 mmol/L NaCl,10 mmol/L咪唑)平衡好的Ni柱,再经洗涤液B(50 mmol/L Tris-HCl,pH 7.5,300 mmol/L NaCl,20 mmol/L咪唑)洗涤,及洗脱液C(50 mmol/L Tris-HCl,pH 7.5,300 mmol/L NaCl,250 mmol/L咪唑)洗脱,最后由缓冲液D(50 mmol/L Tris-HCl,pH 7.5,0.1 mmol/L EDTA,10%甘油)进行透析。纯化后的重组AoEGLAI采用12%的SDS-PAGE进行分析,并通过考马斯亮蓝法测定蛋白含量。
1.3酶活力测定
采用DNS定糖法测定内切葡聚糖酶的活性[13]。具体操作如下:取0.07 mL粗酶液,加入0.07 mL 0.1 mol/L柠檬酸-0.2 mol/L磷酸氢二钠缓冲液(pH 5.0)及0.14 mL 1%溶于此缓冲液的CMC-Na,37℃反应1 h后,加入0.28 mL DNS试剂,煮沸10 min,在540 nm波长下测定光吸收值。每分钟产生1 μg葡萄糖所需要的酶量为1个酶活单位。
1.3.1重组AoEGLAI最适pH、pH稳定性、最适温度及温度稳定性测定
测定方法参考包文华等[14]。在pH 2、3、4、5、6、7、8及20℃、30℃、40℃、50℃、60℃、70℃、80℃的条件下测定重组葡聚糖酶AoEGLAI的活力,得到最适pH及最适温度。在此pH及温度条件下处理后测定剩余酶活力,得到重组酶的pH稳定性和温度稳定性。
1.3.2重组AoEGLAI在有底物保护条件下的热稳定性
酶与水溶的CMC-Na溶液混合后,以酶与同体积的水混合液为对照,于70℃处理10—60 min,间隔10 min取样,置于4℃,待所有样品处理完并降于相同温度后,对照加入1.5%的CMC-Na溶液,其余加入1%的CMC-Na溶液。37℃反应1 h后测活的样品与70℃处理后直接显色的样品对比。
1.3.3不同金属离子对AoEGLAI活性的影响
酶分别与终浓度为1mmol/L、10mmol/L的金属离子溶液CuSO4、CaCl2、Ca(NO3)2、Fe(NO3)2、MnSO4、ZnSO4、MnCl2、K2SO4、MgSO4、FeCl3、LiCl、CrCl3,及溶于pH 5.0缓冲液中的底物CMC-Na溶液混合后,37℃反应1 h,测定酶在上述反应体系中的活力。对照组为水,以其活力值为100%。
1.3.4蛋白酶对AoEGLAI活性的影响
酶分别与含量为5×10-4g的胃蛋白酶、胰蛋白酶及溶于pH 5.0缓冲液中的底物CMC-Na溶液混合后,37℃反应1 h,测定其活力。
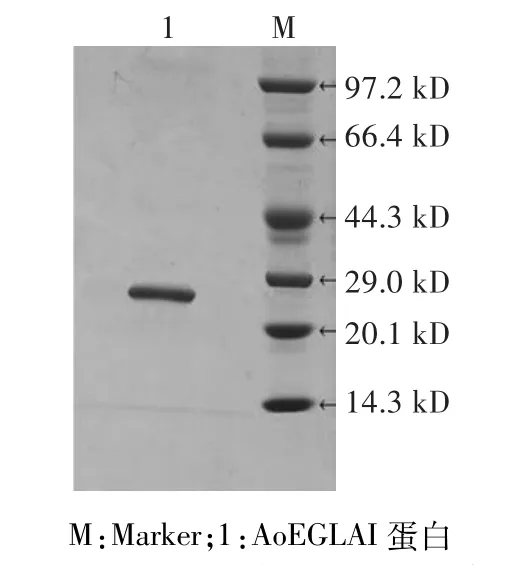
图2 AoEGLAI蛋白的SDS-PAGE检测结果Fig.2 SDS-PAGE detection result of AoEGLAI
2 结果与分析
2.1SDS-PAGE分析
粗酶液浓缩纯化后,进行SDS-PAGE分析,结果如图2所示。纯化后的蛋白条带单一,蛋白大小约为27 kD,与生物信息学预测一致,表明米曲霉内切葡聚糖酶在毕赤酵母中成功表达。
2.2最适pH和pH稳定性
如图3所示:重组AoEGLAI最适pH为3,在pH 2—4有80%的活力,pH 8时其活力剩余20%。如图4所示:处理1 h及4 h时,重组AoEGLAI分别在pH 3—8及pH 4—8仍有很高的活性(90%)。

图3 AoEGLAI的最适pHFig.3 The optimal pH of AoEGLAI

图4 AoEGLAI的pH稳定性Fig.4 pH stability of AoEGLAI
2.3最适温度和温度稳定性
如图5所示:重组AoEGLAI最适温度为50℃,在30—70℃有60%以上的活力。如图6所示:重组AoEGLAI在40℃处理10 min后其活性为80%,50℃处理10 min后其活性为40%,1 h后仅剩7%,活性下降较快,而70℃处理10 min后其活性基本丧失。

图5 AoEGLAI的最适温度Fig.5 The optimal temperature of AoEGLAI

图6 AoEGLAI的温度稳定性Fig.6 The temperature stability of AoEGLAI
2.4酶在有底物保护条件下的热稳定性
70℃处理后,经37℃反应1h并测活的样品与处理后直接显色的样品相比,热稳定性明显提高。如图7所示:重组AoEGLAI在70℃处理10 min后几乎无活性,而与底物CMC-Na混合后在相同的温度条件下处理,10 min后仍有30%以上的酶活力。
2.5不同金属离子对AoEGLAI活性的影响
如图8所示:用1 mmol/L的金属离子处理,除Mn2+对酶起抑制作用外,其他离子无明显作用;而在10 mmol/L下,金属离子Cu2+、Ca2+、Zn+、K+、Gr3+、Fe2+和Fe3+对酶有激活作用,Mn2+的抑制作用不如1 mmol/L时明显;Mg2+及Li+在两个浓度下对重组AoEGLAI均无明显影响。
2.6蛋白酶对AoEGLAI活性的影响
如图9所示:重组AoEGLAI在胃蛋白酶和胰蛋白酶作用下有一定程度的水解,其活性随着处理时间的延长逐渐下降。其中胃蛋白酶的水解作用较明显,酶活下降较快,而重组AoEGLAI对胰蛋白酶则有一定的抗性,作用6 h仍有70%的活性,处理24 h后仍有酶活。
2.7酶反应动力学参数
利用Lineweaver-Burk双倒数作图法,以反应速度的倒数(1/V)对底物质量浓度的倒数(1/S)作图,得到一条直线,如图10所示:该重组酶AoEGLAI的米氏常数Km =22.47 g/L,最大反应速度Vmax =1.22 g/(min·L),纯化后重组AoEGLAI的比酶活为2.7×105IU/mg。

图7 AoEGLAI在底物保护条件下的热稳定性Fig.7 Thermal stability of AoEGLAI under substrate protection

图8 不同金属离子对AoEGLAI的影响Fig.8 Effect of different metal ions on AoEGLAI

图9 胰蛋白酶和胃蛋白酶对AoEGLAI的影响Fig.9 Effect of trypsin and pepsin on AoEGLAI
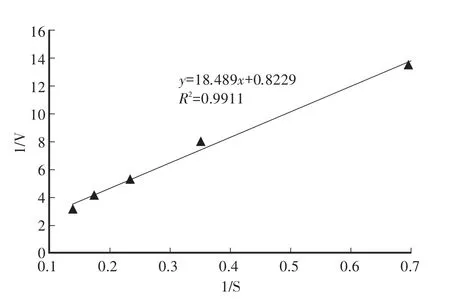
图10 酶的反应动力学参数Fig.10 Kinetic parameters of AoEGLAI
3 结论与讨论
自然界中存在众多能产生纤维素酶的生物,包括某些低等动植物、真菌、细菌和放线菌。纤维素酶的常见表达宿主菌包括大肠杆菌、毕赤酵母、真菌(如米曲霉)等,其中,甲基营养型酵母表达系统中的巴斯德毕赤酵母(Pichia pastoris)作为现代分子生物学研究中一种重要的工具模型,以其自身分泌的背景蛋白少,糖基化程度低,对营养要求低,可采用廉价的培养基,以及易于高密度发酵的优点[15],已成为异源表达最常用的一种表达系统。来源于芽胞杆菌、苜蓿根瘤菌、里氏木霉、草莓等的β-1,4-外切葡聚糖酶在毕赤酵母中的表达已有报道[9],本试验则对来源于米曲霉的内切葡聚糖酶的表达进行了研究。
不同来源的内切β-1,4-葡聚糖酶其性质相差甚远,真菌一般产酸性纤维素酶,本试验中所表达的来自于米曲霉RIB40的重组AoEGLAI最适pH为3.0,与大多数真菌所产纤维素酶为酸性的特征相符,且霉菌来源的AoEGLAI其pH稳定性范围较宽,与邹东恢等[11]报道一致。大多数内切葡聚糖酶最适温度为50—55℃,重组AoEGLAI最适温度为50℃,与Viikari等[16]报道的Trichoderma reesei类似,该酶的最适作用温度是50℃,在40℃条件下保存60%的剩余活力,且在有底物保护条件下稳定性还会有一定程度的提高。动物的体温在40℃左右,重组AoEGLAI若作为饲料添加剂,在通过动物的胃肠道时可在接近最适催化温度下发挥作用,对其酶活影响不大[17]。
韩学易等[18]对来源于米曲霉的giF-10重组内切葡聚糖酶的酶学性质进行了分析,与本试验重组AoEGLAI相比,其最适pH为4.0,虽同为酸性纤维素酶,但重组AoEGLAI对酸性环境的耐受力更强。重组giF-10的最适反应温度是45℃,略低于重组AoEGLAI的最适温度,且重组AoEGLAI的pH稳定性和温度稳定性均优于重组giF-10。黄君等[9]将黑曲霉L3内切葡聚糖酶在毕赤酵母中高效表达后获得重组酶EGI,其最适pH为5.0,不及重组AoEGLAI耐酸,但其最适反应温度为70℃,对高温的耐受能力明显强于重组AoEGLAI,故更适合作为啤酒工业的复合酶。乔宇等[19]研究了里氏木霉内切-β-葡聚糖酶II在毕赤酵母中的表达,其最适反应温度与重组AoEGLAI较为接近,最适pH则与黑曲霉L3重组EGI相同,均高于重组AoEGLAI。
金属离子对内切β-1,4-葡聚糖酶具有不同程度的影响,Mn2+对该酶起抑制作用,而10 mmol/L的金属离子Cu2+、Ca2+、Zn+、Gr3+、Fe2+和Fe3+则对酶有激活作用,这与彭维等[20]的研究结果不同,其报道中指出Mn2+激活效果显著而Cu2+起抑制作用,导致这种差异的原因可能是由于底物不同或者酶来源不同而产生的。
胃蛋白酶和胰蛋白酶均能降低重组AoEGLAI的活性,但重组AoEGLAI对两种蛋白酶有一定的耐受力,特别是胰蛋白酶,处理24 h后仍有活力。李卫芬等[21]在里氏木霉β-葡聚糖酶稳定性研究中提到,胃蛋白酶和胰蛋白酶对β-葡聚糖葡聚糖酶活几乎无影响;而孙建义等[22]在体外模拟动物胃肠条件下研究结果表明,胃蛋白酶对β-葡聚糖酶活无明显影响,而胰蛋白酶却有一定的促进作用。
参 考 文 献
[1]刘丽萍,刘丽华.米曲霉研究进展与应用[J].中国调味品,2008(4):28-32.
[2]李方方,潘力.米曲霉基因表达研究进展及应用[J].中国酿造,2008,27(12):1-3.
[3]孙安权,沙海锋.米曲霉提取物对瘤胃生态及奶牛生产性能的影响[J].乳业科学与技术,2006,119(4):184-186.
[4]常淑君,祖永平,陶波,等.米曲霉(Aspergillus oryzae)RIB40全长cDNA文库的构建[J].微生物学通报,2014,41(8):1485-1490.
[5]赵龙飞,徐亚军.米曲霉的应用研究进展[J].中国酿造,2006,25(3):8-10.
[6]BHIKHABAI R,JOHANSSON G,PETTERSON G.Isolation of celluloytic enzymes from Trichoderma reesei QM9414[J].Appl Biochem,1984,6(5/6):336-345.
[7]SCHULEIN M.Protein engineering of cellulases[J].BBA-Protein Struct Mol Enzymol,2000,1543(2):239-252.
[8]周雄川,李冬生,陈雄,等.米曲霉Y6产中性蛋白酶和内切葡聚糖酶的研究[J].中国酿造,2013,32(10):35-39.
[9]黄君,张昌毅,赵述淼,等.黑曲霉内切β-1-4-葡聚糖酶在毕赤酵母中的高效表达[J].华中农业大学学报,2008,27(5):611-615.
[10]OFFICER D I.Efect of multi-enzyme supplements on the growth performance of piglets during the pre-and postwean-ing periods[J].Animal Feed Sci Technol,1995,55:55-65.
[11]邹东恢,江洁.β-葡聚糖酶的开发与应用研究[J].农产品加工,2005(8):7-9.
[12]XIONG A S,YAO Q H,PENG R H,et al.PCR-based accurate synthesis of long DNA sequences[J].Nature Protocol,2006,1(2):791-797.
[13]陈红歌,朱静,梁改琴,等.黑曲霉木聚糖酶的纯化与性质[J].菌物学报,2000,19(1):111-116.
[14]BAO W H,PENG R H,ZHANG Z,et al.Expression,characterization and 2,4,6-trichlorop henol degradation of laccase from Monilinia fructigena[J].Mol Biol Rep,2012,39(4):3871-3877.
[15]娄瑞娟,罗利龙,张霞,等.巴斯德毕赤酵母表达系统的研究进展和前景展望[J].生物学杂志,2010,27(5):73-76.
[16]VIIKARI L,ALAPURANEN M,PURANEN T,et al.Thermostable enzyme in lignocelluloses hydrolysis[J].Adv Biochem Eng Biotechnol,2007 (108):121-145.
[17]魏晓飞,王在贵,陈键.β-葡聚糖酶的酶学性质研究[J].中国饲料,2007(9):17-19.
[18]韩学易,王春梅,陈惠.米曲霉giF-10内切葡聚糖酶基因的克隆表达及酶学性质分析[R].食品与发酵工业,2012,38(10):17-22.
[19]乔宇,毛爱军,何永志,等.里氏木霉内切-β-葡聚糖酶II基因在毕赤酵母中的表达及酶学性质研究[J].菌物学报,2004,23(3):388-396.
[20]彭维,欧爱芬.金属离子对酶活性影响研究[J].酿酒,2013,40(1):60-62.
[21]李卫芬,孙建义,顾赛红.里氏木霉β-葡聚糖酶稳定性研究[J].西南农业大学学报,2001,23(2):97-99.
[22]孙建义,李卫芬,顾赛红.体外模拟动物胃肠条件下β-葡聚糖酶稳定性的研究[J],中国畜牧杂志,2002,38(1):18-19.
(责任编辑:闫其涛)
Expression and characterization of recombinant endo-β-1,4-glucanase from Aspergillus oryzae in Pichia pastoris
HE Yong-mei1,WANG Bo2*,LI Da-wei1,TIAN Yong-sheng2,PENG Ri-he2**,YAO Quan-hong2*
(1College of Food Science,Shanghai Ocean University,Shanghai 201306,China;2Biotechnology Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China)
Abstract:The AoEGLAI gene was chemically synthesized by PTDS(PCR-based-two-steps DNA synthesis)strategy in this study.Then,the AoEGLAI gene was transformed into Pichia pastoris by electroporation and the enzymatic properties of recombinase were analyzed by DNS method.The results showed that the enzyme is acid proof but not heat resistant,the optimum temperature is 50℃,and the optimum pH is 3.The enzyme activity could be maintained 90%at 30—45℃and pH 4—8.In the presence of substrate CMC,the enzyme’s thermal stability improved.In addition,Cu2+,Ca2+,Zn2+,Gr3+,Fe2+and Fe3+of 10 mmol/L had active effects on the enzyme whereas Mn2+had inhibitory effect on it.This enzyme had certain resistance to trypsin,and relatively poor resistance to pepsin.
Key words:Aspergillus oryzae;Endo-β-1,4-glucanase;Pichia pastoris;Enzymatic property
中图分类号:Q78
文献标识码:A
文章编号:1000-3924(2016)03-018-06
DOI:10.15955/j.issn1000-3924.2016.03.04
收稿日期:2015-02-02
基金项目:上海市农业委员会重点项目(No.2011-1-8,2013D-8)
作者简介:何永梅(1988—),女,硕士,研究方向:生物化学与分子生物学。Tel:18935251120,E-mail:heyongmeiyaner@163.com

