血液透析患者踝臂指数与血磷水平的相关性分析
吴传林 韦海棠 胡海棠 李金梅 童晶晶
(顺德区第一人民医院附属陈村医院1内二科,2手术室,3肾内科,4血液净化中心,广东 佛山 528313)
·临床研究·
血液透析患者踝臂指数与血磷水平的相关性分析
吴传林1*韦海棠2胡海棠3李金梅4童晶晶4
(顺德区第一人民医院附属陈村医院1内二科,2手术室,3肾内科,4血液净化中心,广东 佛山 528313)
目的:通过分析血液透析患者踝臂指数(ABI)与血磷水平相关性,为临床下肢外周动脉病(PAD)的防治提供重要依据。方法:以本院2015年1月至2015年12月收治的200例终末期肾病维持性血液透析患者为研究对象,均行ABI测量,根据ABI测量结果将患者分为合并PAD组(ABI<0.9,40例)与非PAD组(ABI≥0.9,160例),测定并比较两组血脂、血压、血清肌酐、血磷、血钙等指标。结果:两组血压、血糖、血脂、血清肌酐、尿素氮各指标比较差异无统计学意义(P>0.05)。PAD组血磷、钙磷乘积、全段甲状旁腺素(iPTH)、超敏C反应蛋白(hsCRP)水平分别为(2.08±0.32)mmol/L、(56.4±5.6)mg2/dL2、(413.2±235.1)pg/mL、(8.0±1.2)mg/L,均明显高于非PAD组的(1.65±0.49)mmol/L、(44.1±8.8)mg2/dL2、(208.8±172.5)pg/mL、(3.5±1.3)mg/L(P<0.01)。Logistic回归分析血磷、钙磷乘积、iPTH及hsCRP是影响ABI的独立因素。结论:高磷血症、高iPTH及微炎症状态参与血液透析患者PAD发病进程。
血液透析;踝臂指数;血磷;下肢外周动脉病;相关性
动脉粥样硬化性疾病作为终末期肾病一种常见严重并发症,致使动脉闭塞性损伤,易引发下肢外周动脉病(peripheral arterial disease,PAD)及心脑血管疾病,是导致患者死亡的主要原因之一[1]。临床动脉粥样硬化常见症状为下肢外周动脉病变,据统计,>40岁肾功能不全血液透析患者PAD发生率高达24%,为此早期发现PAD并积极预防至关重要[2]。踝臂指数(ankle brachial index,ABI)是PAD筛查重要方法,通常ABI<0.9判断为PAD,且ABI对PAD诊断敏感度及特异度均较高(95%左右),同时ABI测量简单、无创且经济实惠,近年来终末期肾病维持性血液透析患者测量ABI病例越来越多。另外,有研究已证实高磷血症与维持性血液透析患者心血管疾病死亡呈正相关,患者血磷越高,死亡几率越大[3]。基于此,本研究重点分析终末期肾病维持性血液透析患者ABI与血磷水平的关系,以及时控制血磷水平,降低患者PAD发生几率。报告如下。
1 资料与方法
1.1 一般资料
选取本院2015年5月~2017年5月收治的终末期肾病维持性血液透析患者200例,血液透析2~3次/周,4 h/次。纳入标准:①既往慢性肾功能不全病史,且血液透析治疗持续中;②血液透析时间≥3个月;③获取医院伦理委员会批准,患者知情同意;④所有患者病例资料均完整。排除标准:①病例资料不完整;②合并恶性肿瘤、凝血系统疾病等患者;③精神异常、认知障碍者;④不符合纳入标准者。根据ABI测量结果将患者分为合并PAD组(ABI<0.9,n=40)与非PAD组(ABI≥0.9,n=160),合并PAD组中男23例,女17例;年龄43~67岁,平均(55.8±6.0)岁。正常组中男93例,女67例;年龄41~66岁,平均(54.6±7.3)岁。对比两组性别、年龄差异无统计学意义(P>0.05),有可比性。
1.2 方法
所有患者均接受ABI测定,于血液透析开始后2 h内通过水银血压计测定完成:选择仰卧位,分别测量上臂(仅测量无动静脉内瘘的一侧上肢)和双侧踝部(胫后动脉或足背动脉)的收缩压(SBP),取上臂、踝部最高收缩压值。ABI=最高足背动脉或胫后动脉收缩压值/最高上臂收缩压值,ABI<0.9为下肢PAD诊断标准。另外,收集整理所有患者基本情况(如年龄、性别、家庭条件、生活方式)、既往史、体格检查及实验室检查[血压(SBP,舒张压(DBP))、血脂、血糖、血清肌酐(SCr)、尿素氮(BUN)、超敏C反应蛋白(hsCRP)、血磷、血钙、钙磷乘积、全段甲状旁腺素(iPTH)]等资料,其中血脂包括总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C),所有实验室检查指标均于血液透析前测定。
1.3 统计学方法

2 结 果
2.1 两组血糖、血压及血脂指标比较
两组在血压(SBP、DBP)、血糖及血脂(TC、TG、LDL-C、HDL-C)水平方面比较差异均无统计学意义(P>0.05)。见表1。
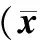
表1 两组患者血液透析前血糖、血压及血脂指标比较±s)
2.2 两组血清肌酐、尿素氮、血磷等指标比较
PAD组血磷、钙磷乘积、iPTH及hsCRP水平均明显高于非PAD组,差异有统计学意义(P<0.01)。两组SCr、BUN比较差异无统计学意义(P>0.05)。见表2。
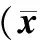
表2 两组患者血液透析前血清肌酐等相关指标比较±s)
2.3 ABI与各指标关系多因素Logistic回归分析
以ABI值正常与否(≥0.9=0,<0.9=1)为因变量,以血磷、血钙、钙磷乘积、iPTH及hsCRP水平为自变量,Logistic回归分析发现ABI独立危险因素包括血磷、血钙、钙磷乘积、iPTH及hsCRP。见表3。

表3 ABI危险因素Logistic回归分析
3 讨 论
3.1 ABI定义及判断标准
ABI指的是下肢踝部最高收缩压与上肢臂部最高收缩压之比,其中下肢踝部收缩压主要测量足背动脉或胫后动脉,而上肢臂部收缩压则仅测量肱动脉[4]。ABI以外周动脉狭窄至临界值引发狭窄时易导致外周动脉病变,且病变严重程度与动脉血管远端灌注压下降密切相关为原理[5]。目前临床公认ABI是判断PAD的“金标准”,1993年美国心脏协会对PAD诊断进行制定,认为ABI≤0.9可能动脉阻塞;ABI<0.8动脉阻塞可能性进一步提高;ABI在0.5~0.8范围内提示1处或1处以上动脉阻塞;ABI<0.05提示多处动脉阻塞;ABI在0.9~1.3范围内正常;ABI>1.3血管可能钙化。有报道称ABI<0.9确诊为下肢外周血管疾病敏感度95%,特异度95%。
3.2 ABI对血液透析患者的影响及其与血磷等指标相关性
有调查显示慢性肾功能不全维持性血液透析患者下肢PAD发生率30.6%,本组200例终末期肾病维持性血液透析患者中PAD(ABI<0.9)40例,占20.0%,比调查显示低,这可能与病例选择、相关干预等有关。Ono等[6]研究显示踝臂指数异常对慢性肾功能不全血液透析患者的全因死亡率和心血管死亡率有一定的预测价值。对其他混杂因素校正后,发现ABI<0.9血液透析病例全因死亡及心血管死亡风险分别上升4倍、5.9倍;而ABI≥1.3血液透析病例全因死亡及心血管死亡风险上升亦明显,这与此类患者血管钙化、血管僵硬程度高密切相关[7]。王革等[8]研究结表明4~5期慢性肾脏病患者桡动脉硬化与高甲状旁腺素、高血磷水平有关,控制血PTH、血磷水平可降低慢性肾病患者桡动脉硬化风险。本研究在前人研究基础上根据ABI测量结果将200例终末期维持性血液透析患者分为PAD组与非PAD组,通过比较两组血脂、血糖、血磷、血钙等相关资料分析ABI与上述指标的关系,了解PAD发生危险因素,以采取针对性的预防措施降低PAD患病率,最终降低血液透析患者心血管死亡风险。
本研究结果显示PAD组与非PAD组患者血糖、血压及血脂指标比较无显著差异(P>0.05),表明血脂、血糖、血压并非维持性血液透析患者PAD发生的危险因素,与罗丹等[9]研究结果基本一致。另外,对两组血磷、血钙、hsCRP等差异显著指标行Logistic回归分析,发现影响ABI的独立因素包括:①高磷血症。国内外研究证实高磷血症是导致维持性血液透析患者心血管死亡的独立危险因素,且血磷每上升0.3 2 mmol/L,死亡风险上升1/5左右;而维持性血液透析患者血磷>2.1 mmol/L,其心血管死亡风险上升1/3左右[10-11]。临床用于判断高磷血症的指标主要为血磷、钙磷乘积等,本研究PAD组患者血磷、钙磷乘积均明显高于非PAD组(P<0.05),且Logistic回归分析P<0.05,表明高磷血症为影响ABI独立因素。②血钙及iPTH。iPTH主要由甲状旁腺主细胞分泌而来,主要作用为升高血钙,降低血磷,且通常情况下血钙水平与iPTH呈负相关。目前临床iPTH在血液透析监测中应用较多[12]。本研究PAD组患者血钙水平明显低于非PAD组,iPTH明显高于非PAD组,差异有统计学意义(P<0.05)。③hsCRP。临床证实慢性微炎症状态参与慢性肾衰竭维持性血液透析患者,有研究认为微炎症状态与动脉粥样硬化有关。本研究PAD患者hsCRP水平明显高于非PAD组(P<0.05),表明炎症状态参与血液透析患者动脉粥样硬化进程,这可能与hsCRP水平升高,致使血管内皮功能异常、氧化产物增多、脂质代谢紊乱等有关[13-15]。
综上所述,高磷血症、微炎症状态参与终末期肾病维持性血液透析患者动脉粥样硬化进程,是PAD发生主要原因之一。
[1] 王 芳,洪大情,吴姝焜,等.血液透析患者肱踝脉搏波传导速度及其影响因素分析[J].中国中西医结合肾病杂志,2013,14(12):1070-1072.
[2] O’Hare A, Glidden DV, Fox CS, et al.Highprevalence of peripheral arterial disease in persons with renal insufficiency [J]. Circulation,2004,12(109):320-323.
[3] 高 卓,穆大为,隋丽娜,等.慢性肾脏病终末期患者动脉僵硬度及血脂水平的分析[J].安徽医药,2014,18(3):510-512.
[4] 杨中荣,秦献辉,王 玉,等.踝臂指数的流行病学研究与进展[J].中国组织工程研究与临床康复,2010,14(15):2814-2817.
[5] 周忠义.踝臂指数在慢性肾脏病患者中的应用价值[J].国际泌尿系统杂志,2010,30(2):258-260.
[6] Ono K, Tsuchida A, Kawai H, et al. Ankle brachial blood pressure index predicts all cause and cardiovascular mortality in hemodialysis patients [J].J Am Soc Nephrol, 2003,10(14):1591-1598.
[7] 高 卓,穆大为,张赤兵,等.血液透析患者动脉僵硬度的调查及危险因素分析[J].河北医药,2014,36(5):718-720.
[8] 王 革,夏 天,汤 锋,等.慢性肾功能不全血磷、PTH 与桡动脉硬化的相关性[J].西南国防医药,2012,22(2): 119-121.
[9] 罗 丹,夏瑗瑜,吴 军,等.血液透析患者高同型半胱氨酸血症、微炎症状态与外周动脉疾病的关系[J].临床荟萃,2011,26(20):1755-1758.
[10] 李月红,王 梅.北京市2007年慢性维持性血液透析患者钙磷代谢分析[J].中国血液净化,2010,9(2):112-115.
[11] 邬碧波,张黎明,唐 琦,等.维持性血液透析患者血磷达标状况与颈动脉粥样硬化的关系[J].中国血液净化,2015,14(8):469-473.
[12] 张立萍,王 静,聂 芳,等.异常踝臂指数与慢性肾脏病患者左室重量指数的关系研究[J].中国医药导报,2014,11(11):14-16.
[13] 田绍强.慢性肾脏病患者中踝臂指数与动脉硬化因素的相关性分析[D].沈阳:中国医科大学,2014.
[14] 贾凤玉,徐 斌,任红旗,等.维持性血液透析患者血清成纤维细胞生长因子23与血管钙化和左心室肥厚的关系[J].肾脏病与透析肾移植杂志,2015,24(2):101-106.[15] 罗 丹,李相友,夏瑗瑜,等.血液透析患者踝臂指数与微炎症状态、营养状况的关系[J].临床内科杂志,2015,32(1):42-44.
(本文编辑:王 馨)
Correlation between ankle brachial index and serum phosphorus level in patients on hemodialysis
WuChuanlin1*,WeiHaitang2,HuHaitang3,LiJinmei4,TongJingjing4
(1DepartmentNo.2ofInternalMedicine,2OperationRoom,3DepartmentofNephrology,4BloodPurificationCenter,ChencunHospitalAffiliatedtoShundeFirstPeople’sHospital,Foshan,Guangdong528313,China)
*Correspondingauthor:Email:wclin3399@sina.com
Objective:To investigate the correlation between ankle brachial index (ABI) and serum phosphorus level in hemodialysis patients, and to provide an important basis for the clinical prevention and treatment of peripheral arterial disease (PAD) of lower limbs.Methods: A total of 200 hospitalized patients with end-stage renal disease on maintenance hemodialysis in our hospital between January 2015 and December 2015 were included as the subjects in the study. All patients underwent ABI measurement. According to the findings of ABI, the patients were divided into the combined PAD group (ABI<0.9,n=40) and non-PAD group (ABI≥0.9160,n=160). Blood lipids, blood pressure, serum creatinine, serum phosphorus, and blood calcium in the two groups were determined and compared.Results:There were no statistically significant differences in blood pressure, blood glucose, blood lipids (TG, TC, LDL-C, HDL-C), SCr, and BUN between the two groups (P>0.05). The levels of serum phosphorus, calcium-phosphorus product, iPTH and hsCRP in the PAD group [(2.08±0.32) mmol/L, (56.4±5.6) mg2/dl2, (413.2±235.1) pg/ml, (8.0±1.2) mg/L]were significantly higher than those in the non-PAD group [(1.65±0.49) mmol/L, (44.1±8.8) mg2/dl2, (208.8±172.5) pg/ml, (3.5±1.3) mg/L](P<0.01). Logistic regression analysis showed that serum phosphorus, calcium-phosphorus product, iPTH and hsCRP were the independent factors influencing ABI.Conclusion:Hyperphosphatemia, high iPTH and micro-inflammatory state are involved in the progression of PAD in patients on hemodialysis.
hemodialysis; ankle brachial index; serum phosphorus; peripheral arterial disease of lower limbs; correlation
10.3969/j.issn.1008-1836.2016.03.018
佛山市顺德区医学科研立项(2015B015)
R692.5
A
2095-9664(2016)03-0068-03
2016-02-15)
*通讯作者:Email:wclin3399@sina.com

