miR-590-5P通过下调靶基因S100A10表达、抑制Wnt信号通道调控肝癌细胞增殖*
范仁根查文章周勇周建平单湘湘
miR-590-5P通过下调靶基因S100A10表达、抑制Wnt信号通道调控肝癌细胞增殖*
范仁根①查文章①周勇①周建平①单湘湘①
【摘要】目的:研究miR-590-5P对肝癌细胞增殖能力的影响以及参与HCC发生发展的机制。方法:利用QPCR对肝癌细胞株miR-590-5P的表达谱系进行分析和验证,生物信息技术预测S100A10可作为miR-590-5P的潜在靶基因,并通过实时定量PCR以及Western blot进行验证。通过慢病毒载体在肝癌细胞株HepG2中过表达miR-590-5P,CCK-8法检测转染后细胞增殖,流式细胞技术检测转染后细胞周期变化,Western blot检测转染后细胞Wnt信号相关蛋白表达水平。结果:荧光定量检测结果显示,miR-590-5P在人肝癌细胞中低表达,而S100A10蛋白在肝癌细胞中高表达。S100A10 3’UTR luciferase 报告系统验证表明,miR-590-5P可以通过结合S100A10 3’UTR而抑制报告基因的表达。通过慢病毒系统在HepG2细胞中高表达miR-590-5P,可有效抑制S100A10基因的表达。在肝癌细胞HepG2中过表达miR-590-5P,可通过调控细胞周期,明显抑制Wnt信号相关蛋白:Wnt5a、cMyc、CyclinD1的表达水平,促进E-cadherin、Caspase3的表达,加速β-catenin蛋白的磷酸化,而调控细胞增殖。结论:miR-590-5P在人肝癌细胞中低表达,而S100A10基因在人肝癌细胞中过表达,S100A10为miR-590-5P的靶基因。miR-590-5P在肝癌细胞中过表达,可有效抑制S100A10基因的表达,抑制Wnt通路的激活,使肿瘤细胞停滞在G1期,从而参与肝癌细胞增殖进程。
【关键词】miR-590-5P; 肝癌细胞
①江苏省盐城市第一人民医院 江苏 盐城 224000
Medical Innovation of China, 2016,13(16):004-008
First-author's address:First People's Hospital of Yancheng City,Yancheng 224000,China
微小RNA(microRNA,miRNA)是一类进化上保守,大小为20~25个核苷酸(nucleotide,nt)的非编码小RNA。成熟的miRNA与其靶信使RNA3’端UTR完全或不完全配对后,通过切割或抑制靶mRNA的转录后翻译,参与调节生物的发育、细胞的分化、增殖和凋亡等,并与人类肿瘤的发生发展密切相关[1]。miRNA的发现为基因表达调控研究打开了新的窗口,异常表达的miRNA及其靶基因的发现不仅丰富了肿瘤的发病机制,也为探索新的基因靶向治疗提供依据[2]。S100A10(又名P11)是S100钙结合蛋白家族成员之一,是一种钙依赖性的信号通路的介导分子,在多种肿瘤细胞中表达异常[3]。S100A10蛋白在Annexin Ⅱ介导的生物膜的聚集和融合过程中具有重要作用,参与Annexin Ⅱ四聚体形式介导的质膜循环,在肿瘤的发生发展进程中具有重要意义。笔者通过检测HCC癌与癌旁临床样本(10例)中S100A10表达,显示大部分HCC肿瘤组织S100A10较癌旁组织高表达,而miR-590-5P较癌旁组织低表达,提示S100A10、miR-590-5P与HCC的发生发展密切相关。本文拟通过分子生物和细胞技术探讨miR-590-5P调控肝癌细胞增殖和细胞周期的潜在机制,现报道如下。
1 材料与方法
1.1材料 人肝细胞性肝癌细胞株QGY-7701、HepG2、SK-HEP-1、SMMC-7721、BEL-7402、Li-7(湘雅医学院细胞库),DMEM培养基(Gibco),胎牛血清FBS(Gibco),Lipofectamine 2000(Invitrogen),miR-590-5P/3P定量PCR引物(上海生工),DH5a感受态细胞(宝生物工程有限公司),慢病毒实验系统、慢病毒表达载体(System Biosciences公司)。0.25%胰蛋白酶-EDTA (Hyclone),RIPA裂解液(sigma),BCA蛋白定量试剂盒(Pierce),ECL发光试剂盒(GE),显影胶片(KODAK),鼠S100A10抗体(Abcam),鼠Wnt-5a单抗(Abcam),鼠cMyc单抗(abcam),鼠Cyclin D1单抗(Santa cruz),鼠Caspase 3单抗(Santa cruz)、鼠β-catenin单抗(Santa cruz),双荧光报告载体、双荧光报告系统检测试剂盒(Promega),限制性内切酶(NEB),PrimeSTAR HS DNA聚合酶(TaKaRa),DNA凝胶纯化试剂盒、DNA产物纯化试剂盒、质粒提取试剂盒(天根)。
1.2仪器 DU800核酸蛋白分析仪(Beckman),凝胶成像系统(上海培清科技),实时荧光定量PCR扩增仪(Bio-Rad),流式细胞仪(FACS Calibur,BD),PCR仪器(SENSO),冷冻低温离心机(黑马HEMR),组合式电泳、电转系统(Bio-Rad),超净工作台,37 ℃细胞培养箱,电热恒温水槽(上海恒科技),化学发光仪(Promega)。
1.3方法
1.3.1QPCR检测方法 以snRNA U6 作为miRNA QPCR的检测内参,其中U6上游引物为:TGGCACCCAGCACAATGAA,下游引物为:CTAAGTCATAGTCCGCCTAGAAGCA,引物为生工生物工程(上海)股份有限公司购买,反应条件参照试剂说明书相应体系进行操作,结果通过以snRNA U6为内参计算2-ΔΔCT值比较各组miRNA表达差异。
1.3.2Western blot 使用RIPA裂解液裂解各组细胞,通过BCA蛋白定量试剂盒行蛋白定量,取20 μg的总蛋白行12% SDS-PAGE胶,120 V恒压电泳(约1.5 h),转膜、封闭和孵育抗体,通过HRP-ECL法,用X光胶片曝光,检测各实验组S100A10、Wnt5a,cMyc,Cyclin D1,Caspase 3 and phosphorylation levels of β-catenin、β-actin(内参)蛋白表达水平。
1.3.3细胞转染 参照Lipofectamine 2000说明书进行转染,转染后48 h检测转染水平。
1.3.4细胞增殖功能检测(CCK-8法) 消化并收集各组细胞以1×103种于96孔板中,体积100 μL/孔,按照不同时间点(0、24、48 h)加入CCK-8(CK04,同仁化学),震荡10 min后置酶标仪上检测490 nm处吸光度值。
1.3.5细胞周期检测 收集各组细胞,预冷PBS (pH=7.4)洗涤两次,离心,收集细胞沉淀;加入预冷70%乙醇,于4 ℃放置过夜。PBS洗涤细胞两次,1000 r/min离心5 min,收集细胞沉淀,加入100 μL PBS(含50 μg/mL PI、100 μg/mL RNase A),4 ℃避光常温孵育30 min,上机(FACS Calibur,BD)检测。
1.4统计学处理 使用SPSS 15.0统计软件进行分析,计量资料采用(±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1miR-590-5P在人肝癌细胞中低表达,而S100A10在肝癌细胞中高表达 QPCR、Western blot分别用于检测miR-590-5P、S100A10在不同肝癌细胞株和正常肝细胞株中的表达水平。mir-590-5P在所有肝癌细胞株中的表达水平明显低于正常肝细胞株(L-02)(P<0.01),见图1。而S100A10在所有肝癌细胞株中的表达水平明显高于正常肝细胞株(L-02)(P<0.01),结果提示:miR-590-5P在人肝癌细胞中低表达、S100A10在肝癌细胞中高表达,见图2。而生物信息学预测miR-590-5P在S100A10保守位点有高分数结合,因此可将其作为重要的候选靶基因,见图3。

图1 人肝癌细胞株中miR-590-5P含量
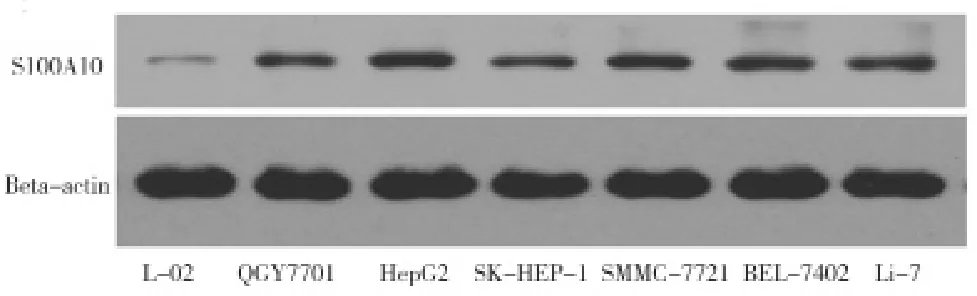
图2 Western blotting检测不同肝癌细胞株中S100A10蛋白含量

图3 miR-590-5P与S100A10靶位点及突变位点配对图
2.2miR-590-5P可以通过与靶基因S100A10的3’UTR直接作用下调其表达 构建pcDNA-miR-590-5P重组表达载体及pS100A10A-3’UTR-PGL3报告基因重组质粒,S100A10 3’UTR Luciferase报告系统验证表明,miR-590-5P可以通过结合S100A10 3'UTR而抑制报告基因的表达,将预测的结合位点突变,其抑制效应也随即消失,提示:miR-590可以通过与靶基因S100A10的3’UTR直接作用下调其表达,见图4。此外,笔者通过慢性病毒系统在HepG2细胞中转染Lv-miR-590-5P,通过QPCR和Western blot对转染效率进行检测,发现miR-590-5P 在HepG2细胞中过表达,且能有效抑制S100A10的表达,见图5~6。
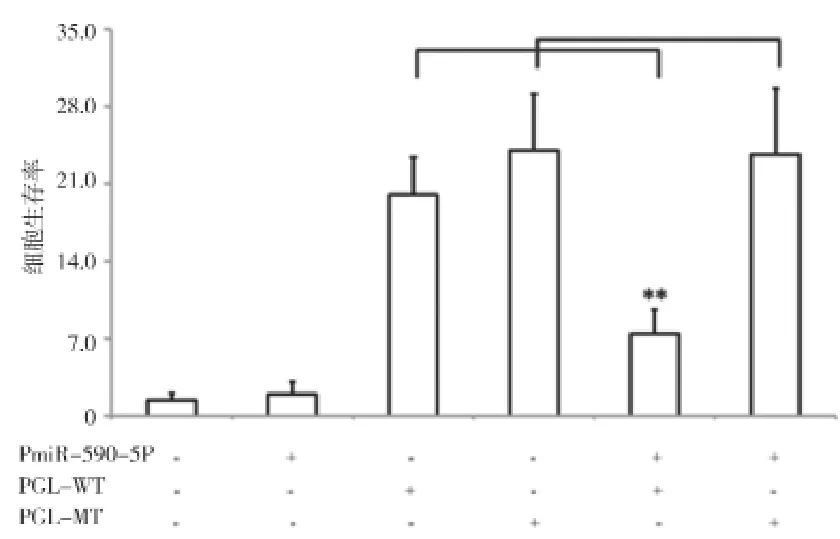
图4 S100A10 3’UTR Luciferase报告分析

图5 各组miR590-5P的表达水平
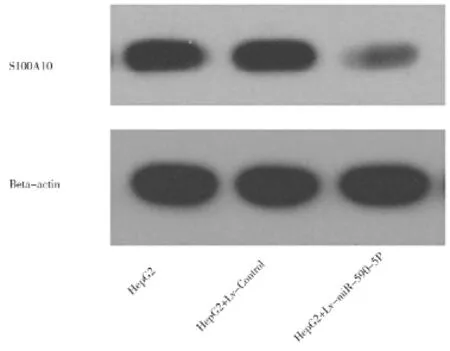
图6 各组S100A10蛋白的表达水平
2.3HepG2细胞株中过表达miR-590-5P可明显抑制细胞的增殖活性,使其细胞周期发生停滞HEPG2分别转染miR-590-5P和空白质粒,CCK-8法检测细胞活性,与空白对照组相比较,在HepG2细胞中过表达miR-590-5P,可以明显抑制肿瘤细胞的增值活性。同时笔者研究示:HepG2细胞株转染Lv-miR-590-5P 24、48 h后,与对照组细胞数比较差异无统计学意义(P>0.05);而72 h后,转染后HepG2细胞数较对照组明显减少,差异有统计学意义(P<0.01),见图7。因此笔者认为miR-590-5P通过时间依赖机制(细胞周期改变)抑制肝癌细胞增殖,基于此笔者通过流式细胞仪检测Lv-miR-590-5P转染后细胞周期分布,发现与对照组相比,其可以使细胞明显阻滞于G1期,见图8。
2.4HepG2细胞株中过表达mir-590-5P可抑制Wnt信号通道 在HepG2细胞中过表达miR-590-5P,可抑制Wnt信号相关蛋白:Wnt5A、c-Myc、CyclinD1、MMP7的表达,同时上调E-cadherin、Caspase3蛋白的表达,促进β-catenin蛋白的磷酸化水平,见图9。
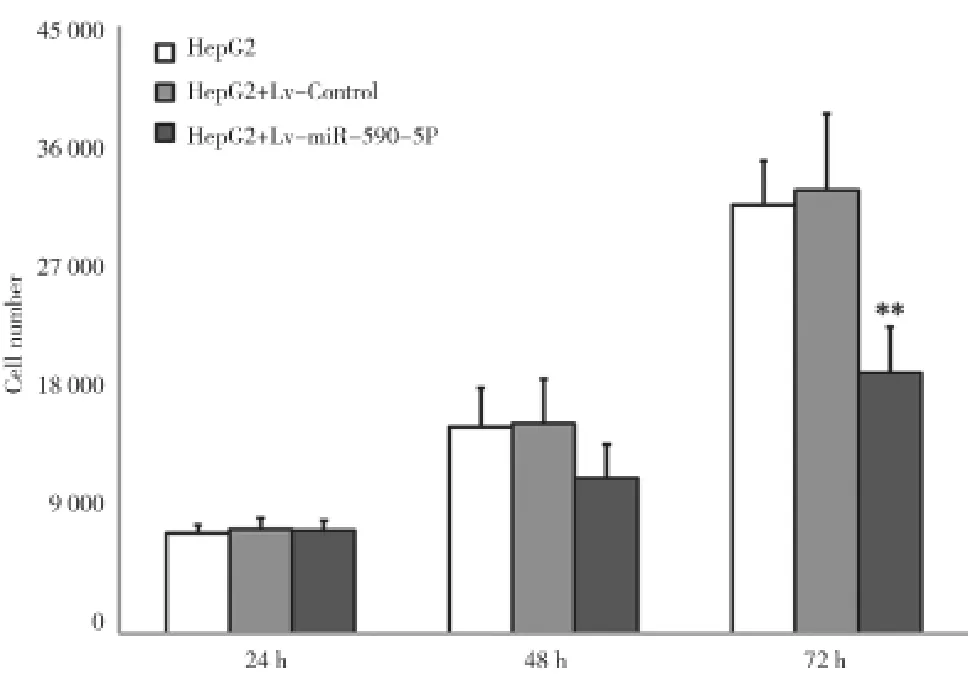
图7 基因干预后各组细胞数情况
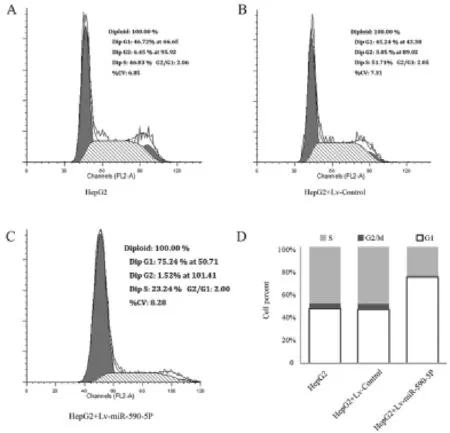
图8 细胞周期检测
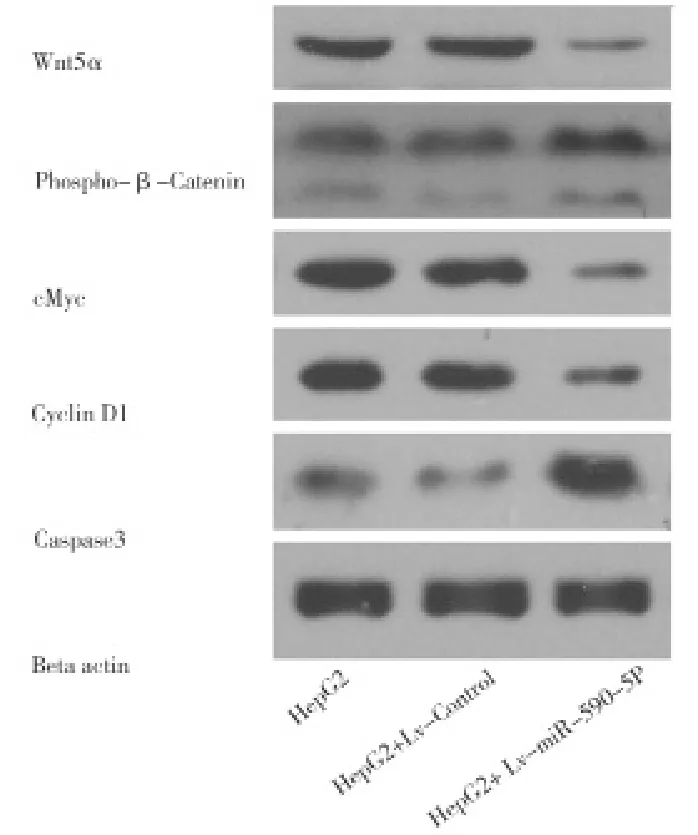
图9 Western blot检测HepG2细胞过表达miR-590-5P及Wnt信号相关蛋白表达水平
3 讨论
miRNA作为一类具有调节作用的小RNA,它调节人体内1/3的信使RNA(mRNA)的表达,且参与人体内包括肿瘤发生在内的多种生物学过程[4]。近来,越来越多的研究表明miRNA在肿瘤细胞增殖、凋亡途径中发挥重要作用。已有研究表明,miR-21、miR-375、miR-224、miR-195、miR-15b等miRNA可通过直接或间接调控靶基因影响细胞的增殖、凋亡以及侵袭和转移,进而参与HCC的发生、发展[5-7]。Chung等[8]发现miRNA-15b可通过抑制肿瘤坏死因子相关的凋亡诱导配体(TRAIL)诱导的死亡受体凋亡通路,而抑制HCC细胞凋亡。GUO等[9]发现在激活的肝星状细胞中高表达miRNA-15/16,可负向凋节靶点Bcl-2,进而激活Caspase-3、Caspase-8和Caspase-9,从而通过死亡受体、线粒体介导的凋亡通路诱导激活的肝卫星干细胞凋亡。Wu等[10]研究表明:miR-184可抑制SOX7表达而调控肝癌细胞增殖。而miR-590-5P位于人类基因组7号染色体长臂近端,且研究表明:miR-590的两个臂5P和3P在HCC发生发展中发挥重要作用[11]。笔者的研究表明,在肝癌细胞中miR-590-5P低表达,并通过生物信息学发现其靶基因S100A10。
为了探索miR-590-5P对HCC细胞功能的影响,笔者通过在人HCC细胞系HepG2细胞中转染miR-590-5P寡聚核苷酸,上调miR-590-5P 在HepG2细胞中的表达,发现miR-590-5P促进β-catenin磷酸化、抑制c-Myc、CyclinD1蛋白表达,诱导细胞阻滞在G1期,而显著抑制细胞增殖。
Wnt/β-catenin信号通路是一条进化过程中高度保守的信号通路,以转录辅助因子β-catenin为主要介导因子,Wnt/β-catenin信号紊乱与肝癌等发生发展密切相关[12]。许多肿瘤细胞中存在Wnt/β-catenin信号通路的异常活化,持续激活的β-catenin可以促进下游靶基因,如CyclinD1、c-Myc等表达增高,从而引起细胞增殖[13-14]。同时肝癌细胞株中过表达miR-590-5P,Caspase3表达明显增加,这表明miR-590-5P可活化Caspase3途径,参与HepG2细胞凋亡,表明在体外实验中,miR-590-5P参与HepG2细胞的增殖及凋亡进程[15]。然而这些实验效果只是建立在一种细胞模型中,因此需要更多的实验来验证。
参考文献
[1] Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[2]郑惊雷,梁力建,王在国,等.肝动脉灌注化疗抑制肝癌血管生成的研究[J].中国医学创新,2014,11(3):1-3.
[3]张维,高云升.S100A8在胃癌中的表达及临床意义[J].中国医学创新,2012,9(3):17-18.
[4]曾凤枝.MiRNA及其与肺癌早期诊断的新认识[J].中国医学创新,2012,9(30):154-156.
[5] Bota J,Chivalric R R,O’Donnell K A.Therapeutic miRNA delivery suppresses tumorigenesis in a murine liver cancer model[J].Cell,2009,137(6):1005-1017.
[6] Liu A M,Poon R T,Luk J M.miRNA-375 targets Hipposignaling effector YAP in liver cancer and inhibits tumor properties[J].Biochemical and Biophysical Research Communications,2010,16(3):623-627.
[7] Garcon M,Dileva G,Romano.miRNA221 and miRNA-222 regulate TRALL resistance and enhance tumorigenicity through PTEN and TIMP3 nonregulated[J].Cancer Cell,2009,25(6):498-509.
[8] Chung G E,Mung S J,Lee S H.High expression of miRNA15b predicts a low risk of tumor recurrence following curative resection of hepatocellular carcinoma[J].Colon Report,2010,32(1):113-119.
[9] Guo C J,Pan Q,Li D G.miR-15b and miR-16 are implicated in activation of the rat hepatic stellatc cell:An esscntial role for apoptosis[J].Journal of Hepatology,2009,13(4):766-778.
[10] Wu G G,Li W H,He W G,et al.Mir-184 post-transcriptionally regulates SOX7 expression and promotes cell proliferation in human hepatocellular carcinoma[J].PLoS One,2014,9(2):e88 796.
[11]杨红飞,郑文宏,赵文淘,等.miR-590-5P和miR-590-3P参与肝细胞肝癌发展的机制[J].南方医学大学学报,2013,33(6):804-811.
[12] Seidler H B,Utsuyama M,Nagaoka S,et al.Expression level of Wnt signaling components possibly influences the biological behavior of colorectal cancer in different age groups[J].Exp Mol Pathol,2004,76(3):224-233.
[13]周威,熊奇如.Wnt/β-catenin信号通路重要分子及其靶基因在原发性肝癌中的作用机制[J].肝胆外科杂志,2013,21 (2):150-155.
[14] Nusse R.Wnt signaling in disease and in devdopment[J].Cell Res,2005,15(1):28-32.
[15]高艳丽,刘晓华,赵衍江,等.肿瘤标志物检测肝癌血清的阳性率与临床意义[J].中国医学创新,2013,10(3):94-95.
MiR-590-5P Inhibits Growth of HepG2 Cells via Decreasing S100A10 Expression and Inhibiting Wnt Pathway
FAN Ren-gen,CHA Wen-zhang,ZHOU Yong,et al
【Key words】MiR-590-5P; Hepatoma cell
【Abstract】Objective:To study the effect of miR-590-5P on the proliferation of hepatocellular carcinoma cells and the mechanism involved in the occurrence and development of HCC.Method:The QPCR was used on hepatocellular carcinoma cell line miR-590-5P expression spectrum analysis and verification,the bioinformaticsprediction S100A10 as miR-590-5P potential target genes and verified by quantitative real-time PCR and Western blot.By lentiviral vector in hepatocellular carcinoma cell line HepG2 cells over expressing miR-590-5P,detected by CCK-8 assay after transfection cell proliferation,flow cytometry was transfected into the cell cycle.After transfection,the cells Wnt signaling associated protein expression levels were detected by Western blot.Result:The results of fluorescence quantitative analysis showed that miR-590-5P was low expressed in human hepatocellular carcinoma cells,while S100A10 protein was highly expressed in hepatocellular carcinoma cells.3’UTR luciferase S100A10 reporting system validation showed that miR-590-5P can inhibit the expression of the reporter gene by binding to 3’UTR S100A10.The expression of S100A10 gene could be effectively inhibited by high expression of miR-590-5P in HepG2 cells through the slow virus system.In human hepatoma HepG2 cells overexpressing miR-590-5P,through the regulation of cell cycle,inhibit Wnt signaling related proteins: Wnt5a,cmyc and CyclinD1 expression level,promoted the expression of E-cadherin and Caspase3,acceleration of beta catenin protein phosphorylation,and regulation cell proliferation.Conclusion:MiR-590-5P in human hepatocellular carcinoma cells in low expression,and S100A10 gene in human hepatocellular carcinoma cells over expression,S100A10 for the miR-590-5P target gene.Overexpression of miR-590-5P in hepatocellular carcinoma cells can effectively inhibit the expression of S100A10 gene,inhibit the activation of Wnt pathway,so that the tumor cells in the G1 phase of stagnation,so as to participate in the process of proliferation of hepatocellular carcinoma cells.
doi:10.3969/j.issn.1674-4985.2016.16.002
*基金项目:盐城市科技局、盐城市卫生局科技计划项目(YK2014010)
通信作者:单湘湘
收稿日期:(2015-11-26) (本文编辑:周亚杰)

