一种茶园小绿叶蝉抗药性快速检测方法的研究
李良德,王定锋,李慧玲,张 辉,曾明森,吴光远*(福建省农业科学院茶叶研究所,福建 福安 355015)
一种茶园小绿叶蝉抗药性快速检测方法的研究
李良德,王定锋,李慧玲,张 辉,曾明森,吴光远*
(福建省农业科学院茶叶研究所,福建福安355015)
摘 要:茶小绿叶蝉具有虫体较小易隐蔽、行动活跃易逃脱、若虫脆弱易死亡等特点,导致室外捕虫工作量大、室内挑虫分装处理困难,是阻碍该虫抗药性研究进展缓慢的重要原因。通过采集叶蝉发生茶园嫩梢于室内水培、培育小绿叶蝉;通过调节改进的粉尘采样设备的不同采样流量收集叶蝉于带芽离心管;最后,通过联苯菊酯处理离心管内芽叶,测定管内小绿叶蝉的L C50值,校验方法的可行性。研究结果表明,田间虫口密度为1.538(头·梢- 1)的茶园,室内水培7 d后可孵化出若虫至3.181(头·梢- 1),收集室内叶蝉可减少室外采虫工作量。采用10 L·min- 1的采虫流量,叶蝉收集速度快,且存活率为100%,改进的设备可简化挑虫难题。联苯菊酯对叶蝉的L C50为163.55 m g·L- 1,毒力测定方法快速简便。
关键词:茶小绿叶蝉;抗药性;快速简便;建立
茶小绿叶蝉E mpoasca flavescens是我国茶树上的头号害虫[1,2]。该虫生长速度快、世代重叠严重,主要以成、若虫刺吸茶树嫩梢取食,同时将卵产于嫩梢内部,致使芽叶生长停滞、萎缩和焦枯,对茶树树势和茶叶产量造成严重影响[3],每年为害损失约为20%左右[4,5]。由于缺乏高效、简便和经济的防治措施,目前该虫仍以化学防治为主[6,7],但长期、大量不合理的用药,导致该虫产生严重的抗药性,这不仅加大了防治难度,也提高了防治成本。因此,详细评估我国茶园小绿叶蝉的抗药性现状、提出解决措施十分重要。
目前,昆虫抗药性检测方法众多,主要有生物检测法、神经电生理检测法、生物化学检测法、免疫学检测法和分子生物学检测法等[8]。其中,生物检测法是目前茶小绿叶蝉抗药性主要检测方法。该方法从试验茶园中获取抗性品系,从未用、少用农药的偏远山区或长期荒废的茶园中采集相对敏感品系,采用浸梢法[9]、药膜加浸梢法[10]、浸虫法等建立两种品系间的毒力回归方程,并获得相应的L D50或L C50值,再通过比较两种品系间的L C50或L D50值来表示抗性倍数。
然而,茶小绿叶蝉生物检测法存在诸多难点,主要体现在:①田间茶小绿叶蝉极易隐蔽不易捕捉,特别是在虫源稀少季节,采集工作量较大;②该虫采集后行动活跃、易逃脱,现有方法难以约束虫体,给室内毒力测定带来不便;③试验对象以2~3龄若虫为主,虫体脆弱,挑虫处理易对若虫造成损伤、死亡,实验误差大。以上原因加大了该虫抗性监测在田间和基层中开展的难度。
针对以上难题,本研究通过调查田间虫口密度,并采集嫩梢于室内水培、培育小绿叶蝉若虫,减少了室外采虫工作量;通过调节改进的粉尘采样设备的不同采样流量将2~3龄若虫收集于带芽离心管内,简化了室内挑虫难题;最后,通过供试药剂处理离心管内芽叶,测定管内小绿叶蝉的L C50值,校验方法的可行性。该研究旨在建立一套茶小绿叶蝉抗药性快速检测方法,为今后深入开展我国不同茶区茶小绿叶蝉的抗药性研究提供方法基础。
1 材料与方法
1.1试验材料
试验对象:试验茶小绿叶蝉均为2~3龄若虫(以下简称若虫叶蝉);主要试剂及仪器:联苯菊酯乳油(有效浓度1 m g·m L- 1)为青岛瀚正益农生物科技有限公司(中国青岛)生产;粉尘采样器(T F C - 30,最大采样流量30 L·min- 1)购自盐城天悦仪器仪表有限公司(中国盐城);塑料水桶(直径∶高度= 15 cm∶30 cm)购自宁波高新区思之源塑料容器有限公司(中国宁波);50 m L离心管购自上海兰易科学仪器有限公司(中国上海);橡胶软管(直径0.8 cm)购自北京南北晨阳实验器材公司(中国北京)。
1.2试验设计
1.2.1采梢地的选择 采梢地点为福建省宁德市柘荣县(北纬27°209',东经119°897')。2015年7 月30日选择近期未喷施农药、生长旺盛、尚未采收的彭家山茶园(平均海拔高度为600 m以上)。选取一块丘陵田块(约1334 m2),将其均匀划成7个小区,每个小区随机调查200根嫩稍(试验重复3次),求出每次调查的虫口密度(虫口密度=每次调查的总虫口数/每次调查的总嫩梢数),再计算出每个小区的总虫口密度(总虫口密度=多次试验的虫口密度的平均值),总虫口密度最大的小区为采梢的田块。
1.2.2嫩梢采集及室内水培 确认采梢田块后,随机选取40株茶树,每株茶树随机采集20根嫩稍(每根嫩梢采至1芽7叶,长约为40 cm,总计800根)。将采集的嫩梢捆绑成团于当天带回室内,用剪刀将梢底剪平(有利于吸水),剥掉底梢老叶(底部叶片长时间淹水易腐烂发臭),于室内(27± 1)℃,R H 75%,光周期12 L∶12 D条件下,放于塑料水桶(水深约7 cm)内水培(每桶放置40根嫩梢,共计20桶),并记录嫩梢的存活天数(叶片自然凋落视为死亡)。
1.2.3室内虫口密度调查 将室内水培的20桶嫩梢作上标记,分别在嫩梢水培的第5、6和7 d,选取3组嫩梢(每组选取3桶,试验重复3次),计算出每组若虫叶蝉的虫口密度(虫口密度=每组叶蝉的总虫口数/每组嫩梢的总梢数),再计算出当天若虫叶蝉的总虫口密度(总虫口密度=多组试验的虫口密度的平均值)。
1.2.4采虫设备的设计 切取2条50 cm橡胶软管,并套入橡胶塞内。一条橡胶管与粉尘采样器相连(吸气管),在橡胶塞端套入长度为2 cm,并包上纱布(防止采集过程吸入叶蝉)。另一条橡胶管用于收集叶蝉(吸虫管),在橡胶塞端套入长度为4 cm(用于贴近离心管内芽叶,避免采集叶蝉时撞击管壁而受伤)。
于多年未喷施农药的福建省农业科学院茶叶研究所试验茶园(福建福安),采集1芽2叶嫩芽,用水浸泡洗净后于27℃空调下晾干。取出室内水培5 d后长有若虫叶蝉的嫩梢,通过调节改进的采虫设备的不同采虫流量(5、10、15、20、25、30 L·min- 1,共6个处理)。对应每个采虫流量,设置6组离心管(试验重复3次,共18管),每个离心管内放入3片嫩芽,并吸入30头若虫叶蝉。观察若虫叶蝉的采集速度并统计采后的成活率,探索最佳采虫流量。采虫方法:接通电源后,将带虫嫩梢放于塑料盆内,将集虫离心管插放于平板上,一手调节粉尘采样器采样流量,一手拿住吸虫管采虫。
1.2.5嫩芽保鲜时间及叶蝉存活天数调查 明确最佳采虫流量后,再次按照以上步骤(1.2.4),选取3个离心管,以最佳采虫流量每管吸入30头若虫叶蝉,用纱布套住管口,于室内(27±1)℃,R H 75%,光周期12 L∶12 D条件下培养,每间隔24 h后观察嫩梢的保鲜情况,并通过管底叶蝉的死亡数计算不同培养天数的存活率。
1.2.6试验方案可行性验证 明确离心管内叶蝉的存活率和存活天数可满足抗药性试验要求后,将联苯菊酯稀释成不同梯度浓度(100、200、300、400、500、600、700、800、900、1000 m g·L- 1,共10组梯度),将芽叶进行带毒处理(联苯菊酯浸泡10 min),27℃空调下晾干后放于离心管内。取出室内水培7 d后的嫩梢,根据最佳采虫流量,每个梯度吸入20头若虫叶蝉(试验重复3次),于室内(27±1)℃,R H 75%,光周期12 L∶12 D条件下试验24 h后,查找联苯菊酯对若虫叶蝉L C50的毒力范围。
根据已得出的毒力范围,在估值的L C50附近再次设置5个梯度溶度(100、150、200、250、300),每个梯度吸入20头叶蝉(试验重复3次),于(27±1)℃,R H 75%,光周期12 L∶12 D条件下试验24 h后,计算出联苯菊酯对若虫叶蝉的L C50值。
1.2.7数据统计与分析 每组试验重复3次,采用Microsoft Excel 2007软件中的Stdev公式对各组数据进行标准差分析并作图。联苯菊酯毒力测定中的回归方方程、曲线斜率、95%置信期间和L C50实值均采用SPSS 1310 for Windows软件中的Probit A nalyze分析方法,选择常用对数转换快速分析得到[11]。
2 结果与分析
2.1采梢地若虫叶蝉发生情况
调查了7个小区的若虫叶蝉发生情况。结果显示,不同田块均有若虫叶蝉发生,各小区总虫口密度0.430~1.538(头·梢- 1)(图1)。其中,田块3的总虫口密度最大(1.538头·梢- 1),确认为采梢的田块。
2.2水培嫩梢若虫叶蝉发生情况
对室内水培嫩梢在水桶内的存活天数进行观察。结果表明:8 d内嫩梢生长良好,第9 d叶片开始脱落,第10 d叶片脱落严重,第11 d嫩芽枯萎。表明:水培嫩梢可在8 d内正常生长。
调查了室内水培嫩梢上若虫叶蝉的发生情况。结果显示,水培5 d,6 d和7 d后,若虫叶蝉总虫口密度分别为2.242,2.622和3.181(头·梢- 1)(图2)。表明:通过室内水培嫩梢的方法培育的若虫叶蝉总虫口密度比室外田间(图1)的大,并且随着水培时间的延长,若虫叶蝉发生越来越严重(图2)。该方法不但可以解决了试验虫源的问题,而且可以长期开展批量试验。
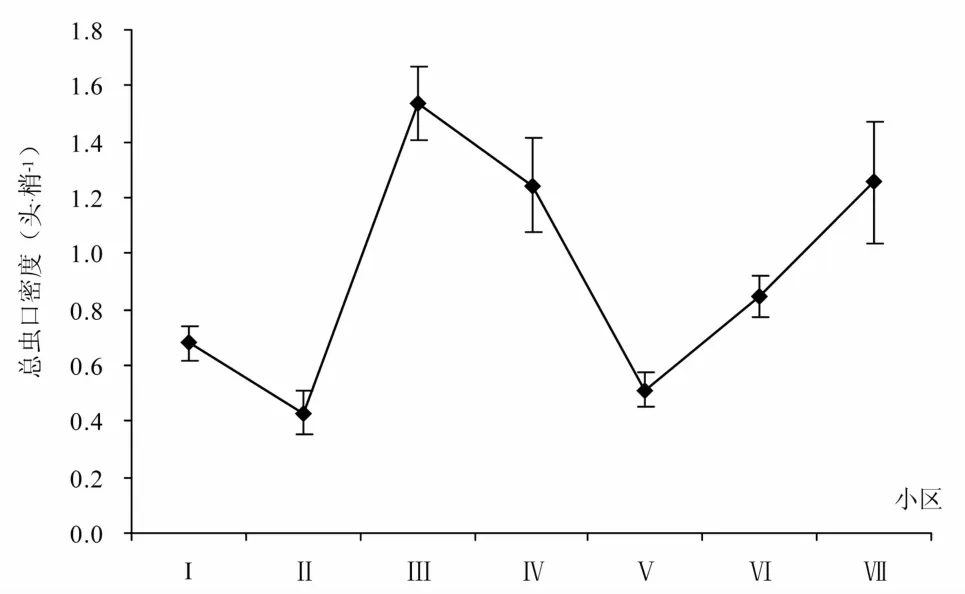
图1 不同小区茶小绿叶蝉发生情况Fig.1 Population of E. flavescens in different areas at tea plantation
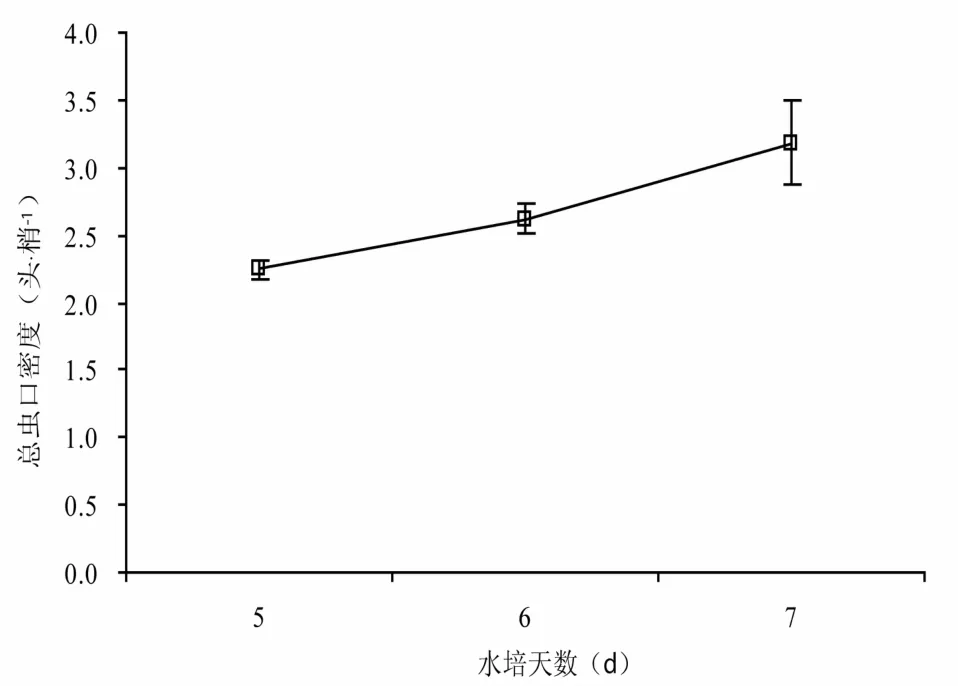
图2 不同水培天数茶小绿叶蝉发生情况Fig.2 Population of E. flavescens after days of incubation on water mediu m
2.3粉尘采样设备采虫流量试验
为保证若虫叶蝉的采集速度和采集质量,对粉尘采样器进行改进,设计了新的采虫设备(图3)。
对该采虫设备的采虫流量进行试验。结果表明:采虫流量为5 L·min- 1时,若虫叶蝉存活率100%,但吸力太小、不易收集若虫叶蝉;采虫流量升到10 L·min- 1时,若虫叶蝉存活率100%,且采集速度适中;采虫流量升到15 L·min- 1时,若虫叶蝉采集速度较快,但部分死亡,存活率为85.56%;采虫流量升到20 L·min- 1时,若虫叶蝉采集速度迅速,但存活率只有77.78%;采样流量升到25 L·min- 1时,若虫叶蝉采集速度过快,存活率只有13.33%;当采虫流量达到30 L·min- 1时,若虫叶蝉全数死亡(图4)。表明,10 L·min- 1的流量适合若虫叶蝉的采集,为最适采集流量。
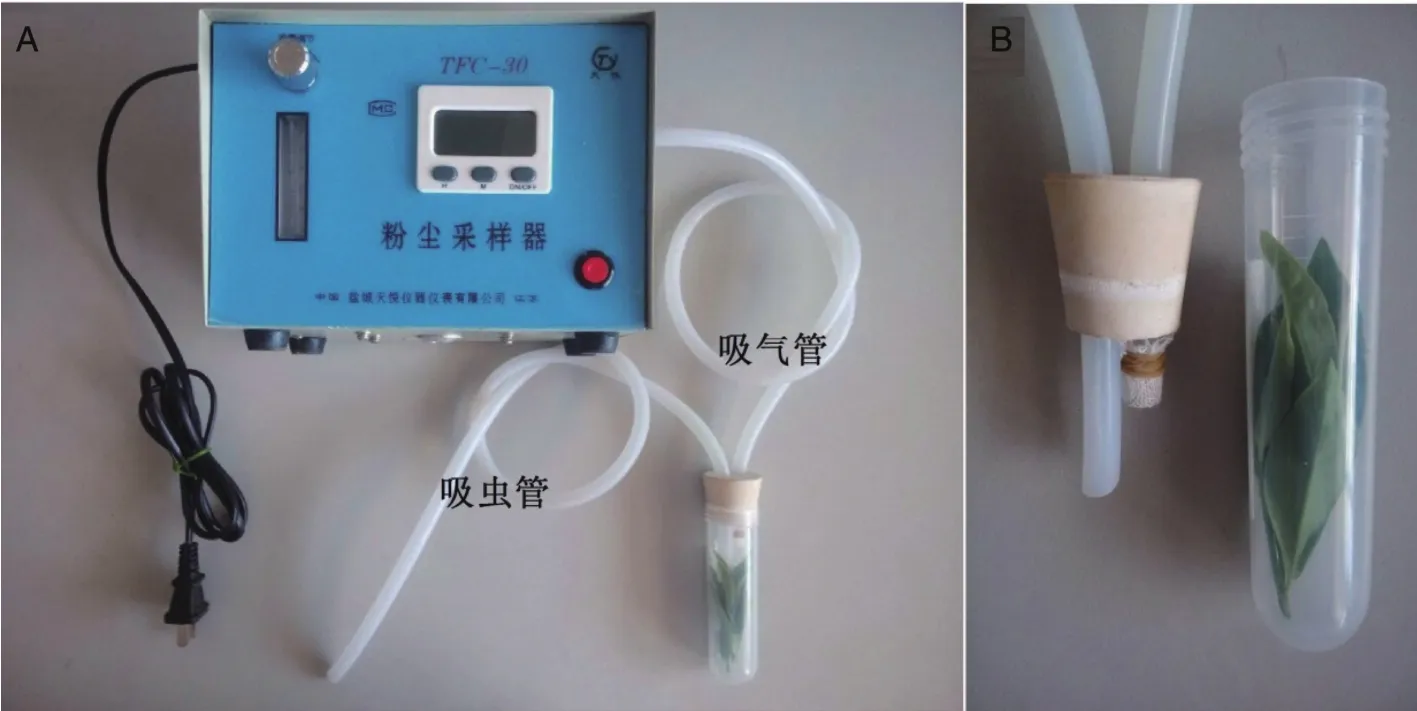
图3 改进的采虫设备Fig.3 M odified dust sampling device for E. flavescens collection注:A -改进的粉尘采样器设备;B -若虫收集管。N ote:A:M odified dust sa m pling device;B:Tube for E. flavescens collection.

图4 若虫叶蝉采集过程中的存活率Fig.4 Survival rate of E. flavescens in insect collection operation
2.4嫩芽保鲜时间及叶蝉存活天数
观察带芽离心管(图5 A)内未做处理的嫩叶的保鲜时长。结果显示:2 d内芽梢鲜绿(图5 B);3 d后,芽梢慢慢枯萎(图5 C);4 d后,芽梢干枯(图5 D)。表明:嫩叶可在离心管内保鲜2 d时间。
同时,观察管内若虫叶蝉的存活天数。结果显示:2 d内,叶蝉存活率100%;3 d后,叶蝉存活率为71.15%;4 d后,叶蝉全数死亡(图6)。表明:管内培养的若虫叶蝉可在2 d内正常生长,该存活时间能够满足抗药性试验要求(抗药性试验为药后24 h测定抗性毒力)。
2.5叶蝉对联苯菊酯的L C50测定
测定10个不同梯度浓度(100~100 m g·L- 1)联苯菊酯对若虫叶蝉的药效毒力。得出:联苯菊酯对若虫叶蝉的L C50100~300 m g·L- 1(表1)。
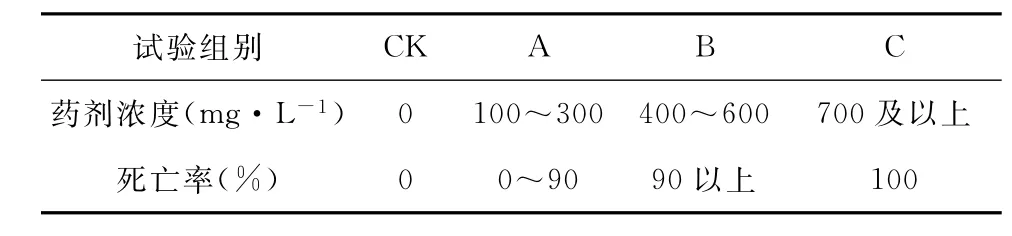
表1 联苯菊酯对若虫叶蝉的药效毒力Table 1 Toxicity of bifenthrin on E. flavescens nymphs
进而对5个梯度浓度(100~300 m g·L- 1)的联苯菊酯进行细化,进一步测定药效毒力测定(表2)。并由SPSS 1310 for Windows软件分析得出:毒力回归方程Y = - 6.974 + 3.15x;曲线斜率为0.335;L C50为163.55 m g·L- 1;置信期间为146.737~182.086 m g·L- 1。该测试过程简便快速,验证了整套检测方案的可行性。
3 讨论
茶小绿叶蝉抗药性检测的难点在于虫源的采集和采集后虫口的分装处理。传统的虫源采集方法主要有两种:(1)以捕虫网来回S型路线绕树快步走动采集,该方法虽然能够限制叶蝉逃跑,但采集的叶蝉却以成虫为主,即便收集到的若虫也易造成损伤;(2)用力抖梢、树下大盆接虫。该方法虽然能够收集较多叶蝉,但收集的叶蝉极易逃跑。同时,在抖梢后的大盆内枯枝落叶混杂、虫源众多,给后续叶蝉分离带来了极大不便。本试验通过采梢,室内水培的方法,不仅减少了茶园采虫的工作量,而且室内水培不受风雨影响,水培7 d后虫口密度达到了较高水平,不但解决了试验虫源的问题,而且可以长期开展批量试验。

图5 离心管内嫩芽保鲜时间及若虫叶蝉存活天数Fig.5 Shelf - life of fresh tea leaves and nymph survival of E. flavescens in centrifuge tubes,day注:A -带芽离心管;B -放置2 d后的嫩芽和叶蝉;C -放置3 d后的嫩芽和叶蝉;D -放置4 d后的嫩芽和叶蝉。N ote:A:Centrifuge tube containing fresh leaves;B:Fresh leaves and E. flavescensin 2 days of incubation;C:Fresh leaves and E. flavescensin 3 days of incubation;D:Fresh leaves and E. flavescensin 4 days of incubation.

图6 若虫叶蝉在离心管培养不同天数后的存活率Fig.6 Survival rate of E. flavescens after days of incubation in centrifuge tube
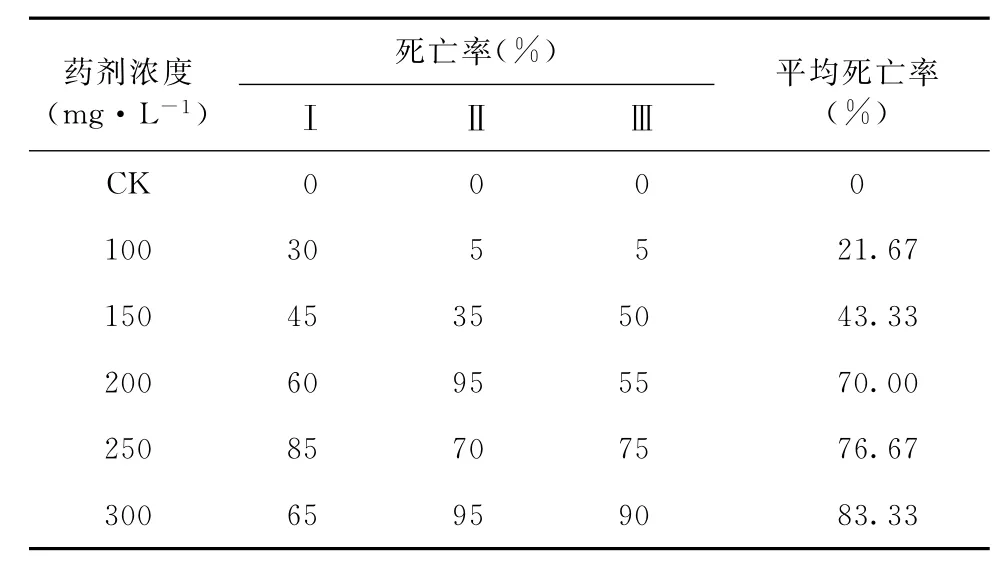
表2 联苯菊酯对若虫叶蝉的L C50校验Table 2 LC50of bifenthrin on E. flavescens nymphs
传统的小绿叶蝉分装处理方法主要是用毛笔挑取后放于玻璃、塑料瓶内,采用浸虫法、滤纸药膜法、喷雾法和浸梢等方法室内检测药效毒力,其中以浸梢法最为常见[6]。这些方法能够保持虫源健康、虫龄和虫口数统一,但用毛笔挑动叶蝉后,受惊的叶蝉容易跳跃逃脱。即便能将叶蝉挑入瓶内,但挑取过程费时费力。虽然采用二氧化碳麻醉和冷冻昏迷的方法能够起到约束虫体的作用,但却影响了虫体的健康且很难掌握。本试验采用改进的粉尘采样设备,不仅能一步到位将健康虫体收集到离心管内,而且将带毒处理的芽叶预先放于管中,简化了给药步骤,提高了检测效率。
综上所述,本研究针对茶小绿叶蝉虫体较小易隐蔽、行动活跃易逃脱、若虫脆弱易死亡等特点,设计了一套从室外采梢到室内监测的抗药性检测方法。与传统检测方法相比,该套方法不仅节省了大量的人力物力,而且缩短了检测时间(室内1个检测周期仅为1 d),可为快速开展我国不同茶区茶小绿叶蝉的抗药性研究方法提供参考。
参考文献
[1]汪云刚,李良静,冉隆殉.不同种植模式下茶假眼小绿叶蝉种群动态的调查[J].西南农业学报,2010,23(2):413 -415.
[2]谷明,林乃铨.假眼小绿叶蝉对不同绿肥挥发性物质的行为反应[J].福建农林大学学报,2011,40(3):242 - 245.
[3]王庆森,王定锋,吴光远.我国茶树假眼小绿叶蝉研究进展[J].福建农业学报,2013,28(6):615 - 623.
[4]张衍炽,陈佳保.安溪县不同海拔茶假眼小绿叶蝉的发生与综防措施[J].茶叶科学技术,2006,(2):43.
[5]肖星,许燕,冉隆珣,等. 5种杀虫剂对茶假眼小绿叶蝉的防效[J].中国植保导刊,2014,(1):66 - 67.
[6]郭华伟,朱国念,姚惠明,等.添加农用有机硅对假眼小绿叶蝉防效的影响[J].浙江农业科学,2013,1(1):40 - 50.
[7]邢树文. 4种入侵植物水提液对假眼小绿叶蝉的防治效果[J].广东农业科学,2013,40(6):88 - 90.
[8]潘志萍,李敦松.昆虫抗药性监测与检测技术研究进展[J].应用生态学报,2006,17(8):1539 - 1543.
[9]庄家祥,傅建炜,苏庆泉.福建省茶小绿叶蝉抗药性的地区差异[J].茶叶科学,2009,29(2):154 - 158.
[10]王念武,徐金汉,陈峥.不同茶园假眼小绿叶蝉抗药性比较[J].福建农林大学学报. 2004,33(2):169 - 173.
[11]贾春生.利用SPSS软件计算杀虫剂的L C50[J].昆虫知识,2006,43(3):414 - 417.
A Rapid M ethod for Determining Insecticide-resistance of Empoasca flavescens(Homoptera:cicadellidae)
LI Liang-de,W A N G Ding-feng,LI H ui-ling,Z H A N G H ui,Zeng Ming-sen,W U Guang-yuan
(Tea Research Institute,Fujian Academy of Agricultural Sciences,Fu’an,Fujian 355015,China)
Abstract:E mpoasca flavescens is characterized by its easily hidden tiny body,fast m oving and escaping ability,as well as fragile ny m phs. Those properties make the entrap ment or collection and the separation or handling for testing rather difficult,and hence,are detrimental in experimenting with the live insects. To overco me the hindrances,this study firstly collected the tea shoots infested with E. flavescens fro m the plantation to keep them on a water mediu m and raise the insects artificially in the lab. Then,a m odified dust sam pling device was used to suck the insects at varied air flow rates into the centrifuge tubes containing fresh tea leaves. Finally,the toxicity measurement of L C50on the insects was determined by pretreating the tubes with varied concentrations of bifenthrin. The data generated verified the applicability of the methodology. The population density of hatched larva obtained fro m the lab setting was 3.181 head/shoot after 7 days incubation,w hile it was 1.538 head/shootin the field. The substantially higher density significantly facilitated the sam ple collection for the experimentation. A nd,at a 10 L/ min sam pling air flow,the insects were harvested rapidly and easily with a 100%survival rate that considerably reduced the workload on or virtually eliminated the need for insect separation. M oreover,the L C50of bifenthrin on E. flavescens was effectively determined to be 163.55 m g·L- 1.
Key words:E mpoasca flavescens;insecticide-resistance;rapid methodology;establish
中图分类号:S435.711
文献标识码:A
文章编号:2096 - 0220(2016)01 - 0048 - 06
收稿日期:2016 - 02 - 01初稿;2016 - 02 - 18修改稿
基金项目:国家茶叶产业技术体系(C A R S - 23);福建省现代农业茶叶产业技术体系(2014 N K04);福建省自然科学基金项目(2015J01099);福建省农业科学院科技创新项目(2014 C X - 8);福建省农业科学院科技下乡“双百”项目(sb m n1620)。
作者简介:李良德(1988 -),男,研究实习员,主要从事昆虫生理学和毒理学研究。
*通讯作者:吴光远(1962 -),男,研究员,主要从事茶树植保与害虫生物防治。E - mail:gy w upt @ 163.co m

