柑橘果肉果胶的流变和结构特性
支梓鉴, 邹明明, 李 珊, 陈健乐, 叶兴乾, 陈士国
(浙江大学生物系统工程与食品科学学院, 馥莉食品研究院,浙江省农产品加工技术研究重点实验室, 杭州 310058)
柑橘果肉果胶的流变和结构特性
支梓鉴, 邹明明, 李珊, 陈健乐, 叶兴乾, 陈士国
(浙江大学生物系统工程与食品科学学院, 馥莉食品研究院,浙江省农产品加工技术研究重点实验室, 杭州 310058)
摘要以柑橘果肉为原料, 采用稀酸提醇沉法提取果胶粗品, 研究了果胶溶液的浓度及热处理温度对果胶溶液流变学性质的影响. 采用DEAE Cellulose-52柱对柑橘果肉粗品进行洗脱得到3个多糖组分(P-0, P-1和P-2), 对其分子量、 半乳糖醛酸、 单糖组成及酯化度等进行分析, 并利用红外光谱及核磁共振氢谱等对各组分进行结构特性分析. 结果表明, 柑橘果肉果胶为典型的剪切稀化型非牛顿流体; P-0, P-1和P-2组分分子量存在显著差异; 柑橘果肉果胶为富含糖醛酸的酸性多糖, 且是发生部分乙酰化的低酯果胶, 其单糖组成以半乳糖醛酸、 半乳糖、 阿拉伯糖、 鼠李糖和岩藻糖居多, 且均以Ⅰ型聚鼠李半乳糖醛酸(RG-Ⅰ型)结构为主; 3种组分糖环类型均是吡喃糖, 糖苷键既有α型, 又有β型.
关键词柑橘果肉; 果胶; 结构特性; 多糖; 流变学性质
果胶是一种酸性杂多糖, 主要包括均聚半乳糖醛酸聚糖(HG)、 鼠李半乳糖醛酸聚糖Ⅰ(RG Ⅰ)和鼠李半乳糖醛酸聚糖Ⅱ(RG Ⅱ) 3个结构域[1,2], 其广泛存在于苹果、 柑橘、 芒果、 番石榴、 向日葵花盘及甘薯渣中. 果胶是一种可溶性的膳食纤维, 具有降低胆固醇, 预防糖尿病, 防止肥胖以及维持肠道健康[3,4]等功能.
随着功能性多糖的研究开发利用, 果胶越来越受到人们的重视和青睐. 有资料表明[5], 全球果胶年需求量约为4万吨, 且以每年约4%~6%的速度递增. 同时, 我国是柑橘生产大国, 种植面积居世界首位, 且国内果汁行业处于飞速发展期, 榨汁过程中易产生大量果渣, 其中含有约20%果胶多糖, 若不将其充分利用, 易引起资源浪费和环境污染问题. 因此, 合理利用废弃物提取其功能多糖亟待研究. 目前, 对橘皮中果胶研究较多, 其果胶含量20%~30%, 但对果肉果胶研究很少, 限制其进一步的开发利用. 本文以柑橘果肉为原料, 研究其果胶的基本理化性质和结构特性, 旨在对其资源再分配和产业发展提供理论基础.
1实验部分
1.1材料、 试剂与仪器
晚熟温州蜜柑(宁波象山). 单糖标品(甘露糖、 氨基葡萄糖、 鼠李糖、 葡萄糖醛酸、 半乳糖醛酸、 半乳糖、 阿拉伯糖、 岩藻糖、 乳糖、 木糖), 右旋糖标样(Dextran, 重均分子量Mw=50000, 80000, 150000, 270000, 410000, 670000)(Sigma公司); DEAE Cellulose-52(Whatman公司); 乙腈、 甲醇, 色谱纯; 重水(D2O, 纯度99.9%)、 氘代丙酮、 三氟乙酸(TFA)和1-苯基-3-甲基-5-吡唑啉酮(PMP)均为分析纯; 其它试剂均为国产分析纯.
高速冷冻离心机(日本日立公司); HAAKE RheoStress 6000型流变仪(Thermo Electron(Karlsruhe) GmbH); UV-2550型分光光度计(日本Shimadzu公司); Waters 1525型高效液相色谱仪、 Waters 2695型高效液相色谱仪、 Waters 2414型示差检测器、 Waters 2996型紫外检测器(美国Waters公司); ZORBAX Eclipse XDB-C18分离柱(4.6 mm×250 mm, 5 μm)(美国Aglient公司); TSK-gel G4000 PWxl色谱柱(日本Tosoh Bioscience公司); SinChrom ODS-BP C18分离柱(4.6 mm×250 mm, 5 μm)(大连依利特公司); AVA TAR370型傅里叶红外光谱仪(美国Nicolet公司); Avance Ⅲ 600 MHz型核磁共振波谱仪(瑞士Bruker公司).
1.2实验方法
1.2.1柑橘果肉果胶提取取冷冻桔肉, 解冻, 过滤, 取渣备用. 用匀浆机将橘渣打匀, 按料液体积比1∶1加入蒸馏水, 调节pH=1.8, (80±1) ℃, 磁力搅拌90 min, 冷却至室温, 离心, 取上层清液, 加入无水乙醇至体积分数为70%, 静置1 h, 400目过滤, 取滤渣用95%(体积分数)乙醇洗涤3次, 复溶, 用分子量为14000的透析袋流水透析, 冻干, 计算果胶得率.
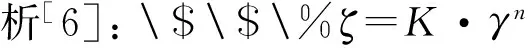
(1)
(2)
式中:K(Pa·sn)为黏度系数;n为流动指数, 表征偏离牛顿流体程度的指数.
1.2.3柑橘果肉果胶的快速纯化及分级取粗果胶1.497 g溶解, 上样于DEAE Cellulose-52阴离子交换柱, 依次以0, 0.1, 0.3, 0.5和1.0 mol/L NaCl溶液(0.1 mol/L乙酸-乙酸钠缓冲液, pH=6.0)洗脱出3个组分(0.5和1.0 mol/L洗脱部分糖反应不明显, 未收集), 分别命名为P-0, P-1和P-2. 在滤液中加入乙醇至体积分数为70%, 静置, 离心, 复溶, 透析, 冻干, 备用.
1.2.4分子量的测定分别取不同分子量的右旋糖苷标准品2 mg, 配成2 mg/mL的溶液. 高效液相色谱(HPLC)条件: 流动相0.2 mol/L NaCl溶液, 流速0.5 mL/min, 柱温和检测温度均为40 ℃, 进样量20 μL. 取果胶样品P-0, P-1和P-2, 利用HPLC和TSK-gel G4000 PWxl色谱柱测定分子量, 并利用Breeze2软件计算其重均分子量(Mw)、 数均分子量(Mn)和多分散系数(D).
1.2.5单糖组成分析配制标准单糖(甘露糖、 鼠李糖、 葡萄糖醛酸、 半乳糖醛酸、 葡萄糖、 半乳糖、 木糖、 阿拉伯糖、 岩藻糖、 氨基葡萄糖等)混合溶液(各单糖浓度为2 mmol/L). 将400 μL单糖混合液与450 μL 0.3 mol/L NaOH于离心管中, 加50 μL 1.6 mmol/L乳糖和450 μL 0.5mol/L PMP(甲醇作溶剂), 混匀, 于70 ℃水浴反应30 min, 以0.3 mol/L HCl溶液调至中性, 加入1 mL氯仿萃取, 重复2次, 过0.45 μm水膜.
称取果胶样品约3 mg于安培瓶中, 加入1 mL 2 mol/L 三氟乙酸(TFA), 充N2气封管, 在110 ℃水解8 h(烘箱). 冷却至室温, 用N2气吹干TFA, 用1 mol/L NaOH溶液调至中性, 再用超纯水定容至1 mL. 取400 μL样品进行衍生化.
参照文献[7]方法, 用色谱柱ZORBAX Eclipse XDB-C18(4.6 mm×250 mm, 5 μm)检测分离, 紫外检测波长为250 nm, 进样体积10 μL.
1.2.6半乳糖醛酸含量的测定分别配制浓度为0, 30, 60, 90, 120, 150, 180, 210, 240和270 μg/mL的半乳糖醛酸标准溶液1.0 mL, 利用硫酸咔唑法在530 nm波长下测定吸光值, 得标准曲线y=0.0035x+0.0092,R2=0.9964, 其中y表示吸光值,x表示半乳糖醛酸浓度(μg/mL). 将果胶P-0, P-1和P-2溶解至适当浓度, 各取1 mL利用硫酸咔唑法测定吸光值, 并根据标准曲线计算半乳糖醛酸的含量.
1.2.7酯化度的测定取果胶样品10 mg, 加入0.5 mL CuSO4溶液(1 mg/mL)、 10 μL异丙醇溶液(20 μL/mL)和1 mL NaOH溶液(0.5 mol/L), 将混合溶液置于冰浴中反应30 min, 离心, 取上层清液, 用稀HCl调节pH=2.0. 配制混标溶液: 将10 μL异丙醇溶液(100 μL/mL)、 10 μL冰乙酸溶液(100 μL/mL)和6 μL甲醇混匀, 用水补充至2 mL. 用HPLC检测. 流动相4 mmol/L H2SO4溶液, 流速0.8 mL/min, 色谱柱C18柱(SinChrom ODS-BP 5 μm, 250 mm×4.6 mm), 示差折光检测器(RID), 进样体积20 μL.

(3)
(4)
(5)
式中:mMeOH or AcOH or IPA分别为MeOH, AcOH或IPA的质量,AMeOH or AcOH or IPA分别为MeOH, AcOH或IPA的峰面积; GalA%为半乳糖醛酸的含量.
1.2.8红外光谱(FTIR)和核磁共振氢谱(1H NMR)测定各取1 mg干燥果胶样品与KBr压片, 使用AVA TAR370傅里叶红外光谱仪, 测定4000~400 cm-1范围的光谱吸收. 取分离纯化的P-0, P-1和P-2样品, 用99.9%的氘水交换2次, 冻干, 样品浓度为10 mg/mL, 以四甲基硅烷(TMS)为内标, 利用VANCE Ⅲ 600 MHz核磁共振波谱仪在20 ℃条件下测定1H NMR谱.
2结果与讨论
2.1流变学特性
2.1.1浓度对果肉果胶溶液流变性的影响各浓度柑橘果肉果胶溶液的黏度随剪切速率的变化曲线如图1(A)所示. 在0.1~600 s-1剪切速率范围内, 其黏度随浓度增大而增大, 且不同浓度的果胶溶液均表现为溶液黏度随剪切速率增加而减小的典型假塑性流体行为. 利用OriginPro7.5软件对不同浓度的果胶溶液流变曲线进行幂律方程的拟合, 得到不同浓度果胶溶液的流体幂律方程及相关参数(见表1). 结果表明, 随果胶溶液浓度的增大, 稠度系数K显著上升, 表观黏度随之增大[9]. 原因可能是果胶在水溶液中呈链状线性构象, 分子间相互缠结形成交联结构, 且具有较强的分子间作用力, 果胶浓度增大使连接区的果胶分子数增多, 分子间引力逐渐加强, 加剧了分子链段间及分子间相互缠结, 而形成网状结构, 使流体流动阻力增大, 从而使表观黏度急剧增大, 随着剪切速率的增大, 这种强化效应逐渐减弱[10]. 表1和表2中显示各浓度果胶溶液n值均小于1, 表明在实验剪切速率范围(0.1~600 s-1)内, 柑橘果肉果胶溶液属于假塑性流体[11]. 当果胶溶液浓度为0.25%时, 非牛顿指数n=0.8766, 其流动行为更接近于理想状态的牛顿流体; 随着浓度的增大,n值逐渐降低, 果胶溶液的剪切变稀进一步增强, 假塑性流体行为更加明显.
2.1.2温度对果肉果胶溶液流变性的影响温度对1.00%柑橘果肉果胶溶液的流变性的影响如图1(B)所示, 在相同剪切速率(0.1~600 s-1)下, 随着处理温度的升高, 果胶溶液的黏度逐渐减小. 表1和表2结果表明, 随果胶溶液处理温度升高, 稠度系数K显著降低, 流体黏度也相应减小. 处理温度为100 ℃时, 果胶溶液的流变曲线远远低于25 ℃时的流变曲线, 稠度系数K仅为4.26 mPa·sn, 且果胶黏度随着剪切速率的增大基本保持不变, 表现出理想的牛顿流体性质. 原因可能是温度升高导致分子热运动加剧, 链柔顺程度增强, 流动性增大; 分子链间氢键被破坏, 分子间斥力增强, 电离度减小, 交联作用也逐渐减小[12]; 果胶分子降解, 分子间缠结点减小, 最终导致果胶黏度下降.
2.2果胶分子量
柑橘果肉果胶的洗脱图如图3所示. 组分P-0, P-1和P-2分别为用0, 0.1和0.3 mol/L NaCl溶液(0.1 mol/L乙酸-乙酸钠缓冲液, pH=6.0)洗脱出来的组分. 表3数据显示, P-0, P-1和P-2重均分子量分别为752410, 286320和131380, 三者存在显著差异.
2.3单糖组成分析
柑橘果肉果胶各组分含有的单糖种类及其摩尔分数如表3所示. P-0含有9种单糖, P-1和P-2含有8种单糖, 3种果胶组分的单糖组成均以半乳糖醛酸、 半乳糖、 阿拉伯糖、 鼠李糖和岩藻糖5种单糖居多, 但是含量存在明显差异, 半乳糖醛酸、 鼠李糖和岩藻糖摩尔分数依次增加, 而半乳糖和阿拉伯糖摩尔分数依次减少. P-0组分半乳糖醛酸摩尔分数最低, 鼠李糖、 半乳糖和阿拉伯糖摩尔分数之和最高; P-2组分半乳糖醛酸摩尔分数最高, 鼠李糖、 半乳糖和阿拉伯糖摩尔分数之和最低.
* Each value represents the mean of three replicates. Man: mannose; Rha: rhamnose; GluA: glucuronic acid; GalA: galacturonic acid; Glu: Glucose; Glu; Gal: galactose; Xyl: xylose; Ara: arabinose; Fuc: fucose; \%D\%: polydispersity index.
果胶RG-Ⅰ域是由重复的鼠李半乳糖醛酸二糖单元4)-α-D-GalpA-(1,2)-α-L-Rhap-(1连接而成, 在鼠李糖残基的C4位可发生阿拉伯聚糖、 半乳聚糖或混合阿拉伯半乳聚糖的取代. Schols等[13]提出, 当果胶分子的Rha/GalA比值在0.05~1.00之间时, 其结构主要为RG-Ⅰ 型; 当比值低于0.05 时, 结构主要为HG和RG-Ⅱ型. 柑橘果肉果胶3种组分的Rha/GalA值分别为0.23, 0.20, 0.26, 因此可推断3个果胶组分均以RG-Ⅰ型结构为主. Ferreira等[14]提出, (Gal+Ara)/Rha值可粗略估计RG-Ⅰ型果胶分子结构的侧链长度, 其值越大, 表明通过鼠李糖连接到RG-Ⅰ主链上的侧链越长. 柑橘果肉果胶3种组分的(Gal+Ara)/Rha值分别为4.09, 2.62, 1.39, 因此可推断3个果胶组分通过鼠李糖连接到RG-Ⅰ主链上的侧链链长依次递减, 并且3种组分各自的半乳糖和阿拉伯糖含量相差不大, 因此, 侧链是半乳聚糖、 阿拉伯聚糖或者混合阿拉伯半乳聚糖均有可能.
2.4半乳糖醛酸含量测定
果胶经水解生成半乳糖醛酸, 在强酸中与咔唑试剂发生缩合反应生成紫红色化合物, 其呈色强度与半乳糖醛酸含量成正比, 可比色定量. 柑橘果肉果胶3种组分的半乳糖醛酸含量如表4所示. 可见其含量较高并且存在一定差异性, 表明这3种组分均是富含糖醛酸的酸性多糖. 该结果与单糖组成分析的结果存在一定差异, 可能是果胶组分的中性糖的干扰所致.
Table 4Content of galacturonic acid(GalA), degree of methylation(DM) and actylation(DA) of different pectin polysaccharide from citrus pulp
2.5酯化度分析
半乳糖醛酸的甲酯化和乙酰化是果胶多糖类物质重要的结构特征. 酯化度的大小直接影响果胶多糖的物理化学性质, 如胶凝特性、 离子交换特性及与钙离子的交联特性等; 另外, 果胶分子间的氢键作用也主要取决于分子主链上甲酯化度和乙酰化度的数目和分布. 以异丙醇作为内标计算得到柑橘果肉果胶的酯化度结果见表4. 其中P-1甲酯化程度最高, P-0次之, P-2最低; 3种组分的乙酰化度较低并且差异不大. 表明柑橘果肉果胶是发生部分乙酰化的低酯果胶.
2.6红外光谱表征

2.7核磁共振氢谱分析
1H NMR谱图主要解决多糖结构中糖苷键的构型问题, P-0, P-1和P-2组分的1H NMR 波谱图如图4所示. 多糖异头氢信号多集中在δ4.8~5.5范围内, 且α型吡喃糖C1上质子信号超过δ4.95, 而β型小于δ4.95; 呋喃糖C1上的质子信号在δ5.4附近, 且J1,2<2 Hz. 图4插图显示, 在δ5.4附近无谱峰, 表明各组分均为吡喃糖. P-0组分在δ4.8~5.5间有5个谱峰, 峰尖分别为δ4.90, 5.03, 5.09, 5.12和5.18; P-1组分有4个谱峰(δ4.91, 5.03, 5.10和 5.18); P-2组分有3个谱峰(δ4.91, 5.04和5.10). 结果表明3种组分的糖苷键既有α型, 又有β型.δ5.03附近是发生甲酯化的半乳糖醛酸的H-1信号,δ5.10附近是未发生甲酯化的半乳糖醛酸的H-1信号, P-0, P-1和P-2在δ3.74附近的信号是酯化果胶的甲氧基的端基质子信号[15]. 各组分在δ1.85, 2.01, 2.11附近的信号是酯化果胶的乙酰基的端基质子信号, 表明3种组分的果胶HG和RG Ⅰ型结构中乙酰基连接在半乳糖醛酸的位置均不同[16]. 3种组分的甲氧基端基质子信号和乙酰基端基质子信号的出现表明柑橘果肉果胶发生甲酯化和乙酰化, 与酯化度的测定结果一致. P-0在δ1.25, 1.26; P-1在δ1.26, 1.27及P-2在δ1.27, 1.28处的信号是甲基氢信号, 分别归属于α-1,2及α-1,2,4连接的鼠李糖残基的H-6信号[17]. P-0在δ1.19, P-1在δ1.19及P-2在δ1.20处的信号为岩藻糖的甲基(CH3)氢信号[18], 谱峰较强, 表明柑橘果肉果胶岩藻糖含量较高, 与单糖组成分析的结果一致.
3结论
在柑橘果肉中提取果胶, 采用DEAE Cellulose-52阴离子交换快速分离纯化出P-0, P-1和P-2组分, 并研究了其结构. 柑橘果肉果胶溶液的黏度随剪切速率的增加而逐渐降低, 表现为典型的剪切稀化型非牛顿流体, 可在食品工业中用于增稠剂等; 酯化度测定结果表明柑橘果肉果胶为发生部分乙酰化的低酯果胶, 可广泛应用于果酱、 冰淇淋、 果肉型饮料及焙烤食品中; 采用红外和核磁共振分析各组分果胶, 发现其均为吡喃糖, 且糖苷键类型既有α型, 又有β型, 为其在食品产业中的应用和废弃果渣资源再利用提供理论基础.
参考文献
[1]Munarin F., Tanzi M. C., Petrini P.,Int.J.Biol.Macromol., 2012, 51(4), 681—689
[2]Ye X. Q., Chen J. L., Jin M.D., Cheng H., Chen S. G., Liu D. H.,J.ChineseInst.FoodSci.Tech., 2015, 15(7), 1—9(叶兴乾, 陈健乐, 金妙仁, 程焕, 陈士国, 刘东红. 中国食品学报, 2015, 15(7), 1—9)
[3]Zhang W. B., Xu P., Zhang H.,TrendsFoodSci.Tech., 2015, 44, 258—271
[4]Otles S., Ozgoz S.,ActaSci.Poly.Technol.Aliment., 2014, 13(2), 191—202
[5]Kammerer D. R., Kammerer J., Valet R., Carle R.,FoodRes.Int., 2014, 65, 2—12
[6]Xu L., Xu G. Y., Liu T., Chen Y. J., Gong H. J.,Carbohydr.Polym., 2013, 92, 516—522
[7]Zhang L. F., Ye X. Q., Ding T., Sun. X. Y., Xu Y. T., Liu D. H.,Ultrason.Sonochem., 2013, 20(1), 222—231
[8]Leving S., Thomas M., Ralet M. C., Quemener B., Thibault J. F.,FoodHydrocolloid, 2002, 16, 547—550
[9]Wang H. B., Xu Q. Y., Wang F. A.,Trans.CSAE, 2006, 22(11), 223—227(汪海波, 徐群英, 汪芳安. 农业工程学报, 2006, 22(11), 223—227)
[10]Zhang X.,StudyonPolymerCrossflowLaw, China University of Petroleum, Qingdao, 2007(张星. 聚合物窜流规律研究, 青岛: 中国石油大学, 2007)
[11]Nascimento G. E., Simas-Tosin F. F., Iacomini M., Gorin P. A., Cordeiro L. M.,Carbohydr.Polym., 2016, 139, 125—130
[12]Liu X. X.,ExtractionandCharacterizationofPecticPolysaccharidesfromOkraFlower, Zhejiang University, Hangzhou, 2014(刘晓霞. 黄秋葵花果胶类多糖的提取工艺及其性质的研究, 杭州: 浙江大学, 2014)
[13]Schols H. A., Voragen A. G. J.,Prog.Biotechnol., 1996, (14), 3—19
[14]Ferreira J. A., Mafra I., Soares M. R., Evtuguin D. V., Coimbra M. A.,Carbohydr.Polym., 2006, 65(4), 535—543
[15]Winning H., Viereck N., Nørgaard L., Larsen J., Engelsen S. B.,FoodHydrocolloid, 2007, 21(2), 256—266
[16]Majoros I. J., Keszler B., Woehler S., Bull A. T., Baker J. R.,Macromolecules, 2003, 36(15), 5526—5529
[17]Hokputsa S., Gerddit W., Pongsamart S., Kari I., Thomas H., Andreas K., Stephen E. H., Berit S. P.,Carbohydr.Polym., 2004, 56(4), 471—481
[18]Chen S. G., Xue C. H., Yin L. A., Tang Q. J., Yu G. L., Chai W. G.,Carbohydr.Polym., 2011, 83(2), 688—696
(Ed.: D, Z)
† Supported by the Public Welfare Project of Zhejiang Province, China(No.2014C32G2010026) and the Agricultural Major Project of Ningbo City, China(No.2013C11013).
Rheological and Structural Characterization of Pectin Polysaccharides from Citrus Pulp†
ZHI Zijian, ZOU Mingming, LI Shan, CHEN Jianle, YE Xingqian, CHEN Shiguo*
(CollegeofBiosystemsEngineeringandFoodScience,FuliInstituteofFoodScience,ZhejiangKeyLaboratoryforAgro-foodProcessing,ZhejiangUniversity,Hangzhou310058,China)
KeywordsCitrus pulp; Pectin; Structural feature; Polysaccharide; Rheological property
AbstractRaw pectin from citrus pulp was prepared with diluted acid extraction and ethanol precipitation. Its rheological behavior was assessed under different thermal treatments at different concentrations. Three polysaccharides, named P-0, P-1 and P-2, were isolated by anion-exchange chromatography on a diethyl-aminoethyl(DEAE) cellulose-52 column at 0, 0.1, 0.3 mol/L NaCl eluent, respectively. Their structural features were elucidated by determination of their molecular weight, sugar analyses, esterification degree analyses, Fourier transform infrared(FTIR) and1H nuclear magnetic resonance(1H NMR) spectra. The results indicated that citrus pulp pectin was the typical shearing thinning non-newtonian fluid. The molecular weights of P-0, P-1 and P-2 were 752410, 286320, 131380, respectively. They belonged to the kind of acid polycose, which was abundant in uronic acid and low-esterified pectin with partial acetylesterification. P-0, P-1 and P-2 were mainly made up of rhammogalacturonan-Ⅰ(RG-Ⅰ) structure and their monosaccharides compositions were mostly glucuronate, galactose, arabinose, rhamnose and fucose at different ratio. FTIR and NMR spectra implied that P-0, P-1 and P-2 owned pyranose rings and exhibited bothα- andβ-glycosidic bonds.
收稿日期:2016-01-26. 网络出版日期: 2016-05-10.
基金项目:浙江省公益性项目(批准号: 2014C32G2010026)和宁波市农业重大项目(批准号: 2013C11013)资助.
中图分类号O631; O629
文献标志码A
联系人简介: 陈士国, 男, 博士, 副教授, 博士生导师, 主要从事海洋糖化学和糖生物学研究. E-mail: chenshiguo210@163.com

