乌鳢产吲哚金黄杆菌的鉴定及其胞外产物特性分析
王鑫毅 韩艳楠 金 珊 王 丽 赵青松 陈寅儿(宁波大学海洋学院,宁波 315211)
研究简报
乌鳢产吲哚金黄杆菌的鉴定及其胞外产物特性分析
王鑫毅 韩艳楠 金 珊 王 丽 赵青松 陈寅儿
(宁波大学海洋学院,宁波 315211)
乌鳢(Channa argus)俗称乌鱼、黑鱼、火头等,因其骨刺少,肉味鲜美,且具有去瘀生薪、生肌补血、滋补调养等多种生理功能,一直广受国内外消费者的亲睐。近十多年来,为顺应国内外贸易市场的需要,我国人工养殖乌鳢迅速发展。但由于高密度养殖、种质退化、环境恶化及人为因素干扰等多种原因,使得养殖乌鳢病害日趋增多,新的病原也不断出现。2013年5—6月,在浙江宁波部分乌鳢养殖池塘出现了批量死亡事件,病鱼主要症状为体表鳞片大面积脱落,有的烂眼、烂鳃、腹部膨胀、皮肤变黄并伴有少量体表出血现象; 解剖发现其肝脏颜色变黄,有淡色斑点,组织糊化,偶有腹水。作者对典型症状的病鱼进行了取样、病原分离和初步鉴定,认为引起本次乌鳢疾病的病原为金黄杆菌属(Chryseobacterium sp.)细菌。据资料显示[1—3],金黄杆菌(Chryseobacterium sp.)是一类革兰氏阴性菌,其广泛存在于土壤、水、植物等自然环境及医院环境,为条件致病菌,是人感染性疾病的重要病原,也可引起畜禽[4]和鱼类[5]、蛙类[6—9]、中华鳖[10]、河蟹[11]等多种水产动物严重疾病。目前国内外关于金黄杆菌病的研究资料很少,已有的报道大多是针对病症的描述、医院临床感染分布及耐药性分析等。为了尽快明确乌鳢金黄杆菌病的病原及致病机理,作者采用常规生理生化试验结合16S rRNA序列分析等方法对所分离的病原菌进行了鉴定,并对病原菌的胞外产物成分及致病性进行了研究,以期为鱼类金黄杆菌病的防治提供理论依据。
1 材料与方法
1.1 实验鱼来源
病鱼取自浙江宁波某乌鳢养殖池塘,共3批次,每次至少解剖3尾病鱼,体重350—500 g; 健康鱼购自宁波水产市场,体重350—400 g,外观检查并经抽样解剖检验确认无病。
1.2 病原菌的分离培养
取发病症状典型的乌鳢,无菌解剖取病鱼血液、肝、肾等组织分别划线接种于TSA平板上,28℃恒温培养48h后,挑取形态特征一致的5株优势菌进行纯培养,转接斜面保存备用。
1.3 病原菌形态观察及生理生化试验
取1.2纯培养的细菌转接TSA斜面,经28℃培养20h,用生理盐水制成约108cell/mL的菌悬液后作革兰氏染色及电镜(日立H-7650)观察。电镜样品采用醋酸铀染色10s。生理生化试验参考伯杰氏细菌鉴定手册(第九版)[12]和赵乃盺等资料[1,2]进行。
1.4 16S rRNA基因扩增及其序列分析
以分离菌基因组DNA为模板,用细菌通用引物27f和1492r进行16S rRNA序列的PCR 扩增[13]。PCR反应条件为:94℃预变性3min; 94℃变性30s,55℃复性1min,72℃延伸2min,30个循环; 最后72℃温育6min。PCR扩增产物用琼脂糖凝胶回收,连接到pMD18-T载体上,作TA克隆,转化至大肠杆菌DH5α,由上海英俊生物技术有限公司完成测序。
将所测的菌株的16S rRNA基因序列上传至Genbank数据库,并通过数据库中的BLAST进行序列相似性比较,选取与所测序列同源性高的已知菌株,采用ClustalX软件进行多序列比对(Multiple Alignments),利用MEGA5.05软件,采用邻位相连(Neighbor-joining method)构建系统发育树,通过自举分析(Bootstrap)进行置信度检测,自举数集1000次。
1.5 人工感染试验
根据1.3和1.4实验结果,所分离的5株菌相似度在99%以上,应为同一种菌,因此,人工感染实验仅采用WL20130525菌株进行。实验在120 cm×80 cm×50 cm的塑料桶中进行,每桶放养体重350—400 g的健康乌鳢10尾,连续充气,暂养2d后进行感染试验。WL20130525菌株培养24h后,用无菌生理盐水制成浓度约2.68×108、2.68×107、2.68×106、2.68×105、2.68×104cfu/mL的菌悬液,细菌量根据M cF浊度管结合活菌计数方法确定。感染组共10组,每个菌浓度肌肉注射20尾,每尾注射0.3 mL,对照组10尾注射同量无菌生理盐水。用SPSS软件计算细菌半致死浓度[14]。
1.6 WL20130525菌胞外产物的制备及活性测定
细菌胞外产物的制备采用玻璃纸提取法[15],考马斯亮蓝法测定胞外产物蛋白浓度。胞外产物活性采用杯碟法测定[16],在TSA培养基上进行。溶血试验血琼脂平板分别采用脱纤维绵羊血、脱纤维兔血、乌鳢血、鲫鱼血,pH 7.5。
1.7 WL20130525菌胞外产物的致病性试验
试验设5个实验组和1个对照组,分别在120 cm× 80 cm×50 cm的塑料桶中进行。每桶放养体重350—400 g健康乌鳢10尾,连续充气,暂养2d后进行试验。取1.6中制备的胞外产物,用PBS稀释成70、104、156、235、352 μg/mL系列浓度,每个浓度肌肉注射 10尾,每尾注射0.3 mL,对照组注射等量无菌PBS。胞外产物的注射量根据预实验确定。用改良寇氏法计算胞外产物半致死浓度[17]。
1.8 WL20130525菌的药敏试验
以涂布法接种0.1 mL WL20130525菌于TSA平板上,贴上药敏纸片,28℃恒温培养24h后,测抑菌圈直径。所用药敏纸片购于杭州滨和微生物试剂有限公司。
2 结果
本实验从患病乌鳢体内共分离5株病原菌,经形态观察、生理生化试验及16S rRNA基因序列分析,所分离的5株菌相似度在99%以上,应为同一种菌,因此,本实验结果仅针对WL20130525菌株。
2.1 病原菌的致病性
采用从患病乌鳢中分离到的病原菌WL20130525感染健康乌鳢,感染初期乌鳢躁动不安,狂游,有跃出水面的现象; 随着感染时间的延长,鱼活力明显下降,精神萎顿,感染第2天鱼开始出现死亡,体表注射部位明显红肿,感染3d后注射部位出现一块圆形病灶,该处鳞片向外张开,松动易脱落,鳞下体表充血肿胀; 随着病情加重,鱼鳞大片脱落,皮肤或成黄色,注射部位溃烂; 解剖发现腹腔内组织松软糜烂,肝肾略有肿大,肠组织黏连。5个感染菌浓度168h的死亡率分别为100%、90%、75%、40%、10%,WL20130525菌对乌 鳢的LD50为4.63×105cfu/mL。感染鱼症状与自然发病鱼相似,从感染发病鱼体内的血液、肝、肾等组织中又可以分离到与WL20130525菌株形态特征完全一致的菌株,说明WL20130525菌株确为乌鳢的致病菌。
2.2 WL20130525菌株形态及生理生化特征
革兰氏染色和电镜观察显示,WL20130525菌株为革兰氏阴性杆菌,菌体两端钝圆,大小约为(0.3—0.5)µm×(1.0—2.3)µm,大多单个散在,无鞭毛,不能运动,无荚膜和芽孢(图 1)在TSA平板上培养24h,菌落为黄色,圆形,直径约1—2 mm,表面隆起、光滑,边缘整齐且有光泽。生理生化特征见表 1,经查阅相关资料[1,2,13],可知WL20130525菌株为产吲哚金黄杆菌(Chryseobacteriumindologenes)。

表 1 WL20130525菌的生理生化特征Tab.1 Physiological and biochemical characteristics of WL20130525
2.3 16S rRNA基因序列及系统发育分析
利用引物27F和1492R扩增菌株的16S rRNA基因,共包括1549个碱基。在GenBank中的注册号为JX515610。将测定的16S rRNA基因序列与GenBank中的参考序列进行比对,找出相关序列,利用生物学聚类软件MEGA5.05进行系统发育树的构建(图 2)。从N-J法构建的系统发育树上可以看出菌株WL20130525属于金黄杆菌(Chryseobacterium)家族,与该菌序列最接近的两个菌株产吲哚金黄杆菌(C.indologenes)和黏金黄杆菌(C.gleum),其相似度分别为98.3%和97.8%。综合2.2和2.3结果,作者认为WL20130525菌株应为产吲哚金黄杆菌(Chryseobacterium indologenes)。
2.4 WL20130525菌胞外产物的活性和致病性
采用玻璃纸提取法制备WL20130525菌胞外产物,考马斯亮蓝法测得蛋白浓度为704 μg/mL。以杯碟法测定WL20130525菌胞外产物的酶活性,结果显示,用50 μL的胞外产物提取液所产生的各酶透明圈直径分别为卵磷脂酶31 mm,蛋白酶20 mm,淀粉酶13 mm,脂肪酶8 mm,说明酶活性卵磷脂酶>蛋白酶>淀粉酶>脂肪酶。WL20130525菌胞外产物对乌鳢血呈完全(β)溶血,对绵羊血和鲫鱼血部分溶血,对兔血不溶血。注射WL20130525胞外产物后,乌鳢发病症状与感染菌病鱼症状相似,5个实验组168h的死亡率分别为100%、60%、40%、20%、0,胞外产物对乌鳢的LD50为158.49 μg/kg体质量,说明WL20130525胞外产物具有较强毒性。
2.5 WL20130525菌药敏试验结果
从表 2可知,WL20130525菌对米诺环素、利福平、恩诺沙星、头孢西丁、强力霉素、依诺沙星、诺氟沙星等7种药物较敏感,对链霉素等10种药物耐药。
3 讨论
本实验从患病乌鳢(C.argus)体内分离到菌株WL20130525,经人工感染试验证实,WL20130525可使乌鳢的生活状态、体表和肝肾等主要组织器官出现明显的病症,且在人工感染患病鱼的体内又可分离到与WL20130525完全一致的菌株,说明WL20130525具有强致病性。通过对WL20130525的16S rRNA基因分析,发现它与产吲哚金黄杆菌(C.indologenes)的亲缘性最接近,且相似度为98.3%; 形态学观察及生理生化特征试验进一步确定WL20130525菌株为产吲哚金黄杆菌(C.indologenes)。
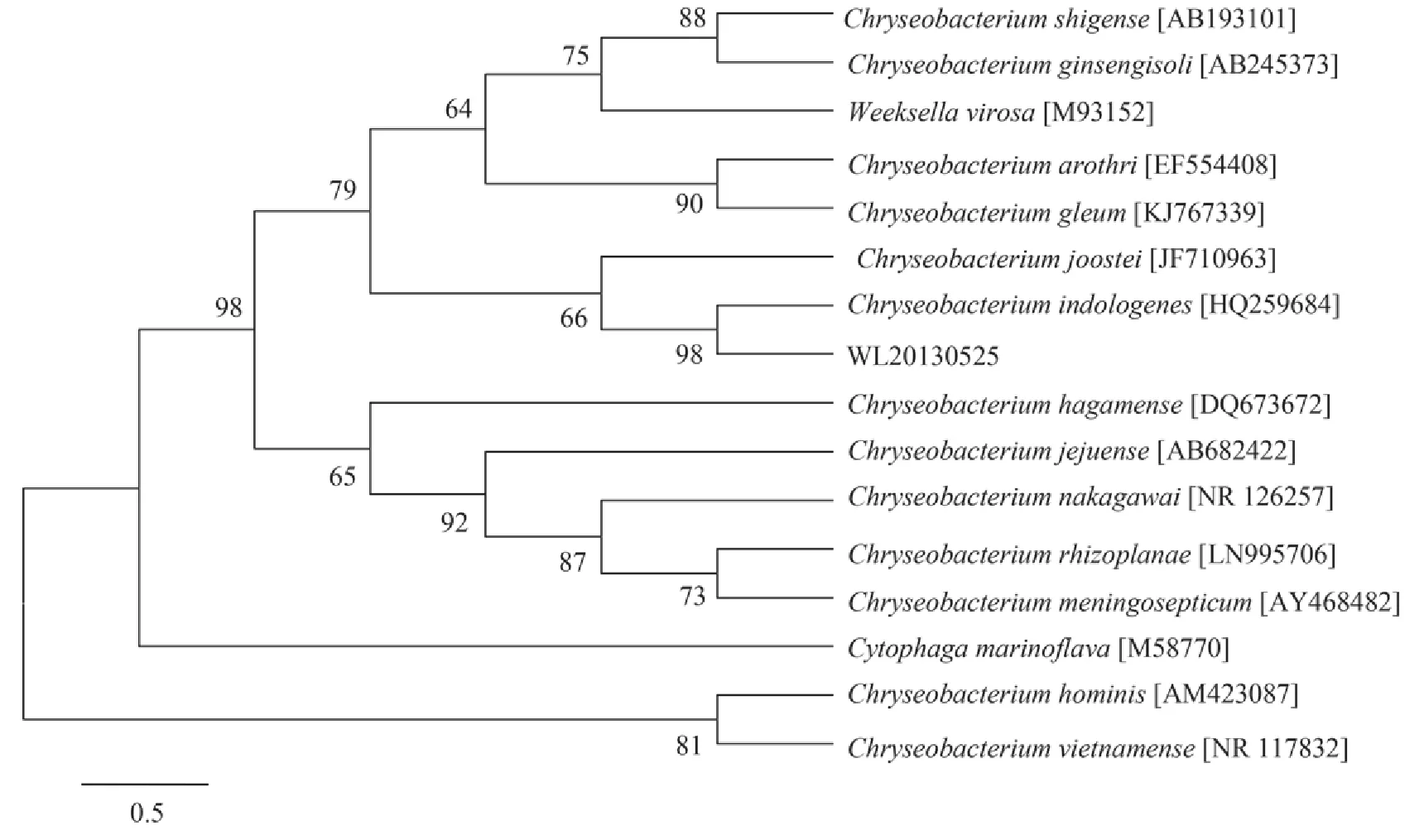
图 2 菌株WL20130525及其相关菌株16S rRNA基因邻位连接法系统发育树

表 2 WL20130525菌的药敏试验结果Tab.2 Drug sensitive test results of WL20130525
1994年Vandamme等根据菌体形态和生理生化特性提出将黄杆菌属(Flavobacterium)中的部分菌统一划归新建立的金黄杆菌属(Chryseobacterium)[18],主要有大比目鱼金黄杆菌(C.balustinum)、黏金黄杆菌(C.gleum)、产吲哚金黄杆菌(C.indologenes)、脑膜脓毒性金黄杆菌(C.meningosepticum)、吲哚金黄杆菌(C.indoltheticum)、大菱鲆金黄杆菌(C.scophthalmum)等6个种,这一归属和命名得到了普遍认可。后来赵乃盺等根据Vandamme的分类及金黄杆菌属的特征,在原有6个种的基础上增加了污水金黄杆菌(C.defluvii)、台湾金黄杆菌(C.formosense)、宙斯特氏金黄杆菌(C.joostei)、C.daecheongense、C.Miricola等共11个种[1]。
自1992年首次发现豹蛙产吲哚金黄杆菌(C.indologenes)感染性疾病,其后西班牙、日本、中国等多个国家和地区陆续有报道产吲哚金黄杆菌引起人类疾病[19,20]。据资料显示,产吲哚金黄杆菌是医院感染的主要病原菌之一,可引起人肺炎、败血症、脓毒血症、局部组织伤口感染等严重疾病,由于其耐药范围广、临床症状与体征复杂,因此死亡率高,近几年已引起国内外医学界的广泛重视[3,19]。目前关于产吲哚金黄杆菌(C.indologenes)感染动物的报道不多,已有的资料大多也是针对病症的描述,如Olson等[2 1]报道了该菌引起豹蛙败血症,Callon等[22]报道了该菌感染奶羊,祖国掌等[11]报道该菌可引起河蟹疾病,Kampfer等[23,24]报道了该菌可引起大西洋鲑鱼疾病,Ilardi[25]等报道了该菌感染了大马哈鱼。而至今还未见国内有关产吲哚金黄杆菌对养殖鱼类感染致病的报道。由于产吲哚金黄杆菌(C.indologenes)是人和动物的共患病原,它不仅对人类健康严重危害,而且对养殖动物也产生潜在威胁,因此,值得进一步的关注和深入研究。
目前关于产吲哚金黄杆菌致病机理的研究很少,已有的研究显示可能与其胞外蛋白有关[18]。本实验结果也显示,WL20130525菌胞外产物具有强致病性,而其胞外产物中蛋白酶活性较强。此外,已有的研究也表明,产吲哚金黄杆菌具有多重耐药性,其耐药机制复杂,除细菌外膜通透性屏障外,还存在多种超广谱β-内酰胺酶及金属β-内酰胺酶,可导致碳青霉烯类、头孢菌素类、氨基糖甙类等抗生素广泛耐药[3,26]。本实验结果显示,WL20130525菌对米诺环素、利福平、头孢西丁、强力霉素、恩诺沙星、依诺沙星、诺氟沙星等7种化学疗剂高度敏感,但由于农业部第2292号公告已把恩诺沙星、依诺沙星、诺氟沙星等列入禁用渔药,2016年12月31日起禁止使用,因此可考虑把米诺环素、利福平、头孢西丁、强力霉素等4种作为治疗乌鳢金黄杆菌病的首选药物。由于产吲哚金黄杆菌广泛存在于空气、水、土壤等自然环境中,为条件致病菌,且化学药物大量的使用不仅会滋生大量的耐药菌株,而且污染环境,甚至危害人类食品安全,因此,该病的控制一定要以防为主,特别是在初夏和初秋季节是该病的高发期。
参 考 文 献:
[1]Zhao N X,Yuan G Y.Name and Classification of Medical Bacteria Identification(third edition)[M].Jinan:Shandong University Press.2013,115—120,173—179[赵乃盺,苑广盈.医学细菌名称及分类鉴定(第三版).济南:山东大学出版社.2013,115—120,173—179]
[2]Fang H,Chen C Z,Zhang X J.Aquaculture Animal Pathogenic Bacterium[M].Beijing:China Agriculture Press.2010,499—517[房海,陈翠真,张晓君.水产养殖动物病原细菌学.北京:中国农业出版社.2010,499—517]
[3]Chen X B.Distribution changes of STAPHYLOCOCCUS spp and drug resistance[J].Chinese Journal of Nosocomiology,2011,21(4):772—774[陈晓蓓.医院金黄杆菌属分布变迁与耐药性研究.中华医院感染学杂志,2011,21(4):772—774]
[4]Hu W J,Song Y H,Qin J C,et al.Intrauterine flora change of postpartum cows and its pathogenicity[J].Hubei Agricultural Sciences,2014,54(17):4115—4119[胡文举,宋艳画,秦佳辰,等.产后牛子宫内菌群变化规律及致病性研究.湖北农业科学,2014,54(17):4115—4119]
[5]Huang Z J,He J G,Weng S P,et al.The isolation and preliminary identification of pathogenic bacteria from the diseased mandarin fish[J].Microbiology,1999,26(4):241—246[黄志坚,何建国,翁少萍,等.鳜鱼细菌性病原的分离鉴定及致病性初步研究.微生物学通报,1999,26(4):241—246]
[6]Bernardet J F,Vancanneyt M,Matte-Tailliez O,et al.Polyphasic study of Chryseobacterium strains isolated from diseased aquatic animals[J].Systematic and Applied Microbiology,2005,28(7):640—660
[7]Ye X P,Yang Z G,Luo Y Z.A study on the pathogen and technioue of prevention of ecnephalitis occvred in cvltured bull-from(Rana Catesbeiana Shaw)[J].Journal of Zhejiang Institute of Aquaculture,1996,15(4):301—304[叶雪平,杨广智,罗毅志.牛蛙脑膜炎(歪脖子病)病原分离及防治技术研究.浙江水产学院学报,1996,15(4):301—304]
[8]Zhou Y C,Zhu C H,Chen G H,et al.Isolation and identification of pathogen of the cataract disease and its immunological control in Rana tigrina rugulosa[J].Journal of Shanghai Fisheries University,2001,10(1):16—21[周永灿,朱传华,陈国华,等.虎纹蛙白内障病病原的分离鉴定及其免疫防治.上海水产大学学报,2001,10(1):16—21]
[9]Chen A P,Jiang Y L,Qian D,et al.Chryseobacterium Meningosepticum of Frog(Rana spp.)[J].China Fisheries,2012,5:51[陈爱平,江育林,钱冬,等.蛙脑膜炎败血金黄杆菌病.中国水产,2012,5:51]
[10]Cai W Q,Sun P F,Zhu Z W,et al.Study on Flavobacterium memingoseptium disease in the soft-shelled turtle(Trionyx sinensis)[J].Fisheries Science & Technology Information,1997,24(4):156—161[蔡完其,孙佩芳,朱泽闻,等.中华鳖脑膜炎败血性黄杆菌病的研究.水产科技情报,1997,24(4):156—161]
[11]Zu G Z,Li J N,Yu W Y,et al.The study of bacterial disease on raising Eriocheir sinensisi[J].Journal of Aquaculture,2007,28(2):1—4[祖国掌,李槿年,余为一,等.河蟹细菌病病原分离与鉴定.水产养殖,2007,28(2):1—4]
[12]Holt J G,Krieg N R,Sneath P H,et al.Bergey's Manual of Determinative Bacteriology[M].Ninth Edition.Baltimore.Williams and Wilkins.1994,507—508
[13]Li N,Guo H Z,Jiao R,et al.Identification and pathogenicity of bacterial pathogens isolated in an outbreak on bacterial disease of Ctenopharyngodon idellus[J].Acta Hydrobiologica Sinica,2011,35(6):980—987[李楠,郭慧芝,焦冉,等.草鱼的一种急性细菌性传染病病原的分离鉴定及致病性研究.水生生物学报,2011,35(6):980—987]
[14]Xiong H M,Wei B Q,Wei R J,et al.Calculation of median lethal dose(LD50)for Yersinia pestis by SPSS pac-kage[J].Chinese Journal of Zoonoses,2013,29(11):1127—1130[熊浩明,魏柏青,魏荣杰,等.用SPSS软件计算鼠疫菌半数致死量(LD50).中国人兽共患病学报,2013,29(11):1127—1130]
[15]Wang B,Yu L P,Yuan T,et al.Pathogenicity of extracellular products of Vibrio harveyi to Fugu obscures[J].Journal of Fishery Sciences of China,2010,17(1):88—95[王斌,于兰萍,袁甜,等.哈氏弧菌胞外产物对红鳍东方鲀的致病性.中国水产科学,2010,17(1):88—95]
[16]Jin S,Zheng T L,Wang G L,et al.Pathogenicity of Extracellular Products of Vibrio alginolyticus to Great Yellow Croaker,Psedosciaena crocea[J].Chinese Journal of Veterinary Science,2004,24(17):439—441[金珊,郑天伦,王国良,等.溶藻弧菌胞外产物对大黄鱼的致病性.中国兽医学报,2004,24(17):439—441]
[17]Gu B,Zhang Z,Li Y P,et al.Summary of median lethal dose and its calculation method[J].China Occupational Medicine,2009,36(6):507—508,511[顾兵,张政,李玉萍,等.半数致死量及其计算方法概述.中国职业医学,2009,36(6):507—508,511]
[18]Vandamme P,Bernardet J F,Segers P,et al.New perspectives in the classification of the flavobacteria:Description of Chryseobacterium gen.nov.,Bergeyella gen.nov.,and Empedobacter nom.Rev[J].International Journal of Systematic Bacteriology,1994,44(4):827—831
[19]Tian G Z,Wang X L.Advances in the study of Flavobacterium indologenes[J].Journal of Pathogen Biology,2012,5(2):134—136[田国忠,王晓蕾.产吲哚黄杆菌研究进展.中国病原生物学杂志,2012,5(2):134—136]
[20]Hsueh P R,Hsiue T R,Wu J J,et al.Flavobacterium indologenes bacteremia:clinical and microbiological characteristics[J].Clinical Infectious Diseases,1996,23(3):550—555
[21]Olson M E,Gard S,Brown M,et al.Flavobacterium indologenes infection in leopard frogs[J].Journal of American Veterinary Medical Association,1992,201(11):1766—1770
[22]Callon C,Dut hoit F,Delbs C,et al.Stability of microbial communities in goat milk during a lactation year:molecular approaches[J].Systematic and Applied Microbiology,2007,30(7):547—560
[23]Kämpfer P,Fallschissel K,Avendaño-Herrera R.Chryseobacterium chaponense sp.nov.,isolated from farmed Atlantic salmon(Salmo salar)[J].International Journal of Systermatic Evolutionary Microbiology,2011,61(3):497—501
[24]Ilardi P,Abad J,Rintamäki P,et al.Phenotypic,serological and molecular evidence of Chryseobacterium piscicola in farmed Atlantic salmon,Salmo salar L.[J].Journal of Fish Diseases,2010,33(2):179—181
[25]Ilardi P,Avendaño-Herrera R.Isolation of Flavobacterium like bacteria from diseased salmonids cultured in Chile[J].Bulletin of the European Association of Fish Pathologists,2008,28(5):176—185
[26]Wang S Y,Mu H,Liu Y H.172 strains produce in doles golden coli clinical distribution and drug resistance analysis[J].Shandong Medical Journal,2013,53(27):84—85[王世瑜,穆红,刘烨华.172株产吲哚金黄杆菌的临床分布及耐药分析.山东医药,2013,53(27):84—85]
IDENTIFICATION AND ANALYSIS ON EXTRACELLULAR PRODUCTS CHARACTERISTICS OF CHRYSEOBACTERIUM INDOLOGENES ISOLATION FROM CHANNA ARGUS
WANG Xin-Yi,HAN Yan-Nan,JIN Shan,WANG Li,ZHAO Qing-Song and CHEN Yin-Er
(School of Marine Sciences in Ningbo University,Ningbo 315211,China)
关键词:乌鳢; 产吲哚金黄杆菌; 生理生化鉴定; 16S rRNA; 胞外产物; 抗菌药物
Key words:Channa argus; Chryseobacterium indologenes; Physiological and biochemical identification;16S rRNA; Extracellular products; Antimicrobial agents
doi:10.7541/2016.86
收稿日期:2015-09-15;
修订日期:2015-12-16
基金项目:海洋公益性行业专项经费资助项目(201105007); 宁波大学水产浙江省重中之重一级学科开放基金(xkzsc1503)资助[Supported by the Public Science and Technology Research Funds Projects of Ocean(No.201105007); Ningbo University Aquaculture in Zhejiang Province Priority Level 1 Subject Open Fund(No.xkzsc1503)]
作者简介:王鑫毅(1995—),男,浙江嘉兴人; 本科; 研究方向为水产动物病害防控。E-mail:578405056@qq.com
通信作者:金珊(1964—),教授; E-mail:jinshan@nbu.edu.cn
中图分类号:S941.42
文献标识码:A
文章编号:1000-3207(2016)03-0641-06

