酪蛋白激酶1α的功能和相关肿瘤的研究进展
万 倩 杨雅芝 李 剑
(南昌大学第二附属医院,江西 南昌 330006)
·综述·
酪蛋白激酶1α的功能和相关肿瘤的研究进展
万倩杨雅芝李剑
(南昌大学第二附属医院,江西南昌330006)
〔关键词〕酪蛋白激酶Iα;Wnt/β-Cat信号通路;p53;肿瘤
酪蛋白激酶(CK)1α广泛分布于各类真核生物中,是CK1家族成员(CK1α,β,δ,ε,γ1,γ2,γ3)之一,序列结构高度保守。在哺乳动物中,CK1α参与多种细胞生理过程,包括膜转运,细胞周期,染色体分离,细胞凋亡和细胞分化等。此外,CK1α还参与P53,Wnt/β-Cat等信号通路。本文将CK1α的功能作一综述,为进一步研究其在肿瘤治疗中的地位提供参考。
1CK1α与P53
P53是极为重要的抑癌基因,具有维持基因组稳定和防止细胞恶变等重要功能〔1〕。MDMX是MDM2的同源蛋白,以往研究发现MDMX可与MDM2协作使p53降解〔2〕。
Wu等〔3〕研究表明,MDMX与p53结合位点位于N-末端结构域,并被中央酸性域所抑制。中央酸性域通过分子间相互作用来竞争与P53结合位点结合。CK1α则与中央酸性域结合,并磷酸化中央酸性域的S289位点(图1),从而破坏中央酸性域的分子间相互作用,增加MDMX的N-末端结合P53的亲和力。然而在应激状况下,CK1α可通过直接磷酸化p53的Thr18和Ser20位点〔4〕,从而激活p53。因此,CK1α可作为调控细胞p53活性的微调工具。此外,DNA损伤激活p53,其机制可能是破坏CK1α-MDMX蛋白的相互作用,从而降低 MDMX对p53的亲和力〔5〕。总之,根据使用不同的细胞系的研究结果显示,CK1α既可以通过直接磷酸化P53使p53活性增强,也可以通过与MDM2蛋白之间的相互作用使P53活性降低。
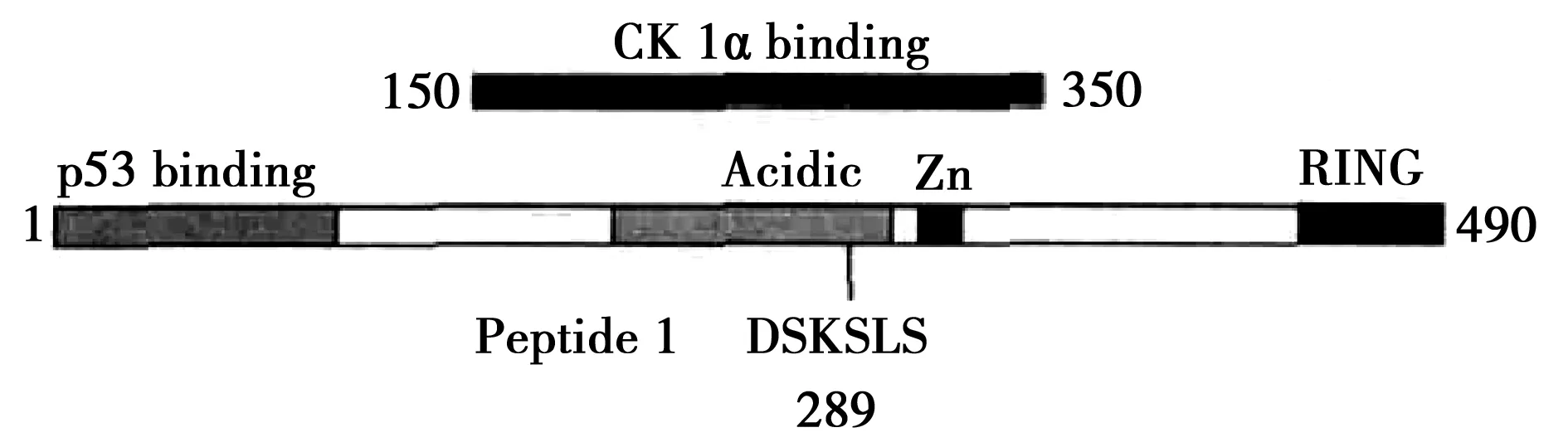
图1 CK1α、MDMX 和p53相互作用示意图
2CK1α与Wnt信号通路
正常细胞和非增殖细胞中缺乏Wnt信号,因此Wnt/β-Cat信号通路的异常激活与人类的肿瘤发生密切相关〔6〕。β-连环蛋白(β-Cat)是Wnt/β-Cat信号通路中的关键分子,最初是作为钙粘连蛋白复合体的一种相关蛋白,然而在随后的研究中,β-Cat基因则更倾向于是一种原癌基因〔7〕。β-Cat蛋白在细胞内广泛积聚与肿瘤的发生相关,并且在一些肿瘤中,存在生殖系的突变,从而破坏β-Cat降解〔8〕。
当缺乏Wnt信号时,腺瘤性息肉蛋白(APC)和轴蛋白(Axin)所形成的破坏复合体(DC)结合细胞质中的β-Cat,有助于CK1α在β-Cat的Ser45位点磷酸化,进而蛋白酶体降解β-Cat〔9〕。然而最新一项研究表明,CK1α能磷酸化Jade-1蛋白,从而解除Jade-1蛋白对β-Cat的抑制作用〔10〕。Jade-1蛋白作为一种E3泛素连接酶,结合β-Cat,从而使蛋白酶体降解β-Cat〔11,12〕。
总之,CK1α既可以与β-Cat的破坏复合体结合降解β-Cat,也可以磷酸化Jade-1蛋白,阻止Jade-1降解β-Cat。
3CK1α与肿瘤
CK1α的表达异常与肿瘤的发生、发展有着密切联系。目前研究结果显示,CK1αRNA在脑肿瘤、前列腺癌、淋巴瘤和白血病中高表达,而在膀胱癌、肺癌和黑色素瘤中有低表达的趋势。在黑色素瘤中,CK1α的蛋白水平是低表达的,且其表达下调主要是由CK1α基因的启动子甲基化所介导〔13〕。但是与之相矛盾的一项研究表明,CK1α在黑色素瘤中的表达比良性痣中的表达要高〔14〕。
3.1CK1α与黑色素瘤在黑色素瘤中,CK1α被认为是一种新的抑癌基因和CK1α蛋白是调节β-Cat信号的关键因子。在原发性黑色素瘤细胞系中敲除CK1α基因后,黑色素瘤细胞系的体外侵袭能力明显增加,然而抑制该细胞的β-Cat信号可使敲除CK1α基因的黑色素瘤细胞的侵袭性降低,说明黑色素瘤细胞的侵袭性依赖于β-Cat信号。此外,使用低致瘤性的黑色素瘤细胞构建黑色瘤模型,然后再敲除CK1α基因,发现成瘤能力增加且和β-Cat信号处于稳定状态〔15〕。另一项研究表明,使用药物增加CK1α蛋白水平表达后,β-Cat信号激活,显著降低黑色素瘤细胞的迁移能力〔16〕。此外,Chien等〔17〕发现高β-Cat蛋白水平可作为预示黑色素瘤较好预后的指标,β-Cat结合MITF通过促进细胞分化,从而抑制肿瘤迁移〔18〕。然而在Chien等〔19〕最近的一项研究中发现,使用BRAF抑制剂治疗高β-Cat蛋白水平的黑色素瘤患者后,患者的总生存期很短。这些不同的研究结果可能与不同的黑色素瘤类型相关,因为可能还存在着一些未确定的黑色素亚型。
3.2CK1α与血液恶性肿瘤
3.2.1CK1α与急性粒细胞白血病在一项体内筛选RNA干扰小鼠原代白血病MLL-AF9细胞的研究结果中,CK1α位于所列出的白血病必需基因中的首位〔20〕。Jaras等〔21〕的研究表明,使用CK1α抑制剂D4476可选择性杀死急性粒细胞白血病(AML)白血病干细胞,并避免杀伤正常的造血干/祖细胞。CK1α以类似于核糖体S6激酶1、2的方式〔22〕调节RPS6的活性(具体为CK1α磷酸化RPS6的丝氨基残基247位点),从而加强上游位点的磷酸化〔23〕。Jaras认为,CK1α杀伤AML白血病干细胞的可能的机制是通过抑制CK1α减少RPS6的磷酸化,从而激活p53〔21〕。
3.2.2CK1α与多发性骨髓瘤有研究表明,CK1α在冒烟型骨髓瘤细胞中的表达高于正常血浆细胞〔24〕,并且在多发性骨髓瘤(MM)和浆细胞白血病患者中CK1α的表达显著高于MGUS患者〔25〕。与该结果相一致的是,Hu等〔26〕的研究表明,CK1α在所测试的MM细胞株中都表达,并且使用D4476抑制CK1α后,引起MM细胞G0/G1期阻滞,G2/M期延长,并诱导MM细胞凋亡。
Hu等〔26〕的研究结果显示,在MM细胞中靶向CK1α可影响多条经典的细胞增殖和凋亡的通路,例如CDKN1B,p53,FADD,IFNa,TNF和Lin9。具体来说,CK1α可通过直接接触或增加MDM2活性改变p53的磷酸化状态,从而抑制p53的活性。然而该实验结果与CK1a在AML中不同,p53在CK1a诱导的MM细胞毒性中并没有发挥关键作用。因为P53突变的RPMI 8226细胞要比野生型p53的MM1S细胞对D4476和CK1α shRNA更敏感。
3.2.3CK1α与骨髓异常综合征Schneider等〔27〕的研究发现,CK1α基因位于5q缺失(del 5q)骨髓综合征(MDS)的共同缺失区,并被认为是抑癌基因。并且CK1α单倍体不足导致造血干细胞扩增和竞争性增殖优势,而纯合性缺失导致造血干细胞衰竭。此外还发现CK1α杂合性缺失的细胞要比CK1α基因完整的细胞对CK1α抑制剂更为敏感。因而提示CK1α基因属于“由于部分丧失拷贝数改变产生的癌症负累”(CYCLOPS)基因〔28〕,该基因的一个拷贝频繁丢失,但两个拷贝却从不一起丢失,表明至少一个拷贝对细胞生存是必不可少的。
Xu等〔29〕研究提示,del(5q)MDS的发生发展与核β-Cat的表达相关。而CK1α是β-Cat破坏复合物的组成成分,并且是调节β-Cat活性的关键因子〔30〕。因而Schneider等〔27〕认为,CK1α单倍体不足增强HSC自我更新,可能与细胞核β-Cat的积聚,细胞周期蛋白D1的感应,和静止LT-HSCs细胞的释放相关。
总的来说,CK1α在血液恶性肿瘤发生发展中发挥重要作用,并可望成为一个新的治疗靶点。
4参考文献
1Vousden KH, Lane DP.p53 in health and disease〔J〕.Nat Rev Mol Cell Biol,2007;8(4):275-83.
2Waning DL,Lehman JA,Batuello CN,etal.Controlling the Mdm2-Mdmx-p53 Circuit〔J〕.Pharmaceuticals(Basel),2010;3(5):1576-93.
3Wu S,Chen L,Backer A,etal.Casein kinase 1alpha regulates an MDMX intramolecular interaction to stimulate p53 binding〔J〕.Mol Cell Biol,2012;32(23):4821-32.
4Cheong JK, Virshup DM.Casein kinase 1:complexity in the family〔J〕.Int J Biochem Cell Biol,2011;43(4):465-9.
5Venerando A,Marrn D,Cozza G,etal.Isoform specific phosphorylation of p53 by protein kinase CK1〔J〕.Cell Mol Life Sci,2010;67(7):1105-18.
6Gujral TS,MacBeath G.A system-wide investigation of the dynamics of Wnt signaling reveals novel phases of transcriptional regulation〔J〕.PLoS One,2010;5(4):e10024.
7Mason MD,Davies G,Jiang WG.Cell adhesion molecules and adhesion abnormalities in prostate cancer〔J〕.Crit Rev Oncol Hematol,2002;41(1):11-28.
8Baron R, Kneissel M.WNT signaling in bone homeostasis and disease:from human mutations to treatments〔J〕.Nat Med,2013;19(2):179-92.
9Li VS,Ng SS,Boersema PJ,etal.Wnt signaling through inhibition of beta-catenin degradation in an intact Axin1 complex〔J〕.Cell,2012;149(6):1245-56.
10Borgal L,Rinschen MM,Dafinger C,etal.Casein kinase 1 alpha phosphorylates the Wnt regulator Jade-1 and modulates its activity〔J〕.J Biol Chem,2014;289(38):26344-56.
11Chitalia VC,Foy RL,Bachschmid MM,etal.Jade-1 inhibits Wnt signalling by ubiquitylating beta-catenin and mediates Wnt pathway inhibition by pVHL〔J〕.Nat Cell Biol,2008;10(10):1208-16.
12Borgal L,Habbig S,Hatzold J,etal.The ciliary protein nephrocystin-4 translocates the canonical Wnt regulator Jade-1 to the nucleus to negatively regulate beta-catenin signaling〔J〕.J Biol Chem,2012;287(30):25370-80.
13Sinnberg T,Menzel M,Kaesler S,etal.Suppression of casein kinase 1alpha in melanoma cells induces a switch in beta-catenin signaling to promote metastasis〔J〕.Cancer Res,2010;70(17):6999-7009.
14Sun D,Zhou M,Kowolik CM,etal.Differential expression patterns of capping protein,protein phosphatase 1,and casein kinase 1 may serve as diagnostic markers for malignant melanoma〔J〕.Melanoma Res,2011;21(4):335-43.
15Sinnberg T,Menzel M,Ewerth D,etal.beta-Catenin signaling increases during melanoma progression and promotes tumor cell survival and chemoresistance〔J〕.PLoS One,2011;6(8):e23429.
16Vaid M,Prasad R,Sun Q,etal.Silymarin targets beta-catenin signaling in blocking migration/invasion of human melanoma cells〔J〕.PLoS One,2011;6(7):e23000.
17Chien AJ,Moore EC,Lonsdorf AS,etal.Activated Wnt/beta-catenin signaling in melanoma is associated with decreased proliferation in patient tumors and a murine melanoma model〔J〕.Proc Natl Acad Sci USA,2009;106(4):1193-8.
18Lucero OM,Dawsom DW,Moon RT,etal.A re-evaluation of the “oncogenic” nature of Wnt/beta-catenin signaling in melanoma and other cancers〔J〕.Curr Oncol Rep,2010;12(5):314-8.
19Chien AJ,Haydu LE,Biechele TL,etal.Targeted BRAF inhibition impacts survival in melanoma patients with high levels of Wnt/beta-catenin signaling〔J〕.PLoS One,2014;9(4):e94748.
20Miller PG,Al-Shahrour F,Hartwell KA,etal.In Vivo RNAi screening identifies a leukemia-specific dependence on integrin beta 3 signaling〔J〕.Cancer Cell,2013;24(1):45-58.
21Jaras M,Miller PG,Chu LP,etal.Csnk1a1 inhibition has p53-dependent therapeutic efficacy in acute myeloid leukemia〔J〕.J Exp Med,2014;211(4):605-12.
22Magnuson B,Ekim B, Fingar DC.Regulation and function of ribosomal protein S6 kinase(S6K) within mTOR signalling networks〔J〕.Biochem J,2012;441(1):1-21.
23Hutchinson JA,Shanware NP,Chang H,etal.Regulation of ribosomal protein S6 phosphorylation by casein kinase 1 and protein phosphatase 1〔J〕.J Biol Chem,2011;286(10):8688-96.
24Zhan F,Barlogie B,Arzoumanian V,etal.Gene-expression signature of benign monoclonal gammopathy evident in multiple myeloma is linked to good prognosis〔J〕.Blood,2007;109(4):1692-700.
25Dickens NJ,Walke BA,Leone PE,etal.Homozygous deletion mapping in myeloma samples identifies genes and an expression signature relevant to pathogenesis and outcome〔J〕.Clin Cancer Res,2010;16(6):1856-64.
26Hu Y,Song W,Cirstea D,etal.CSNK1alpha1 mediates malignant plasma cell survival〔J〕.Leukemia,2015,29(2):474-82.
27Schneider RK,Adema V,Heckl D,etal.Role of casein kinase 1A1 in the biology and targeted therapy of del(5q) MDS〔J〕.Cancer Cell,2014;26(4):509-20.
28Nijhawan D,Iack TI,Ren Y,etal.Cancer vulnerabilities unveiled by genomic loss〔J〕.Cell,2012;150(4):842-54.
29Xu J,Suzuki M,Niwa Y,etal.Clinical significance of nuclear non-phosphorylated beta-catenin in acute myeloid leukaemia and myelodysplastic syndrome〔J〕.Br J Haematol,2008;140(4):394-401.
30Cheong JK, Virshup DM.Casein kinase 1:Complexity in the family〔J〕.Int J Biochem Cell Biol,2011;43(4):465-9.
〔2015-10-22修回〕
(编辑李相军)
基金项目:国家自然科学基金资助项目(No.13006091)
通讯作者:李剑(1970-),女,教授,博士生导师,主要从事干细胞基础与临床研究。
〔中图分类号〕R-1
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2782-03;
doi:10.3969/j.issn.1005-9202.2016.11.104
第一作者:万倩(1991-),女,硕士,主要从事血液学基础与临床研究。

