中山市新生儿听力筛查联合耳聋基因检测结果分析
熊怡 钟梅 李欣 陈文强 黄湘 张艳芳 唐海深
婴幼儿早期的听力损失,若不及时干预或治疗可导致明显的或永久的功能障碍,从而由聋致哑严重影响生活质量[1]。新生儿听力筛查为全国新生儿重点筛查三大疾病之一,为了更好地在全国范围内开展新生儿听力筛查工作,2010年卫生部颁布了《新生儿听力筛查技术规范》,旨在尽早发现有听力障碍的个体,并及时给予适当干预,避免由聋致哑[2-3]。目前,新生儿听力筛查的物理方法主要为耳声发射(evoked otoacoustic emission,EOAE)和脑干诱发电位(auditory brainstem respons,ABR)。
随着新生儿听力筛查工作的深入进行,单纯听力筛查在应用中的局限性也逐渐被发现。临床中发现,并非所有患儿出生后立即表现出来听力损失,如SLC26A4基因突变引起的迟发性听力损失、线粒体 DNA 12SrRNA基因突变引起的听力损失等,患儿出生时听力筛查结果均为通过。美国婴幼儿听力联合会2000年报告提出:由于新生儿听力筛查中的假阴性,约有10%~20%的迟发性和进行性听力损失将漏诊[4]。2007年,新生儿听力及基因联合筛查的理念被首次提出[5],即在传统听力筛查的基础上联合耳聋基因筛查,基因筛查即新生儿出生时或出生后3d内分别采集新生儿脐带血或足跟血对耳聋易感基因进行筛查。近年来,新生儿耳聋基因检测和听力联合筛查越来越被医学界所关注。
本研究对906例新生儿采集脐静脉血,利用耳聋基因芯片检测4个国人中常见的耳聋相关基因(GJB2,GJB3,SLC26A4和线粒体 DNA 12SrRNA基因)中的9个热点突变,同时用耳声发射技术对新生儿进行听力初筛,对复筛未通过者,采用脑干听觉诱发电位技术进行听力复筛。建立新生儿听力筛查新模式,论证耳聋基因芯片检测在对非综合征性耳聋出生缺陷三级预防中的有效性。
资料与方法
一、研究对象
2015年9月至2016年2月间在中山市妇幼保健院出生的 906例新生儿,在新生儿监护人知情同意的情况下进行听力和耳聋基因的联合筛查,并签署知情同意书。其中男性489例,女性417例。
二、研究材料与方法
1. 材料:用含 EDTA的真空采血管采集新生儿脐静脉血2~3 mL, 采用DNA提取系统试剂盒,进行样本的细胞裂解、消化蛋白、沉淀DNA、清洗DNA、溶解DNA等步骤提取基因组DNA ,采用紫外分光光度法对DNA定量和纯度进行检测,使DNA浓度为200ng/L,纯度为OD值(260nm/ 280nm)1.8~ 2.0,可置于-80℃保存备用。
2.耳聋基因突变检测:按照耳聋基因突变检测芯片试剂盒(北京博奥生物)的操作说明书,测试4个国人中常见的耳聋相关基因中的9个热点突变,包括GJB2(35delG176del16 235delC 299delAT)、GJB3(538C>T)、SLC26A4(IVS7-2A>G 2168A>G)和线粒体 DNA 12SrRNA(A1555G,1494 C>T)。
2.1 PCR反应:样本 PCR扩增分别在 A、B 两个反应体系 中 进 行。 配制A反应体系的:引 物 混 合 物 A112.5 μl,试剂混合物 A2 4.5 μl,基因组DNA 3.0 μl,总反应体系为 20 μl。配制 B反应体系:引物混合物 B1 12.5 μl,试 剂 混 合 物 B2 4.5 μl,基 因 组DNA3.0 μl,总反应体系为 20 μl。
2.2 扩增反应条件:37 ℃ 10 min,95 ℃ 15 min,96 ℃ 1 min,后预变性,再94 ℃ 30 s,55 ℃ 30 s,70 ℃ 45 s 共 32 个循环,最后60 ℃ 10 min完成扩增。其中 94 ℃ 降至 55 ℃ 时下降速率为0.4 ℃/s,55 ℃ 降至 70 ℃ 时上升速率为0.2 ℃/s
2.3杂交:对PCR产物加热,至95℃变性5 min;立即放置冰浴中3min;从同一样品A、B两个不同的扩增体系管中分别取2.5μl PCR产物加入至10μl杂交缓冲液管中,得到杂交混合液;将杂交混合液加至芯片的微阵列点样区域,加盖,封闭杂交盒;置于50℃杂交仪,保温1h。
2.4 洗片与干燥将杂交后的芯片取出,放置芯片架在洗片机中洗涤,先以42℃洗涤液Ⅰ洗涤2min;洗涤完成后迅速取出,再继续以42℃洗涤液Ⅱ洗涤2min,洗涤2次再将其以1 200rpm离心2min甩干。
2.5 以LuxScanTM 10K/B微阵列芯片扫描仪以90的激光扫描强度和532 nm激发波长进行芯片扫描。
3.听力筛查
EOAE测试:初次筛查在安静的妇产科病房床边。每次均在新生儿吃过奶处于安静或自然睡眠状态时进行。耳用棉签常规清洁耳道,以防外耳道分泌物影响测试结果。采用德国ERO-SCAN耳声发射听力筛查仪进行检测。仪器自动显示“PASS”为通过。若出现“REFER”则为不通过。
ABR测试;初筛不通过,则在出生后42天进行ABR复筛。先用 95% 酒精脱脂,将记录电极置于前额,参考电极放于颈后同侧耳垂内侧;极间电阻 ≤10kΩ,刺激声为30dBnHL的短声 ;刺激声相位交替 ,应用回旋式模板信号提取ABR的V波 ,V 波反应阈≥ 30d Bn HL 诊断为异常。ABR检测未通过者,则行听力学评估。
结 果
一、新生儿听力筛查结果
906例新生儿中,初筛通过804例,通过率为88.74%,初筛未通过102例,其中双耳未通过58例,右耳未通过30例,左耳未通过14例,未通过率为11.26%;89例42天后进行复筛,复筛未通过9例,其中双耳未通过3例,左、右耳未通过各3例。
二、新生儿耳聋基因筛查结果
906例新生儿中,43例携带耳聋基因突变,总携带率为4.75%(43/906)。其中,31例为GJB2基因突变,携带率为3.42%(24/906) (GJB2 235delC基因突变24例,GJB2 299del AT基因突变6例,GJB2 176del16基因突变1例);7例为SLC26A4 IVS7-2 A>G 基因杂合突变,携带率为0.77% (7/906);2例为12SrRNA m.1555A>G突变,携带率为0.22%(2/906);3例为GJB3 538C>T 基因突变,携带率为0.33%(3/906)。
三、耳聋基因与听力联合筛查结果
在804例通过了听力初筛的新生儿中,有33例耳聋基因检测异常,占4.10%;其余102例听力初筛未通过的新生儿中,10例耳聋基因检测异常,占9.80%;确诊具有听力障碍的患儿中,3例存在耳聋基因检测异常,均为GJB2 c.235delC基因突变(2例GJB2 c.235delC纯合突变,1例GJB2 c.235delC/299del AT复合杂合突变);统计结果见表1。
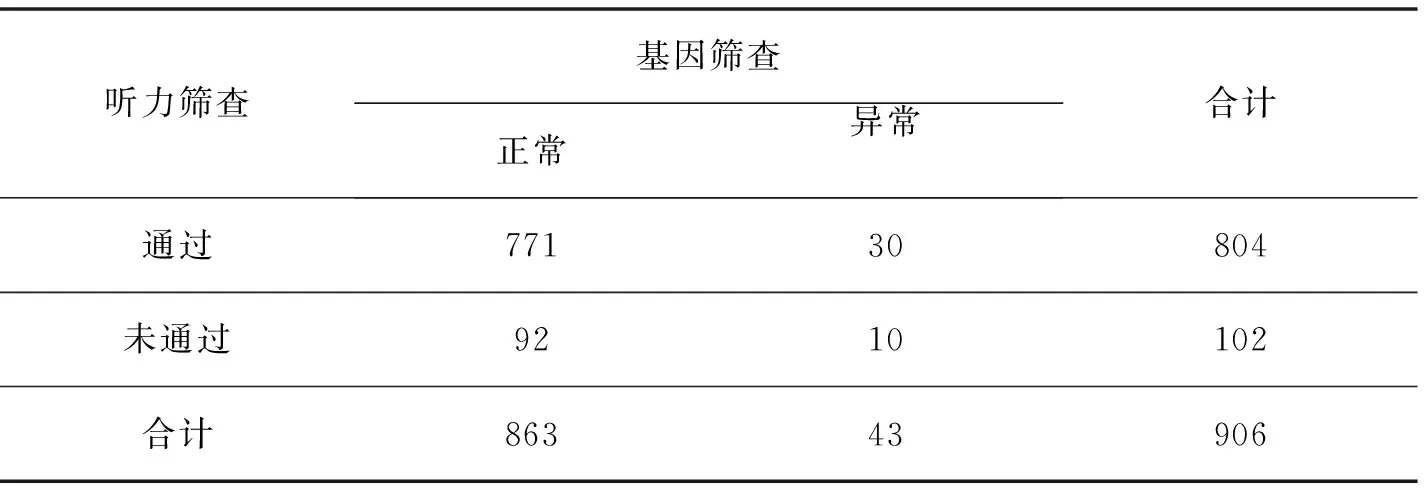
表1 耳聋基因筛查与听力筛查结果
讨 论
本研究906例新生儿中,43例携带耳聋基因突变,阳性率为4.75%(43/906)。在43例携带耳聋基因突变中病例中,31例为GJB2基因突变,突变率为3.42%,所占比例最大,与其它研究调查发病率相近[6]。GJB2纯合突变和复合杂合突变表现为先天性耳聋,一般听力检测不能通过,我们此次研究也证实这点,3例GJB2 c.235delC基因突变(2例GJB2 c.235delC纯合,1例GJB2 c.235delC/ 299del AT复合杂合)他们的听力筛查均不通过。但单纯的听力检测并不能明确病因,耳聋基因的检测可帮助患儿及早的明确病因,可根据不同的病因做相应的治疗及干预,如235delC基因纯合/复合杂合突变主要导致Corti器的钾中毒,其病变部位在耳蜗,及早诊断,可使患者及早治疗安装人工耳蜗或助听器,避免患儿错过语言发育的最佳时期甚至由聋致哑,从而改善他们的生活质量,同时也减少家庭和社会的负担。
另在我们的调查中,有7例为SLC26A4 基因杂合突变,6例双耳初筛检测均通过,1例表现为单耳不通过;经测序检测证实均为单杂合突变,但因为不排除可能携带一些罕见位点或未知位点突变,且SLC26A4基因突变导致的大前庭水管综合征,此类患者出生时可能听力正常,或伴有轻度至中重度的听力损失,新生儿临床表现不明显。所以建议随诊,可结合CT检测尽量减少漏诊。此外,此类单杂合突变者以后如与同型基因的携带者婚配,则其后代听力损失几率为1/4,因此,新生儿的耳聋基因筛查有助于获取耳聋遗传信息,对婚育指导以及提高下一代质量有重要意义。
线粒体基因突变的携带者,对氨基糖甙类抗生素敏感,一旦使用氨基糖甙类抗生素可能导致或者加重耳聋,这类患者在出生时可表现为听力正常。在本研究中,2例12SrRNA m.1555A>G 突变患者耳声发射检测均通过,如果按一般听力筛查,即会造成漏诊。孩子有可能因为应用氨基糖甙类药物而导致耳聋。此外,我们通过基因检测能够检出携带这种突变基因患者和家族成员,从而避免接触氨基糖甙类药物,尽可能避免耳聋的发生。
此外,我们还查出3例GJB3 c.538C>T 基因突变患者,GJB3基因突变患者,大多表现为高频听力的散失[7],出生时亦可表现为听力正常,本文中3例GJB3 c.538C>T 基因突变患者均通过听力初筛。这部分患者需要在听力中心严密监测,以防止听力的减退。
新生儿基因筛查与听力筛查结果联合分析,可将二者的优势结合起来,能更好地检测出先天性耳聋以及携带相关基因突变的潜在耳聋者。针对病因进行有效的治疗和干预,如GJB2先天性耳聋需及时进行佩戴助听器或植入人工耳蜗;对携带SLC26A4基因突变患儿,通过生活指导和干预措施来减缓耳聋的发展,并能对人工耳蜗植入的疗效进行预测;对GJB2、SLC26A4 基因的携带者需进行相应的遗传咨询,携带者成人后,其配偶需进行相应位点的基因测试,从而预防其生育耳聋后代。根据检测结果还能指导临床上抗生素氨基糖苷类的应用,尽可能避免药物性耳聋的发生。此外,并非所有耳聋都在初生时即外显,GJB2耳聋患者初生时存在一定的非外显率,有文献报道达到 3.8%~8.9%[8]。因此,在基因检测和听力联合筛查中,对检查结果的分析处理和对受检新生儿的随访十分重要[9],我们需要详细地同携带者父母解释和做好新生儿后续的听力检测及随访。并根据随访结果,印证听力筛查及耳聋基因诊断的结果,从而不断完善新生儿听力与基因联合筛查体系。
通过本次研究调查,证实利用耳聋基因芯片检测联合耳声发射对新生儿进行听力筛查,可提高对耳聋出生缺陷的检出率,同时对通过对基因筛查阳性的携带者或患儿采取早期预防和干预等措施,可有助于降低耳聋出生缺陷率、减少迟发型听力损失高危新生儿的发病率和降低患儿的听力损伤严重程度,提高母婴保健及优生优育水平,起到三级预防的作用。
[1]Sagong B, Baek JI, Oh SK, et al. A rapid method for simultaneous screening of multi-gene mutations associated with hearing loss in the Korean population [J]. PLoS One, 2013, 8 (3): 57237.
[2]Korver AM, Admiraal RJ, Kant SG, et al. Causes of permanent childhood hearing impairment [J]. Laryngoscope, 2011, 121 (2): 409- 416.
[3]Mahboubi H, Dwabe S, Fradkin M, et al. Genetics of hearing loss: where are we standing now? [J]. Eur Arch Otorhinolaryngol, 2012, 269 (7): 1733-1745.
[4]Joint Committee on Infant Hearing.Year 2000 position statement: principles and guidelines for early hearing detection and intervention programs [J]. Am J Audiol,2000,9(1):9-29.
[5]王秋菊,赵亚丽,兰兰,等.新生儿聋病基因筛查实施方案与策略研究[J].中华耳鼻咽喉头颈外科杂志, 2007, 42(11):809-813.
[6]纪育斌, 兰兰, 王大勇, 等. 中国非综合征型聋患者GJB2基因突变流行病学文献荟萃分析[J]. 听力学及言语疾病杂志, 2011, 19 (4): 323- 327.
[7]Xia JH, Liu CY, Tang BS, et al. Mutations in the gene encoding gap junction protein beta-3 associated with autosomal dominant hearing impairment [J]. Nat Genet, 1998, 20 (4): 370- 373.
[8]Chan DK, Chang KW. GJB2-associated hearing loss:Systematic review of world wide prevalence, genotype, and auditory phenotype [J]. Laryngoscope,2014, 124(2):E34-E53.
[9]陆洋, 孙晓勉. 新生儿听力及耳聋基因联合筛查研究进展[J]. 中国妇幼健康研究, 2015, 26 (5): 1088-1091.

