基于COSMO-RS模型研究基团修饰[EMIM][OAC]的离子液体对乙腈-水汽液平衡的影响
李婷婷,杨青,彭昌军,刘洪来(华东理工大学化学系,化学工程联合国家重点实验室,上海 200237)
研究论文
基于COSMO-RS模型研究基团修饰[EMIM][OAC]的离子液体对乙腈-水汽液平衡的影响
李婷婷,杨青,彭昌军,刘洪来
(华东理工大学化学系,化学工程联合国家重点实验室,上海 200237)
摘要:以1-乙基-3-甲基咪唑醋酸盐([EMIM][OAC])为基准,通过分别在阴阳离子上修饰胺基(—NH2)、羟基 (—OH)、腈基(—CN)、卤素(Br、F)等,虚拟设计了15种阳离子和21种阴离子组成的离子液体(IL)。采用基于COSMO-RS模型的COSMOthermX软件计算了所设计的离子液体对乙腈-水混合物恒压汽液相平衡的影响,探索了修饰基团的种类、离子液体结构对乙腈相对挥发度的影响规律。研究发现,在阳离子碳链上修饰—NH2,阴离子(醋酸根和丙酸根)羰基的邻碳上进行单一的—OH修饰能促进乙腈与水的分离,且阳离子修饰的—NH2数越多,促进分离的效果越明显,其他嫁接方式未取得好的分离效果。虚拟设计的两种阳离子(1-胺乙基-3-甲基咪唑、2,2,2-三胺乙基-3-甲基咪唑)与3种阴离子(羟基乙酸、2-羟基丙酸、2-羟基-3-胺基丙酸)组合的离子液体分离效果明显比[EMIM][OAC]好。
关键词:离子液体;COSMO-RS;乙腈;水;汽液相平衡
2015-10-12收到初稿,2015-12-12收到修改稿。
联系人:彭昌军。第一作者:李婷婷(1989—),女,硕士研究生。
Received date: 2015-10-12.
引 言
乙腈是重要的化工原料和有机溶剂,在生产、使用和回收过程中,常涉及乙腈与水的分离问题。乙腈(1)-水(2)体系是典型的共沸体系[1],普通精馏难以达到完全分离的目的。变压精馏[2]和加盐萃取精馏[3-4]等具有设备成本高、添加的无机盐易结晶、腐蚀设备的缺点。常规的分离剂醋酸丁酯[5-6]、乙二醇[7-8]等由于分离剂添加量大导致后续分离能耗高。虽然二甲基亚砜(DMSO)可以作为乙腈-水分离的有效添加剂,但它由于可以渗入皮肤、气味难闻等问题而受到限制[9]。因此,寻找一种应用效果好且环境友好的分离剂是优化萃取分离技术的关键。
近些年来,离子液体作为萃取精馏的分离剂备受关注[10-12]。Kurzin等[13-14]测定了乙腈-水-离子液体三元体系的恒温汽液平衡数据。他们发现,添加[N4444][Br]能有效提高乙腈在其高浓度区的相对挥发度,并能消除共沸点,但添加[N3333][Br]时并不能消除共沸点,仅能改变共沸点的位置。尹伟超等[15]、李春利等[16]、Fang等[17]测定了乙腈-水-离子液体恒压汽液平衡数据,实验发现1-乙基-3-甲基咪唑四氟硼酸盐([EMIM][BF4])、1-乙基-3-甲基咪唑硝酸盐([EMIM][NO3])、1-丁基-3-甲基咪唑氯盐([BMIM][Cl])、1-丁基-3-甲基咪唑二丁酯磷酸盐([BMIM][DBP])均能消除乙腈-水的共沸,且乙腈的相对挥发度会随离子液体含量的增加而提高,分离效果为[EMIM][NO3]>[EMIM][BF4],[BMIM][Cl]>[BMIM][DBP]。Yang 等[18]研究了乙腈分别与[BMIM][BF4]、[BMIM][Cl]和1-己基-3-甲基咪唑氯盐([HMIM][Cl])组成的二元系统的恒温汽液相平衡数据,发现能有效促进乙腈与水分离的离子液体顺序是[BMIM][Cl]> [HMIM][Cl]> [BMIM][BF4]。除实验研究外,一种COSMO-RS (conductor-like screening model for real solvents) 模型[19-22]也被应用于离子液体的筛选中。Li等[23]使用COSMOthermX软件预测了由已知的13种阴离子与14种阳离子组合形成的离子液体对乙腈-水共沸体系汽液相平衡的影响。预测结果显示,在已知的阴离子中含醋酸根[OAC]的离子液体具有最好的分离效果,阳离子上碳链越短,则越能促进乙腈与水的分离,即1-乙基-3-甲基咪唑醋酸盐[EMIM][OAC]具有最好的分离效果,这一结果已得到实验证实[24]。
离子液体的最大优势在于结构可设计,如在阴阳离子上可嫁接不同的官能团。本文将以实验和理论预测中被证实的对乙腈-水混合物具有最佳分离效果的[EMIM][OAC]离子液体为基础,通过在阳离子和阴离子上修饰胺基、羟基、腈基、卤素元素等方式虚拟设计若干新的离子液体,再利用基于COSMO-RS理论开发的COSMOthermX软件,系统考察虚拟设计的离子液体对乙腈-水共沸体系分离效果的影响,为用于乙腈-水分离的离子液体的设计与筛选提供参考。
1 分子设计和模拟计算
1.1分子设计
以[EMIM][OAC]离子液体为本体,分别对1-乙基-3-甲基咪唑阳离子([EMIM])和醋酸根阴离子([OAC])进行官能团修饰,修饰的基团分别是:胺基(—NH2)、羟基(—OH)、腈基(—CN)、卤素(R=Br,F)。设计的15种阳离子和21种阴离子的系列号、分子式、名称与结构分别见表1和表2(其中离子的名称分别省略了“阳离子”和“阴离子”)。
1.2计算细节
利用COSMOthermX软件预测热力学性质的第1步是进行量子化学计算,可在Gaussian 03[25]软件包中进行。本文使用B3LYP 6-311G基组优化物质的结构,并得到相关物质表面电荷密度分布(即σ-profile)。然后利用COSMOthermX软件的BP-TZVP-C21-0110版本预测热力学性质,主要是获得混合物中不同组分的活度系数和汽液相组成。
对于乙腈(1)-水(2)-离子液体(3)三元系统,假定汽相压力不太高,汽液两相平衡时,有
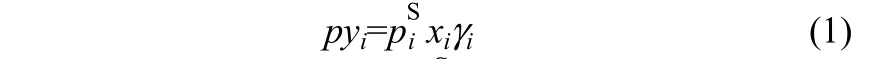
式中,p为系统总压;piS为组分i的饱和蒸气压,可通过安托因方程计算;xi和yi分别为组分i在液相和汽相中的摩尔分数;γi为组分i在液相中的活度系数,它可通过COSMOthermX软件预测得到。如果离子液体结构已知,只要液相组成、系统总压一定,则可利用COSMOthermX软件获得平衡时汽相的组成和系统温度。预测时将离子液体看作是等摩尔比的阴阳离子对所组成。本文以乙腈的相对挥发度α12作为分离效果的判断指标。如在乙腈(1)-水(2)全浓度范围内的α12大于1,即可认为添加的离子液体可消除共沸现象,α12越大预示离子液体对于乙腈-水混合物的分离效果越好。相对挥发度α12定义为

式中,x1'、x2' 分别为液相中无离子液体基并归一化后乙腈和水的组成;y1、y2分别为乙腈和水在汽相中的组成。

表2 阴离子结构Table 2 Constructions of anions

Table 2 (continued)
2 结果与讨论
常压下,乙腈-水的共沸点出现在摩尔分数x1=0.713处。为探索不同虚拟设计的离子液体对混合物相平衡的影响,预测中离子液体添加量统一规定为摩尔分数x3=0.20, 系统总压p控制为101.325 kPa。
2.1阳离子修饰的离子液体
下面考察以[OAC]阴离子与不同基团修饰的[EMIM]阳离子构成离子液体对乙腈(1)-水(2)分离效果的影响。为比较,选择的基础离子液体为[EMIM][OAC]。
2.1.1引入羟基(—OH)和腈基(—CN)的影响羟基和腈基修饰的阳离子结构见表1 C01~C04系列,它们与[OAC]构成离子液体对乙腈相对挥发度的影响见图1。预测发现,在阳离子碳链上嫁接—OH的C01的分离效果与[EMIM][OAC]基本相似。在咪唑环上修饰—OH的C02在乙腈的低浓度范围内的分离效果稍优于[EMIM][OAC]的效果,但在高浓度区的效果则相反。在碳链上修饰—CN的C03和在咪唑环上修饰—CN的C04,在全浓度范围内,均会导致小于添加[EMIM][OAC]的效果。总体而言,虽然羟基和腈基修饰的各种阳离子所组成的离子液体均能消除共沸点,但相差不大,它们的分离效果并未超过 [EMIM][OAC]的分离效果。
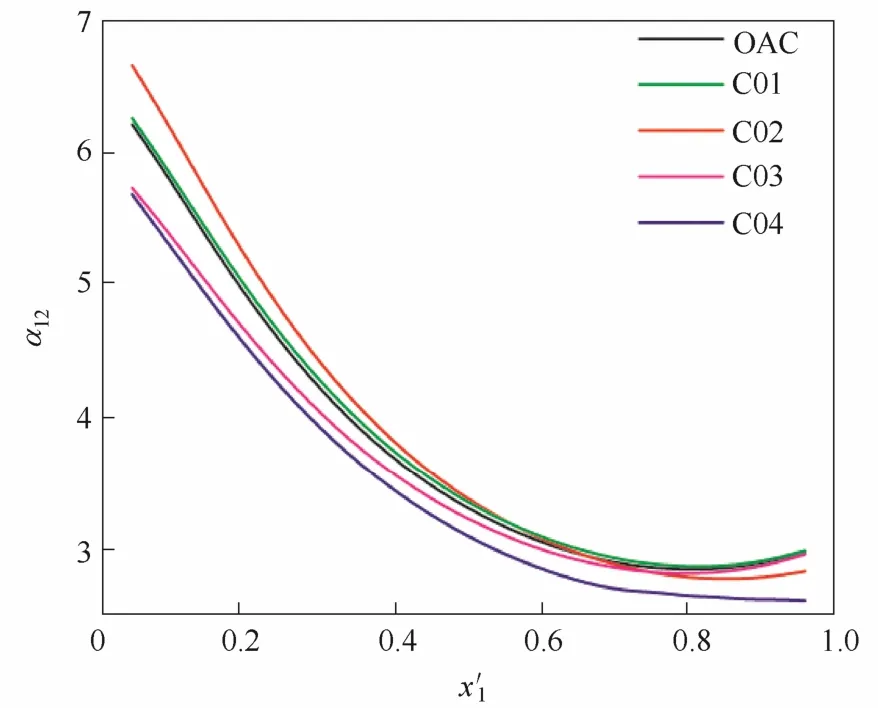
图1 阳离子引入羟基和腈基的离子液体对乙腈相对挥发度的影响Fig. 1 Influence of ILs introduced —OH and —CN with cation on relative volatility of acetonitrile
2.1.3引入卤素的影响咪唑阳离子上可单独嫁接Br或者F元素,也可进行混合嫁接卤素。嫁接的卤原子可以是一个,也可是两个或以上。表1中的C09~C15与[OAC] 构成的离子液体对乙腈相对挥发度的影响见图3。由图3可知,尽管阳离子修饰卤素后可消除乙腈-水混合物的共沸点,但整体的分离效果均要低于[EMIM][OAC]的效果,说明在阳离子上修饰卤素并不是适宜的选择。
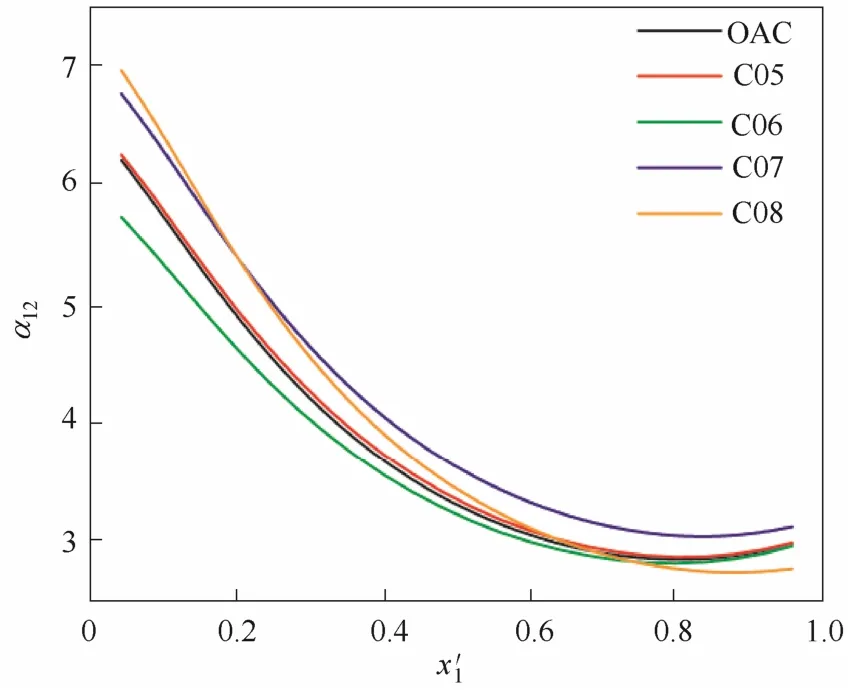
图2 阳离子引入胺基的离子液体对乙腈相对挥发度的影响Fig.2 Influence of IL introduced —NH2with cation on relative volatility of acetonitrile
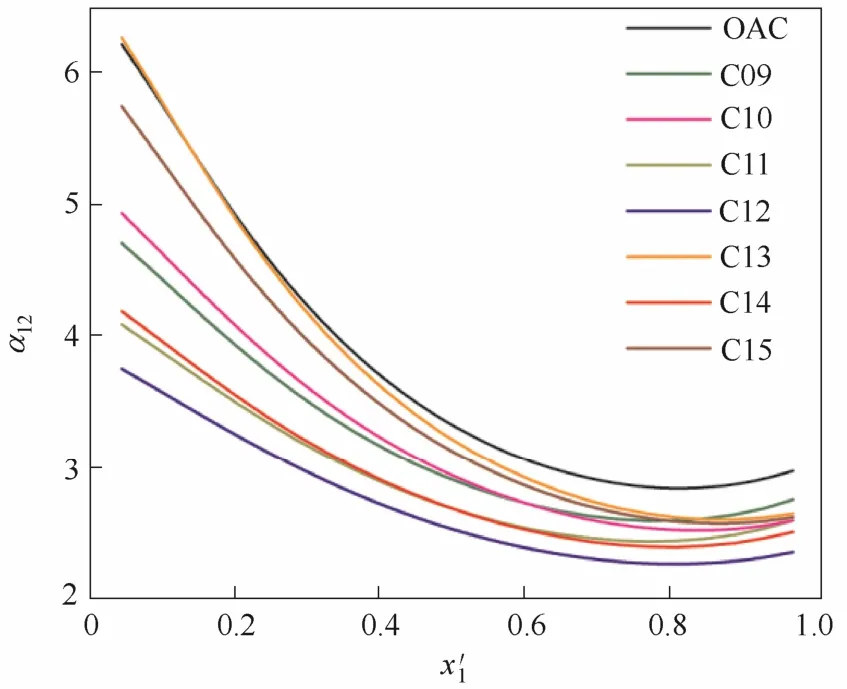
图3 阳离子引入卤素的离子液体对乙腈相对挥发度的影响Fig. 3 Influence of ILs introduced halogen with cation on relative volatility of acetonitrile
2.2阴离子功能化的离子液体
研究发现,阴离子种类对乙腈-水分离的影响程度要比阳离子种类的影响程度大得多[24]。本文以[EMIM]为阳离子,通过对[OAC]阴离子的不同基团修饰来比较其对分离效果的影响。这种修饰可以有多种方式:一是利用不同基团取代醋酸根中—CH3上的H原子;二是首先将醋酸根中碳链变为—CH2—CH3,此时阴离子实质上是丙酸根离子,然后对丙酸根中的H原子实施不同基团取代。
2.2.1引入胺基(—NH2)的影响修饰—NH2的阴离子的结构见表2中的A01~A04,相应构成的离子液体对乙腈相对挥发度的影响见图4。由于在乙腈的全浓度范围内均大于1,说明—NH2修饰的阴离子所构成的离子液体均能消除共沸点。但与阳离子上修饰—NH2不同,在阴离子上修饰—NH2所获得的分离效果并不能超越[EMIM][OAC]的效果。而且—NH2修饰的个数越多,其与[EMIM][OAC]的效果差别越大,对促进乙腈的分离越不利。
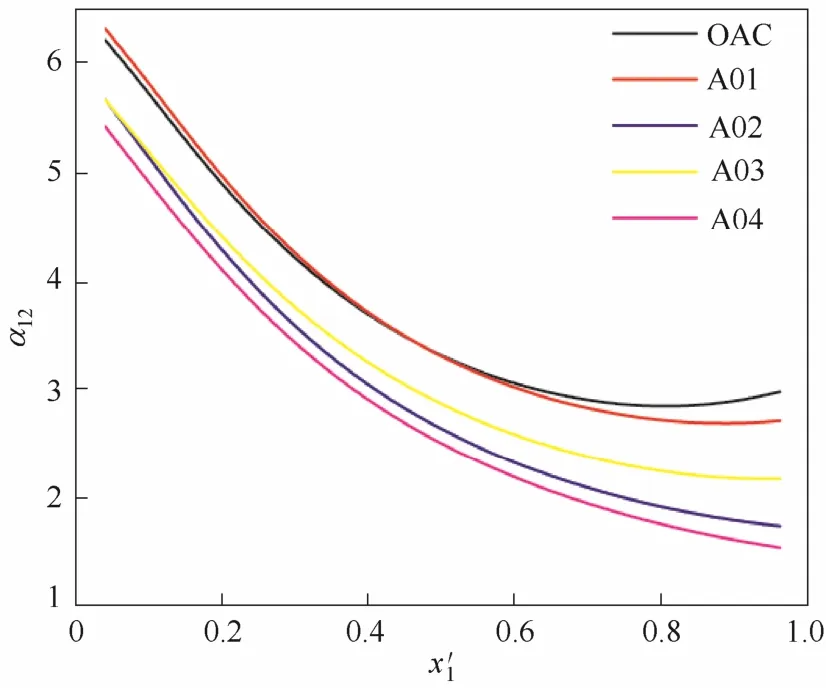
图4 阴离子引入胺基的离子液体对乙腈相对挥发度的影响Fig. 4 Influence of ILs introduced –NH2with anion on relative volatility of acetonitrile
2.2.2引入卤素的影响醋酸根离子上修饰卤素(Br、Cl或者F)的结构见表2中的A05~A09。它们与阳离子[EMIM]构成的离子液体对乙腈相对挥发度的影响见图5。由图可以发现,无论何种卤素的修饰,均会导致分离效果低于[EMIM][OAC]的效果。醋酸根上修饰卤素的个数越多,乙腈相对挥发度越低,甚至导致小于1而不能消除共沸现象。可见,无论是阴离子,还是阳离子,嫁接卤素都不会取得好的效果。
2.2.3引入羟基(—OH)的影响不同羟基—OH修饰的阴离子结构见表2中的A10~A14,它们与[EMIM]阳离子构成离子液体后对乙腈相对挥发度的影响见图6。很明显,羟基乙酸根A10和 2-羟基丙酸根A11与[EMIM]阳离子构成离子液体具有比[EMIM][OAC]更优越的促进分离作用。预测发现,修饰两个羟基(如A12、A13)的分离效果均要低于[EMIM][OAC]的效果。因此,在阴离子(醋酸根和丙酸根)上进行单一的羟基修饰更能促进乙腈与水的分离。但羟基的位置会对分离效果有不同影响,只有在羰基的邻碳上修饰羟基才能提高离子液体对乙腈与水的分离效果。

图6 阴离子引入羟基的离子液体对乙腈相对挥发度的影响Fig. 6 Influence of ILs introduced —OH with anion on relative volatility of acetonitrile
2.2.4混合修饰在醋酸根或丙酸根上同时修饰两种基团的结构见表2中的A15~A21,相应对乙腈挥发度的影响见图7。此时,离子液体对相平衡的影响除了与基团种类有关外,还与基团嫁接的位置有关。一般地,羟基的位置离羰基的位置越近,胺基、卤素等不利于分离的基团离羰基位置越远,则所构成的离子液体所导致的乙腈相对挥发度越高。然而,除了 [EMIM][A15]对乙腈-水分离的效果高于[EMIM][OAC]的效果外,其他混合基团修饰的离子液体均要低于[EMIM][OAC]的分离效果,甚至A19和A20所组成的离子液体都不能消除共沸现象。
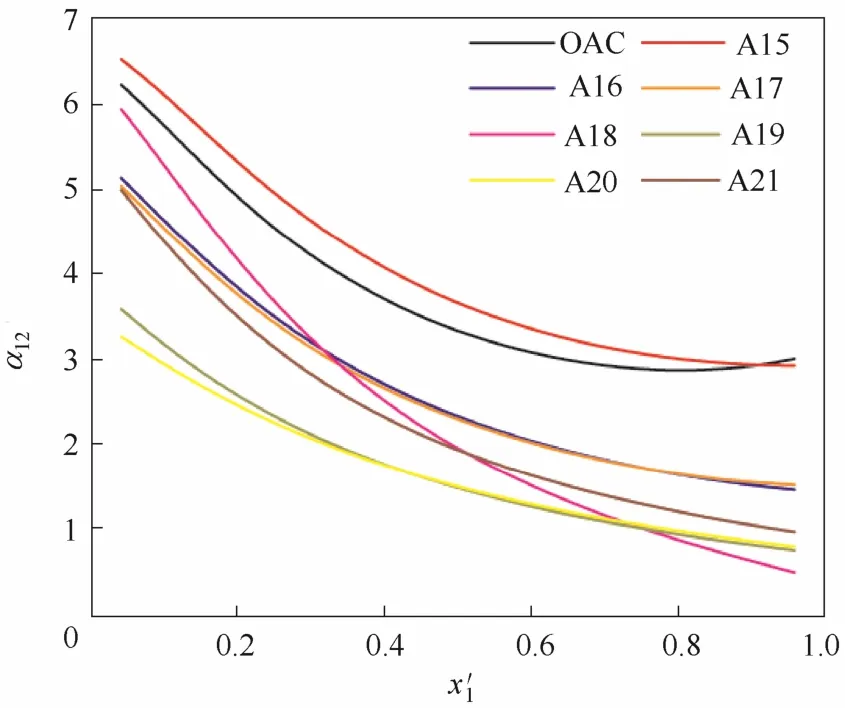
图7 阴离子引入混合基团的离子液体对乙腈相对挥发度的影响Fig. 7 Influence of ILs introduced mixed groups with anion on relative volatility of acetonitrile
2.3功能化阴阳离子的组合效果
联系人:臧建成医生:13261797099(微信同号) 办公室王一岚:010-58122956,13167579442
上述计算说明,阳离子[EMIM]上实施—NH2修饰的C05、C07与阴离子[OAC]组合的离子液体,它们所取得的分离效果将超越[EMIM][OAC]的效果。如果阳离子固定为[EMIM],阴离子改变为A10、A11或A15时,它们的效果也将超越[EMIM][OAC]的效果。如将优选的阳离子和阴离子实施组合,理论上可得到6种新的离子液体,它们对乙腈相对挥发度的影响见图8。可见,在乙腈的全浓度范围内,不同组合的离子液体所导致乙腈的相对挥发度几乎全部大于3,且分离效果均要比[EMIM][OAC]效果好。在全浓度范围,C07与A10的组合将更能促进乙腈与水的分离,C05与A15的组合效果稍差。这表明:胺基修饰的阳离子可促进乙腈-水的分离,且修饰的胺基个数增多越利于分离;阴离子羰基临近位置修饰单一羟基可以促进乙腈-水的分离;在阴离子修饰羟基的基础上修饰胺基,并未体现出不同基团的协同作用,虽然效果优于[EMIM][OAC],但并不利于分离效果的进一步提升。
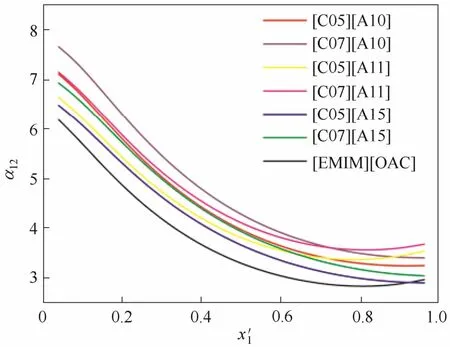
图8 功能化离子液体对乙腈相对挥发度的影响Fig. 8 Influence of functionalized ILs on relative volatility of acetonitrile
2.4表面电荷密度与相互作用能分析
表面电荷密度分布(σ-profile)体现了分子表面的极化作用,决定着分子作用能的大小。为了进一步说明修饰的离子液体对分离效果影响的本质原因,本文选择了代表性的几种离子、乙腈和水进行了表面电荷密度分析,结果见图9。图9中虚线(σ = −0.0082 e·Å−2, σ =0.0082 e·Å−2, 1 Å=0.1 nm)为氢键分隔线,落在σ<−0.0082 e·Å−2区域的σ-profile曲线表示该物质具有较强的氢键提供能力,落在σ>0.0082 e·Å−2的曲线表示该物质具有较强的氢键接受能力。峰位置离氢键分隔线距离越远,阈值越宽,表示形成氢键的能力越强。图9(a)中C05+及C07+分别对应C05和C07在C3短碳链上进行胺基修饰的阳离子。由图可知,C05+与C05、C07+与C07的电荷密度分布所对应的阈值及峰位置基本相近。由于相比阴离子,阳离子对于乙腈-水混合物分离影响很小,因此长短碳链选择性修饰胺基对于乙腈-水混合物的分离效果相近,本文不做具体区别考虑。阳离子在[−0.015,0] e·Å−2处有很大的峰,且阳离子此处的峰覆盖了乙腈在此区域的峰,所以会表现出较大的排斥作用,有利于阳离子与水的结合。胺基修饰的阳离子C05+与C05、C07+与C07峰相比于[EMIM]都有不同程度的向左延伸,即氢键提供能力有一定的提升,与水的相互作用将增强,利于乙腈-水的分离,并且C07峰位置离氢键分隔线更远且阈值更宽,体现出更好的修饰效果。
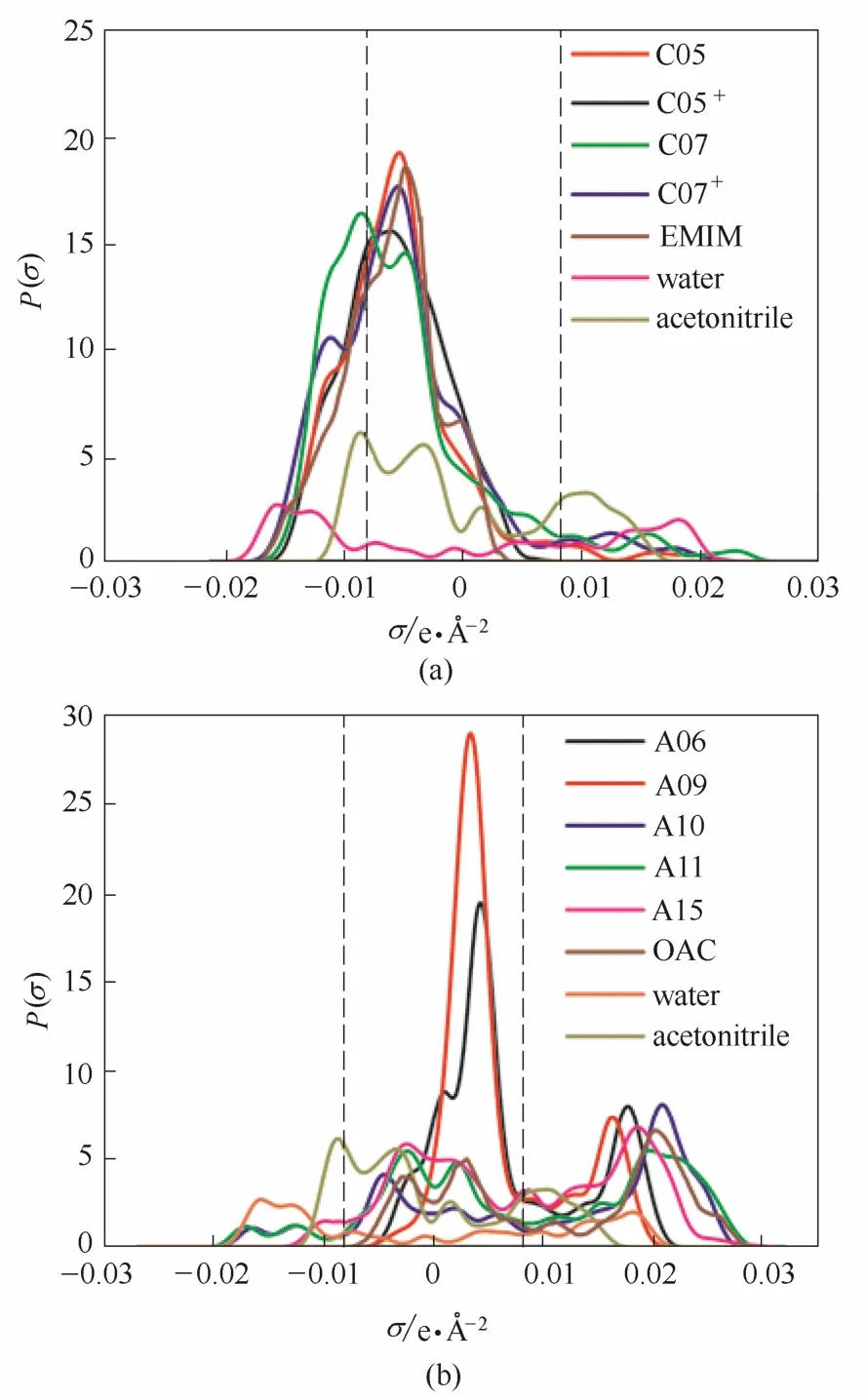
图9 阴阳离子的σ-profileFig. 9 σ-Profile of cations and anions
从图9(b)可知,对于阴离子,表面电荷密度在中性区域有较大面积,并且在0.015~0.25 e·Å−2的范围有强峰出现,表现出较强的氢键接收能力。乙腈和水的表面电荷密度在σ<−0.0082 e·Å−2区域均有出现,即有较强的氢键提供能力。但在σ<−0.0082 e·Å−2区域,乙腈和水的表面电荷密度分布有所差别,乙腈表面电荷密度只能低至−0.015 e·Å−2,但水的分布可低至−0.020 e·Å−2,特别是在−0.015~−0.02 e·Å−2范围内电荷密度分布出现峰值。这说明,阴离子与水的相互作用更强,将有利于乙腈与水的分离。从不同阴离子在0.015~0.25 e·Å−2区域出现峰的位置来看,与阴离子三氯乙酸(A06)、2-三氟甲基-四氟丙酸(A09)不同,阴离子羟基乙酸(A10)、2-羟基丙酸(A11)、2-羟基-3-胺基丙酸(A15) 出现峰的位置离氢键分隔线(0.0082 e·Å−2)的位置较远,即氢键接收能力更强,即A10、A11、A15与水的相互作用更大,预示它们可更好地促进乙腈与水的分离。阴离子A10在高电荷密度分布的区域明显增多,其后依次是A11、A15,这与图8所示的相对挥发度规律一致。然而A06和A09具有高电荷密度分布的区域明显减少,这与图5所示的分离效果是对应的。可见,阴离子的单一羟基功能化对乙腈-水的分离具有促进作用。
乙腈-水-离子液体三元系统中存在范德华、静电和氢键相互作用。相互作用能可定义为分子结合体的总能量与各孤立子体系能量和的差值。乙腈/水分子与离子液体之间的相互作用能指乙腈/水分子与离子液体形成的超分子体系的总能量减去乙腈/水分子和离子液体能量的差值。相互作用能及各个孤立体系能量通过Gaussian 03以DFT理论,B3LYP 6-311G基组计算得到。具体计算公式如下

式中,IE为相互作用能,kJ·mol−1;E为孤立体系的能量,kJ·mol−1。
为了从相互作用能方面考察离子液体对相平衡的影响,本文选取了基准阳离子[EMIM]和效果最好的阳离子C07,基准阴离子[OAC] 和效果最好的阴离子A10,分别计算了它们组合的离子液体与乙腈及与水的相互作用能,结果见表3,其中,乙腈与水的相互作用能为−23.27 kJ·mol−1。可见,离子液体与水的相互作用能均大于离子液体与乙腈的相互作用能,也大于乙腈与水的相互作用能。因此,离子液体的加入将改变系统中不同组分间的相互作用,但离子液体更容易与水结合,导致混合物中乙腈更易逸出。计算发现,[EMIM][A10]与水的相互作用能(−70.11 kJ·mol−1)高于[EMIM][OAC]与水的相互作用能(−69.17 kJ·mol−1),但两种离子液体与乙腈的相互作用基本相近,说明[EMIM][A10]更易导致乙腈与水的分离,这正是图6的结果。如果离子液体/水间的相互作用能与离子液体/乙腈间的相互作用能差值越高,基本可判定离子液体越有利于乙腈与水的分离。如[C07][OAC]与水和乙腈间作用能的差值为35.72 kJ·mol−1,它比[EMIM][OAC]与水和乙腈间作用能的差值(35.09 kJ·mol−1)要高,即[C07][OAC]的分离效果要优于[EMIM][OAC]的效果,图2所示正是这一结果。显然,[C07][A10]与水和乙腈间作用能的差值最高(37.01 kJ·mol−1),它的分离效果在所设计的离子液体中将是最好的,这正是图9所示的结果。
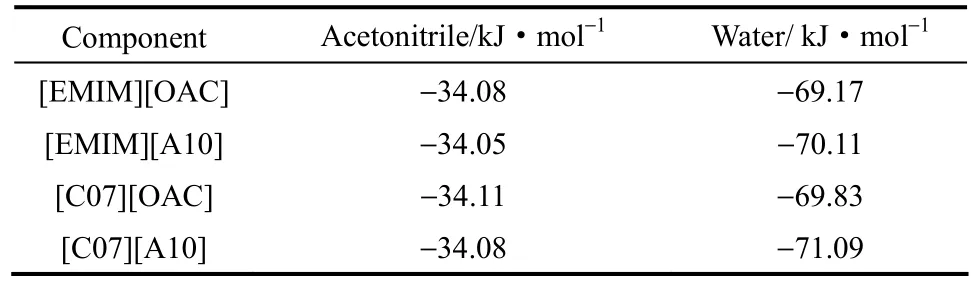
表3 离子液体与乙腈及离子液体与水之间的相互作用能Table 3 Interaction energies of acetonitrile-IL and water-IL
3 结 论
对[EMIM][OAC]离子液体中阴阳离子分别进行了胺基(—NH2)、羟基(—OH)、腈基(—CN)、卤素(Br、F)等不同基团的嫁接,虚拟设计了15种阳离子和21种阴离子组合的离子液体,在此基础上,利用COSMOthermX软件计算了所设计的离子液体对乙腈-水混合物分离效果的影响。一般地,在阳离子上嫁接—OH和—CN所组成的离子液体的分离效果并未超越 [EMIM][OAC]的效果。在阳离子碳链上修饰—NH2的分离效果要优于在咪唑环上修饰—NH2的效果,且修饰的—NH2个数越多,促进分离的效果越明显。在阴离子上单独修饰—NH2所获得的分离效果并不能超越[EMIM][OAC]的效果,但在阴离子(醋酸根和丙酸根)羰基的邻碳上进行单一的—OH修饰更能促进乙腈与水的分离。无论是阴离子还是阳离子,嫁接卤素都不会取得好的分离效果。在所设计的离子中,1-胺乙基-3-甲基咪唑(C05)和2,2,2-三胺乙基-3-甲基咪唑(C07)与[OAC]组合的离子液体,以及羟基乙酸(A10)、2-羟基丙酸(A11)和2-羟基-3-胺基丙酸(A15)与 [EMIM]组合的离子液体的分离效果均优于[EMIM][OAC]的效果。设计的2种阳离子和3种阴离子理论上可组合成6种新的离子液体,分离效果都要比[EMIM][OAC]效果好,其中,C07与A10组合的离子液体将更能促进乙腈与水的分离。应该指出,本文仅从离子液体是否能消除共沸点和提升乙腈相对挥发度的角度来判断离子液体的优劣,判断基准是[EMIM][OAC]的效果,所取得的结果对离子液体的筛选和设计具有借鉴作用。要想虚拟设计的离子液体得到实际应用,还必须综合考虑离子液体的合成难度和制备成本,并通过汽液相平衡实验获得验证。
符号说明
P(σ)——表面电荷密度分布
p——蒸气压, kPa
piS——纯组分i的饱和蒸气压, kPa
xi——液相中组分i的摩尔分数
xi′——无离子液体基归一条件下液相中组分i的摩
尔分数
yi——汽相中组分i的摩尔分数
αij——组分i,j的相对挥发度
γi——纯组分i的活度系数
σ ——表面电荷密度, e·Å−2
References
[1] 穆光照. 实用溶剂手册[M]. 上海: 上海科技出版社, 1990: 346. MU G Z. Practical Manual of Solvent[M]. Shanghai: Shanghai Science & Technology Press, 1990: 346.
[2] 李忠杰. 高纯乙腈精制工艺技术开发与应用 [J]. 石油化工, 2001, 30: 785-788. LI Z J. Development and application of high-purity acetonitrile purification and refining processes [J]. Petrochemical Technology , 2001, 30: 785-788.
[3] KAI Z, JON W, PAUL Y, et al. Multiresidue pesticide analysis of agricultural commodities using acetonitrile salt-out extraction, dispersive solid-phase sample clean-up, and high-performance liquid chromatography-tandem mass spectrometry [J]. J. Agric. Food Chem., 2011, 59(14): 7636-7646. DOI:10.1021/jf2010723.
[4] 崔现宝, 李杨, 冯天扬, 等. 加盐萃取精馏分离乙腈-水物系 [J].石油化工, 2007, 36(12): 1229-1233. CUI X B, LI Y, FENG T Y, et al. Separation of acetonitrile - water by saline extractive distillation [J]. Petrochemical Technology, 2007, 36(12): 1229-1233.
[5] ACOSTA J, ARCE A, RODIL E, et al. A thermodynamic study onbinary and ternary mixtures of acetonitrile, water and butyl acetate [J]. Fluid Phase Equilibria, 2002, 203: 83-98. DOI: PII S0378-3812(02) 00171-1.
[6] 张锁江, 刘晓敏, 姚晓倩, 等. 离子液体的前沿、进展及应用[J].中国科学(B辑:化学), 2009, 39(10): 1134 -1144. ZHANG S J, LIU X M, YAO X Q, et al. Forefront, development and application of ionic liquid [J]. Science in China, Series B: Chemistry, 2009, 39(10): 1134-1144.
[7] 叶庆国, 韩平. 加盐萃取精馏技术进展[J]. 化学工业与工程, 2009, 30(2): 44-47. YE Q G, HAN P. Technology progress of saline extractive distillation [J]. Journal of Chemical Industry and Engineering, 2009, 30(2): 44-47.
[8] 周金波,崔现宝, 董炳利, 等. 间歇萃取精馏分离乙腈-水体系[J].化学工业与工程, 2009, 26(6): 482-486. ZHOU J B, CUI X B, DONG B L, et al. Separation of acetonitrile-water mixture by batch extractive distillation [J]. Journal of Chemical Industry and Engineering, 2009, 26(6): 482-486.
[9] ZHANG Z G, LV M, HUANG D H, et al. Isobaric vapor-liquid equilibrium for the extractive distillation of acetonitrile+water mixtures using dimethyl sulfoxide at 101.3 kPa [J]. J . Chem. Eng. Data, 2013, 58: 3364-3369. DOI: 10.1021 /je400531a.
[10] 李文秀, 张琦, 张亲亲, 等. 含离子液体乙腈-正丙醇体系的等压汽液平衡[J].化工学报, 2015, 66(S1): 38-45. DOI:10.11949/j.issn. 0438-1157.20141907. LI W X, ZHANG Q, ZHANG Q Q, et al. Isobaric vapor-liquid equilibrium for system of acetonitrile-n-propanol system containing ionic liquids [J]. CIESC Journal, 2015, 66(S1): 38-45. DOI: 10.11949/ j.issn.0438 - 1157.20141907.
[11] DUPONT J, DE-SOUZA R F, SUAREZ P A Z. Ionic liquid (molten salt) phase organometallic catalysis [J]. Chemical Reviews, 2002, 102(10): 3667 -3692. DOI: 10.1021/cr010338r.
[12] JORK C, SEILER M, BESTE Y A, et al. Influence of ionic liquids on the phase behavior of aqueous azeotropic systems [J]. J. Chem. Eng. Data, 2004, 49: 852-857. DOI: 10.1021/je034183r.
[13] KURZIN A V, EVDOKIMOV A N, POLTORATSKIY G M, et al. Isothermal vapor-liquid equilibrium data for the systems 1,4-dioxane + water + tetrabutylammonium nitrate and acetonitrile + water + tetrabutylammonium bromide [J]. J. Chem. Eng. Data, 2004, 49: 208-211. DOI: 10.1021/je0301287.
[14] KURZIN A V, EVDOKIMOV A N, ANTIPINA V B, et al. Measurement and correlation of isothermal vapor-liquid equilibrium data for the system acetonitrile + water + tetrapropylammonium bromide [J]. J. Chem. Eng. Data, 2006, 51: 1361-1363. DOI: 10.1021/je0600855.
[15] 尹伟超, 崔现宝, 吴添, 等. 离子液体对乙腈-水体系汽液平衡的影响[J]. 化工进展, 2009, 28: 190-193. YIN W C, CUI X B,WU T, et al. Effect of ionic liquid on the vapor-liquid equilibrium of acetonitrile-water [J]. Chemical Industry and Engineering Process, 2009, 28: 190-193.
[16] 李春利, 李聚魁, 刘艳稳, 等. 离子液体对乙腈-水共沸物系汽液平衡的影响[J].化工进展, 2011, 30(12): 2611-2614. LI C L, LI J K, LIU Y W, et al. Effect of ionic liquid on the vapor-liquid equilibrium of acetonitrile-water [J]. Chemical Industry and Engineering Process, 2011, 30(12): 2611-2614.
[17] FANG J, LIU J, LI C L, et al. Isobaric vapor-liquid equilibrium for the acetonitrile + water system containing different ionic liquids at atmospheric pressure [J]. J. Chem. Eng. Data, 2013, 58: 1483-1489. DOI: 10.1021/je3009792.
[18] YANG Q, CHEN K X, HE C C, et al. Vapor pressure measurement and correlation of acetonitrile + 1 - butyl -3 - methylimidazolium chloride, + 1-butyl-3-methylimidazolium tetrafluoroborate, and + 1-hexyl-3-methylimidazolium chloride [J]. Chin. J. Chem. Eng., 2015, 23: 412-416. DOI: 10.1016/j.cjche.2014.11.008.
[19] KLAMT A. Conductor-like screening model for real solvents: a new approach to the quantitative calculation of solvation phenomena [J]. J. Phys. Chem., 1995, 99: 2224-2235.
[20] KLAMT A, JONAS V, BÜRGER T, et al. Refinement and parametrization of COSMO-RS [J]. J. Phys. Chem. A, 1998, 102(26): 5074 -5085.
[21] KLAMT A, ECKERT F. COSMO-RS: a novel and efficient method for the apriori prediction of thermophysical data of liquids [J]. Fluid Phase Equilibria, 2000, 172(1): 43-72. DOI: 10.1016/S0378-3812(00)00357-5.
[22] ECKERT F, KLAMT A. Fast solvent screening via quantum chemistry: COSMO-RS approach [J]. AIChE Journal, 2002, 48(2): 369-385. DOI: 10.1002/aic.690480220.
[23] LI J L, YANG X Q, CHEN K X, et al. Sifting ionic liquid as additives for separations of acetonitrile and water azeotropic mixture using COSMO-RS method [J]. Ind. Eng. Chem. Res., 2012, 51: 9376-9385. DOI: 10.1021/ie3000985.
[24] 杨青. 促进乙腈水溶液分离的离子液体设计与实验研究[D]. 上海:华东理工大学, 2014. YANG Q. Design and experimental study of ionic liquid used in separation of acetonitrile and water [D]. Shanghai: East China University of Science and Technology, 2014.
[25] VENKATASUBRAMANIAN V, RENGASWAMY R, KAVURI S N, et al. A review of process fault detection and diagnosis (Ⅲ): Process history based methods [J]. Comp. Chem. Eng., 2003, 27: 327-346. DOI: PII S0098-1354(02) 00162-X.
DOI:10.11949/j.issn.0438-1157.20151535
中图分类号:TQ 013.1
文献标志码:A
文章编号:0438—1157(2016)02—0425—10
基金项目:国家重点基础研究发展计划项目(2015CB251401);国家自然科学基金项目(21136004, 21276073);中央高校基本科研业务费资助项目(222201313001)。
Corresponding author:Prof. PENG Changjun, cjpeng@ecust.edu.cn supported by the National Basic Research Program of China (2015CB251401), the National Natural Science Foundation of China (21136004, 21276073) and the Fundamental Research Funds for the Central Universities of China(222201313001).
Functionalized ionic liquids based on [EMIM][OAC] for vapor-liquid phase equilibrium of acetonitrile and water by COSMO-RS method
LI Tingting, YANG Qing, PENG Changjun, LIU Honglai
(State Key Laboratory of Chemical Engineering, Department of Chemistry, East China University of Science and Technology, Shanghai 200237, China)
Abstract:Based on 1-ethyl-3-methylimidazolium acetate ([EMIM][OAC]), ionic liquids composed by 15 cations and 21 anions were designed by modifying [OAC] and [EMIM] with different groups, including amine (—NH2), hydroxy (—OH), nitrile (—CN), halogen (Br, F) and so on. The effect of the designed ionic liquids on the vapor-liquid phase equilibrium of acetonitrile and water mixtures was predicted by COSMOthermX based on COSMO-RS model. The influence of group type and IL structure on relative volatility of acetonitrile was also investigated. The results showed that the ILs carrying —NH2in cation or carrying —OH in anion can promote the separation of acetonitrile from water and the separation effect becomes more obvious with increasing number of —NH2group. The ionic liquids composed by 2 cations (1-(2-aminoethyl)-3-methylimidazolium, 2,2,2-triaminoethyl-3-methylimidazolium) and 3 anions (hydroxyacetic acid, 2-hydroxypropanoic acid, 2-hydro-3-aminopropanoic acid) had better performance in separation water from acetonitrile than[EMIM][OAC].
Key words:ionic liquid; COSMO-RS; acetonitrile; water; vapor-liquid equilibrium

