三疣梭子蟹Spook基因克隆及其表达分析
周彦琦 朱冬发
(宁波大学海洋学院,宁波 315211)
三疣梭子蟹Spook基因克隆及其表达分析
周彦琦 朱冬发
(宁波大学海洋学院,宁波 315211)
甲壳动物蜕皮激素(Ecdysteroids)主要在Y器官(YO)中合成与分泌,参与调控蜕皮、繁殖等多项生理活动。Spook基因编码的细胞色素P450(CYP)307a1是蜕皮激素合成通路早期的关键酶。为了研究其在三疣梭子蟹蜕皮过程中的调控作用,采用反转录PCR(RT-PCR)和cDNA末端快速扩增(RACE)技术,克隆得到了三疣梭子蟹Spook基因的全长cDNA序列(Gen-Bank 登录号:KM030021)。该序列全长为2 200 bp,包含一个长度为1 563 bp的开放阅读框,编码520个氨基酸;比对分析显示该氨基酸序列含helix-C、helix-K、helix-I、PERF、heme-binding 5个P450特征保守区域;系统进化树分析发现推导的三疣梭子蟹Spook蛋白与其他物种Spook聚为一支,而其他Halloween基因则分别聚为一支,表明推导的氨基酸确实是三疣梭子蟹Spook的蛋白序列。采用实时荧光定量PCR(qPCR)技术分析了其在不同组织中的表达情况,结果显示Spook基因主要在三疣梭子蟹的YO中表达。在三疣梭子蟹的蜕皮周期中,Spook基因的表达水平自蜕皮后期(A、B期)逐渐上升,并在蜕皮间期(C期)上升至最大,随后在蜕皮前期逐渐下降至D3、D4亚期最低。研究结果表明Spook基因可能参与调控三疣梭子蟹的蜕皮过程。
三疣梭子蟹;Spook;蜕皮周期;基因克隆;表达水平
蜕皮激素(Ecdysteroids)在节肢动物的生长、繁殖和形态发生方面起着重要的作用,包括个体发育、变态、蜕皮、肌肉再生和能量储备等多种生物过程[1]。在周期性蜕皮过程中蜕皮激素刺激表皮发生分离并启动一系列与蜕皮相关的重要生理过程[2]。蜕皮激素是一种类固醇激素,最早从蛾蛹中分离得到[3]。随后Huber[4]确定其化学结构并发现分泌组织为昆虫前胸腺(Prothoracic gland,PG)。
在甲壳动物中,蜕皮激素由位于其头胸部前端的Y器(Y-organ,YO)所分泌,并在外周组织中转化为其活性形式,一般为20-羟基蜕皮酮(20-Hydroxyecdysone,20E)[5]。YO中蜕皮激素的生物合成的途径包括两个阶段:第一阶段是由含有Riseke功能结构域的Neverland(Nvd)蛋白催化胆固醇向7-脱氢胆固醇(7-dehydrocholesterol,7DC)的转化[6],然后7DC被转运至线粒体中转化为5β-diketol(3D2,22,25,dE)。7DC转化为5β-diketol的机制尚不清楚,被称为“黑匣子(black box)”。目前普遍认为Spook(CYP307a1)、Spookier(CYP307a2)和Spookiest(CYP307B1)参与该阶段的调控[7]。第二阶段包括5β-diketol经过Phantom、Disembodied和Shadow分别编码的CYP306a1、CYP-302a1和CYP315a1的催化作用,其C25、C22和C5发生羟基化进而合成YO最终的分泌产物[8,9],产物种类因物种及蜕皮时期的差异而有所不同。此外,Shade编码的CYP314a1参与催化YO分泌的无活性蜕皮激素的活化过程[10,11]。上述Neverland(Nvd)、Spook(spo)、Spookier(spok)、Spookiest(spokest)、Phantom(phm)、Disembodied(Dib)、Shadow(Sad)和Shade被统称为“Halloween家族基因”。
Halloween家族基因最早发现自一系列果蝇(Drosophila melanogaster)胚胎发育突变体的性状研究[12-14]。果蝇Phm、Dib、Sad和Shd突变体表型十分相似,都在胚胎发育后期出现表皮不能分化、头部内翻、背部闭合失败和中肠缺失等异常表型。这些突变体大多在胚胎发育末期死亡,且表现出来的性状与蜕皮激素缺失有关[10,15-17],因此Halloween家族基因在果蝇蜕皮激素合成过程中有着重要意义。
目前,甲壳动物蜕皮激素的研究主要集中在其活性产物的分离鉴定及生理作用上[18-21]。对于Halloween基因及调控机制的研究则少有报道。本研究以三疣梭子蟹(Portunus trituberculatus)为研究对象,通过RT-PCR和RACE技术克隆获得了三疣梭子蟹Spook基因(PtSpook)的全长cDNA,并运用实时荧光定量PCR(qRT-PCR)分析了其组织分布情况及在蜕皮周期YO中的表达变化,旨在为进一步理解Halloween家族基因在蜕皮激素合成过程中的作用,为深入探讨三疣梭子蟹蜕皮的调控机制奠定基础。
1 材料与方法
1.1 材料
选取健康的野生三疣梭子蟹,暂养于宁波市宁海县得水育苗场。根据形态学特征变化研究,将三疣梭子蟹蜕皮周期分为蜕皮后期(A、B期)、蜕皮间期(C期)、蜕皮前期(D0、D1、D2、D3和D4亚期)和蜕皮期(E)5个阶段[22]。采集C期蟹(头胸甲宽(CW)为 15.0-16.5 cm、体质量(BW)为170-265 g)的表皮、卵巢、精巢、肝胰腺、大颚器、眼柄、胸神经节、Y器和心脏等9个组织用于分析PtSpook在三疣梭子蟹组织分布情况;采集蜕皮周期各期(E期除外)蟹(CW:8-12 cm、BW:42-83 g)的Y器用于分析Spook在蜕皮周期中的表达水平变化。每期取5只蟹用于平行实验。各组织在冰上解剖后被转移至RNA保护液(上海生工)-20℃保存备用。
1.2 方法
1.2.1 总RNA提取 将上述组织样品按照Trizol(上海生工)说明进行总RNA提取。总RNA用DNase I(TaKaRa)去除基因组DNA后,用琼脂糖凝胶电泳检测其完整性,并用超微量分光光度计Nanodrop 2000(Thermo scientific)进行纯度分析。
1.2.2 三疣梭子蟹Spook基因的克隆 采用RT-PCR进行PtSpook核心片段的扩增。模板cDNA由YO总RNA通过 PrimeScriptRTreagent Kit试剂盒(TaKaRa)反转录获得,扩增引物设计自NCBI已知物种Spook序列的保守区域(表1)。根据得到核心序列设计基因特异性引物,利用RACE技术分别对PtSpook的3'和5'端进行巢式PCR扩增(表1)。其中,3'RACE-cDNA将接头引物AP替换上述试剂盒中的OligodT primer和Random 6 mers后用相同的方法进行制备,5'RACE-cDNA按照 SMARTerTMRACE cDNA Amplification Kit试剂盒(Clontech)说明书进行合成(表1)。以上PCR均在25 μL体系下进行反应,反应条件如下:94℃预变性5 min;94℃ 50 s,57℃ 50 s,72℃ 1 min 50 s,34个循环;72℃延伸10 min。所有PCR产物经琼脂糖电泳后,用DNA回收试剂盒(上海生工)进行回收并纯化,再与pMD18-T载体连接并转化至E. coli DH5α感受态细胞进行培养,之后选取阳性克隆菌落交由上海生工生物工程有限公司进行测序。

表1 PCR引物序列
1.2.3 序列分析 利用VectorNTI 10.0对测序结果进行分析和拼接,获得三疣梭子蟹Spook的cDNA全长。ORF Finder确定开放阅读框(Open reading frame,ORF),并翻译成氨基酸序列。BLAST(http://blast. ncbi.nlm.nih.gov/Blast.cgi)分析与其他物种相似性。ExPASy Proteomics Server(http://ca.expasy.org/)对氨基酸序列进行蛋白预测分析 ;SMART(http://www. cbs.dtu.dk/services/TMHMM/)分 析氨基酸结构;用 Signal 4.1 Server(http:// www.cbs.dtu.dk/services/ SignalP)预测氨基酸序列信号肽;利用在线TMHMM工具(http://www.cbs.dtu.dk/services/TMHMM/)预测氨基酸跨膜区域;利用ClustalX软件将该氨基酸序列与已公布的Spook氨基酸序列进行同源性比对分析,并用MEGA 6.0软件的邻位法(Neighbor-Joining)构建系统进化树。
1.2.4 实时荧光定量PCR(qPCR)分析 将取好的组织抽取总RNA,取1.0 μg的RNA用Perfect Real Time PrimeScript®RT reagent Kit(TaKaRa)进行反转录获得cDNA。根据PtSpook cDNA全长设计一对荧光定量引物spQF1和spQR1(表1)检测PtSpook表达水平,Actin-F和Antin-R(表1)扩增三疣梭子蟹β-actin基因(FJ641977.1)作为内参。标准曲线用于验证PtSpook和β-actin基因引物的效率。按照SYBR®Premix Ex TaqTMII kit(TaKaRa)使用说明进行qPCR反应。反应条件如下:95℃ 2 min;95℃ 5 s,58℃ 20 s,68℃ 30 s,共40个循环。设定熔解曲线用于保证产物的特异性,条件如下:55-95℃,每秒上升0.2℃。每个cDNA重复3个平行。数据用±SEM方法表示。采用 2-△△Ct方法计算目的基因相对表达量[23]。选重复组中的一个组作为1。其他组的数值以重复组的倍数来表示。用SPSS Statistics软件进行单因素方差(ANOVA,Duncan’s test)分析,利用Excel对统计结果进行作图,P<0.05表示显著性差异。
2 结果
2.1 三疣梭子蟹Spook基因cDNA序列分析
将PCR产物的测序结果进行拼接,得到全长为2 200 bp的三疣梭子蟹Spook的cDNA序列。该序列已登录GenBank(登录号:KM030021),包含524 bp 的5'端非编码区,113 bp的3'端非编码区和1 563 b p的开放阅读框(ORF)(图1)。ORF编码520个氨基酸。ExPASy ProtParam Tool预测的蛋白分子式为C6472H10746N2200O2624S691,分子量大小约18.3 kD,等电点为4.84。Signal 4.1 Server和THMMHM分析发现其氨基酸序列第1位至第21位为氨基酸信号肽序列,并且有跨膜结构域。Blast比对发现,推导的氨基酸序列与果蝇(Drosophila melanogaster)、家蚕(Bombyx mori)、烟草天蛾(Manduca sexta)的相似性分别为36%、33%和37%。ClustalX软件比对分析显示,该氨基酸序包含经典的P450特征保守区域:helix-C、helix-I、helix-K、PERF和Hemebinding,且在其N末端有一段膜疏水序列(图2)。通过不同物种Halloween基因构建的系统进化树(图3)显示,推导的氨基酸序列与Spook聚为一支,亲缘关系较近。以上结果表明推导的氨基酸序列即为三疣梭子蟹的Spook的蛋白序列。

图1 三疣梭子蟹Spook的cDNA核苷酸序列和编码区氨基酸序列

图2 三疣梭子蟹Spook氨基酸序列与其他物种Spook氨基酸序列比对
2.2 组织表达差异分析
运用qPCR检测了Pt Spook在三疣梭子蟹表皮、卵巢、精巢、肝胰腺、大颚器、眼柄、胸神经节、Y器和心脏等9个组织中的表达情况,结果(图4)表明PtSpook表达量在Y器(YO)中最高,极显著高于眼柄、心脏、表皮等其他组织(P<0.05)。
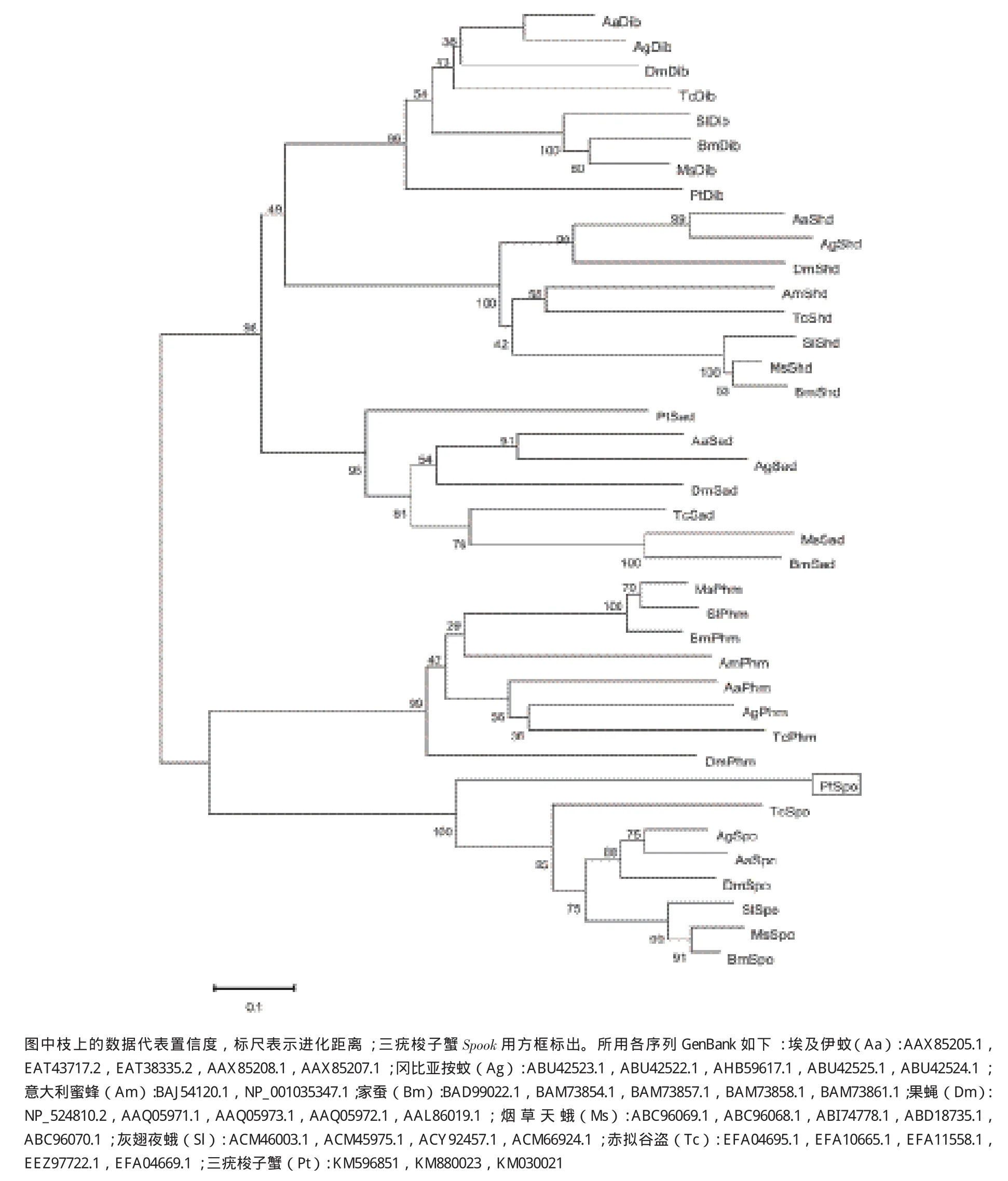
图3 Spook基因系统进化树
2.3 三疣梭子蟹Spook基因在蜕皮周期中的表达水平变化
根据组织表达结果,选取YO研究PtSpook在蜕皮周期中的表达变化。结果(图5)显示,PtSpook表达量在蜕皮后期(A期和B期)逐渐上升(P< 0.05),并在C期升至最大,之后在蜕皮前期逐渐下降,至D3、D4亚期降至最低。
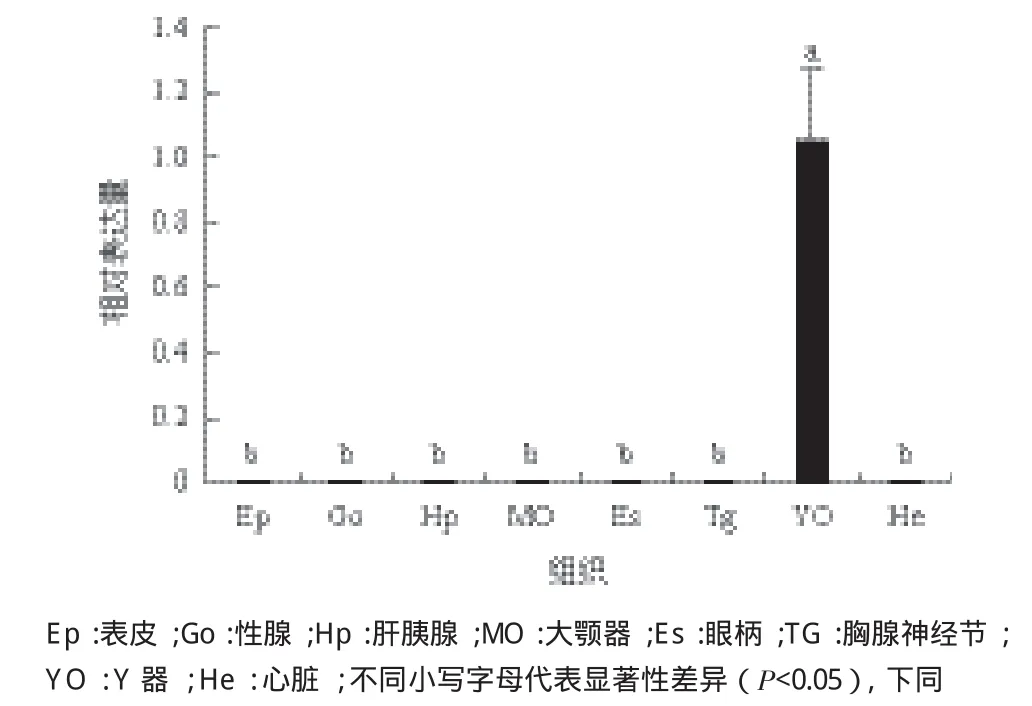
图4 Spook在三疣梭子蟹不同组织中的相对表达量
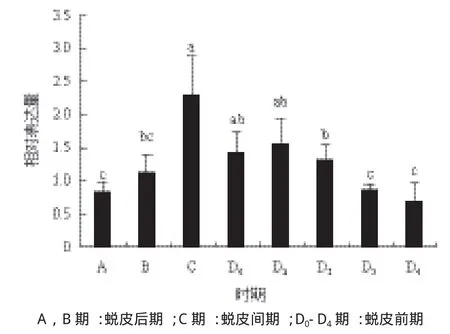
图5 YO中Spook在三疣梭子蟹中蜕皮周期的相对表达量
3 讨论
本研究克隆获得了三疣梭子蟹Spook基因的全长cDNA序列。Spook基因参与编码Spook,属于细胞色素P450超基因家族,该家族是由数量众多、功能复杂的一类血红蛋白酶基因组成,广泛存在于细菌、真菌和动植物生物中。其具有多样化的氧化酶作用,参与生物体中众多重要的生理过程[24]。很多其他Halloween基因诸如Spooki er、Spookiest、Phantom、Disembodied、Shadow也都各自编码不同的细胞色素P450。细胞色素P450家族成员虽然在氨基酸序列变异性很高,但仍存在一定的保守结构域。昆虫中报道的保守结构域包括helix-C、helix-I、helix-K、PERF和 heme-binding。Heme-binding(FXXGXXXCXG)为细胞色素P450的标志性基序。血红素铁接受电子被还原后再与CO结合,会在450 nm附近产生特征吸收峰,heme-binding中绝对保守的半胱氨酸作为血红素铁的第5配体参与此过程[25]。helix-C(WXXR)中的精氨酸能够与血红素的丙酸酯相结合。helix-I(AGXXT)基序能与氧原子结合,推测与血红素的远端侧的质子传递沟(proton transfer groove)有关。helix-K(EXXR)推测能与氢原子结合,与helix-K形成盐桥而参与稳定血红素核心结构的作用[26]。保守域PERF(PXXF)属于芳香族。P450还保有跨膜信号序列,是由甲硫氨酸开始15-20个疏水性的氨基酸构成,信号序列后 富含脯氨酸(P/G-rich),主要功能是指导P450 进入膜内或内质网腔中[27]。本研究推导的氨基酸序列经多重比对后发现,包含这5个保守结构域(图2)和信号肽序列(图1),证明其属于P450家族基因。此外,系统进化树显示该氨基酸序列与其他物种Spook一致性较高,共同聚为一支,鳞翅目(Lepidoptera)家蚕和烟草天蛾等聚为一支,再与双翅目(Diptera)昆虫果蝇等组成的分支聚为另一大支,最后与甲壳动物三疣梭子蟹聚为泛甲壳动物大类(图3)。以上结果与Rewitz等[28]和Zhou等[29]的研究结果一致,由此推断该序列为三疣梭子蟹Spook基因。
qRT-PCR结果表明,PtSpook在三疣梭子蟹的多个组织中均有不同程度的表达,其中YO中的表达极显著(P<0.05),该结果与三疣梭子蟹Disembodied基因的组织表达的特异性一致[30]。这进一步证实了YO是甲壳动物合成蜕皮激素的主要器官[31]。另外,PtSpook与昆虫Spook基因的组织表达特性也极其相似,昆虫Spook基因主要在其前胸腺(PG)组织中表达[29,32],这说明甲壳动物的YO和昆虫PG在功能上具有相似性。
作为Halloween家族基因成员之一,Spook通过参与蜕皮激素的合成,进而调控昆虫的多项生理功能。Chávez等[15]用酶免疫分析(EIA)方法检测到spook突变体中蜕皮酮(ecdysone)和20E含量极低,也无法检测到IMP-E1和L1等蜕皮激素后期响应基因的表达,表明果蝇的Spook基因参与了蜕皮激素合成。Namiki等[33]应用荧光标记差异显示技术得到了家蚕(Bombyx mori)的Spook基因,并发现其基因表达水平与血淋巴中蜕皮激素滴度呈正相关,同时还发现Spook突变后胚胎中蜕皮激素浓度降低并导致胚胎发育停滞。Ono等[32]在微粒体中检测到Spook编码产物,Spook突变体中添加20E、蜕皮酮或者三脱氧蜕皮酮都能挽救胚胎和幼虫发育停滞。本实验同样表明Spook基因可能通过参与三疣梭子蟹蜕皮激素的合成,进而实现对蜕皮的调控。在三疣梭子蟹的蜕皮周期中,Spook基因的表达水平与之前报道的三疣梭子蟹血淋巴中蜕皮激素浓度[34]和YO中Disembodied基因的表达水平[30]有着良好的协同关系,且其表达水平峰值出现较早。该结果表明三疣梭子蟹Spook作为蜕皮激素早期合成酶,其表达水平与下游合成酶和蜕皮激素合成均有着密切的联系。
4 结论
本研究首次克隆获得了三疣梭子蟹Spook基因的全长cDNA序列,其氨基酸序列与其他物种Spook一致性较高,共同聚为一支。组织差异表达分析显示三疣梭子蟹Spook在YO中最高,显著高于其他所检组织。在三疣梭子蟹蜕皮周期过程中,PtSpook在YO的表达水平自蜕皮后期(A、B期)逐渐上升,并在蜕皮间期(C期)上升至最大,随后在蜕皮前期逐渐下降至D3、D4亚期最低。该结果表明PtSpook可能参与调控三疣梭子蟹的蜕皮过程。
[1]Kuballa AV, Holton TA, Paterson B, et al. Moult cycle specific differential gene expression profiling of the crab Portunus pelagicus[J]. BMC Genomics, 2011, 12(1):147.
[2]Skinner DM. Molting and regeneration[J]. The Biology of Crustacea, 1985, 9:143-146.
[3]Butenandt A, Karlson P. Über die isolierung eines metamorphosehormons der insekten in kristallisierter form[J]. Zeitschrift für Naturforschung B, 1954, 9(6):389-391.
[4]Huber R, Hoppe W. Zur Chemie des Ecdysons, VII:Die Kristallund Molekülstrukturanalyse des Insektenverpuppungshormons Ecdyson mit der automatisierten Faltmolekülmethode[J]. Chemische Berichte, 1965, 98(7):2403-2424.
[5]Lachaise F, Le Roux A, Hubert M, et al. The molting gland of crustaceans:localization, activity, and endocrine control(a review)[J]. J Crust Biol, 1993, 13(2):198-234.
[6]Yoshiyama T, Namiki T, Mita K, et al. Neverland is an evolutionally conserved Rieske-domain protein that is essential for ecdysone synthesis and insect growth[J]. Development, 2006, 133(13):2565-2574.
[7]Thummel CS, Chory J. Steroid signaling in plants and insects—common themes, different pathways[J]. Genes & Development, 2002, 16(24):3113-3129.
[8]Böcking D, Dauphin-Villemant C, Sedlmeier D, et al. Ecdysteroid biosynthesis in moulting glands of the crayfish Orconectes limosus:evidence for the synthesis of 3-dehydroecdysone by in vitro synthesis and conversion studies[J]. Insect Biochemistry and Molecular Biology, 1993, 23(1):57-63.
[9]Mykles DL. Ecdysteroid metabolism in crustaceans[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2011, 127(3):196-203.
[10]Petryk A, Warren JT, Marqués G, et al. Shade is the Drosophila P450 enzyme that mediates the hydroxylation of ecdysone to the steroid insect molting hormone 20-hydroxyecdysone[J]. Proceedings of the National Academy of Sciences, 2003, 100(24):13773- 13778.
[11]Rewitz KF, Rybczynski R, Warren JT, et al. Developmental expression of Manduca shade, the P450 mediating the final step in molting hormone synthesis[J]. Molecular and Cellular Endocrinology, 2006, 247(1):166-174.
[12]Nüsslein-Volhard C, Wieschaus E, Kluding H. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster[J]. Wilhelm Roux’s Archives of Developmental Biology, 1984, 193(5):267-282.
[13]Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila[J]. Nature, 1980, 287(5785):795-801.
[14]Wieschaus E, Nüsslein-Volhard C, Jürgens G. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster[J]. Wilhelm Roux’s Archives of Developmental Biology, 1984, 193(5):296-307.
[15]Chávez VM, Marqués G, Delbecque JP, et al. The Drosophila disembodied gene controls late embryonic morphogenesis and codes for a cytochrome P450 enzyme that regulates embryonic ecdysone levels[J]. Development, 2000, 127(19):4115-4126.
[16]Warren JT, Petryk A, Marqués G, et al. Molecular and biochemical characterization of two P450 enzymes in the ecdysteroidogenic pathway of Drosophila melanogaster[J]. Proceedings of the National Academy of Sciences, 2002, 99(17):11043-11048.
[17]Warren JT, Petryk A, Marqués G, et al. Phantom encodes the 25-hydroxylase of Drosophila melanogaster and Bombyx mori:a P450 enzyme critical in ecdysone biosynthesis[J]. Insect Biochemistry and Molecular Biology, 2004, 34(9):991-1010.
[18]Hampshire F, Horn D. Structure of crustecdysone, a crustacean moulting hormone[J]. Chemical Communications(London), 1966(2):37-38.
[19]Soumoff C, Skinner DM. Ecdysteroid titers during the molt cycle of the blue crab resemble those of other Crustacea[J]. The Biological Bulletin, 1983, 165(1):321-329.
[20]Lachaise F, Lafont R. Ecdysteroid metabolism in a crab:Carcinus maenas L.[J]. Steroids, 1984, 43(3):243-259.
[21]Watson RD, Spaziani E. Biosynthesis of ecdysteroids from cholesterol by crab Y-organs, and eyestalk suppression of cholesterol uptake and secretory activity, in vitro[J]. General and Comparative Endocrinology, 1985, 59(1):140-148.
[22]沈洁, 朱冬发, 胡则辉, 等. 三疣梭子蟹蜕皮周期的分期[J].水产学报, 2011(10):1481-1487.
[23]Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T)method[J]. Nature Protocol, 2008, 3(6):1101-1108.
[24]Coon MJ. Cytochrome P450:nature’s most versatile biological catalyst[J]. Annu Rev Pharmacol Toxicol, 2005, 45:1-25.
[25]Werck-Reichhart D, Feyereisen R. Cytochromes P450:a success story[J]. Genome Biol, 2000, 1(6):3001-3009.
[26]艾均文, 董元凌, 孔卫青, 等. 家蚕细胞色素 P450 基因CYP6AE2 的分子克隆与序列分析[J]. 蚕业科学, 2007, 33(3):380-386.
[27]Gonzalez F. The molecular biology of cytochrome P450s[J]. Pharmacological Reviews, 1988, 40(4):243-288.
[28]Rewitz KF, Gilbert LI. Daphnia Halloween genes that encode cytochrome P450s mediating the synthesis of the arthropod molting hormone:evolutionary implications[J]. BMC Evolutionary Biology, 2008, 8(1):60.
[29]Zhou J, Zhang H, Li J, et al. Molecular cloning and expression profile of a Halloween gene encoding CYP307A1 from the seabuckthorn carpenterworm, Holcocerus hippophaecolus[J]. Journal of Insect Science, 2013, 13(1):56.
[30]柳志业, 朱冬发, 谢熙, 等. 三疣梭子蟹CYP302a1基因克隆及其表达分析[J]. 水产学报, 2015(5):628-637.
[31]Chang ES, O’Connor JD. Secretion of alpha-ecdysone by crab Y-organs in vitro[J]. Proceedings of the National Academy of Sciences, 1977, 74(2):615-618.
[32]Ono H, Rewitz KF, Shinoda T, et al. Spook and Spookier code for stage-specific components of the ecdysone biosynthetic pathway in Diptera[J]. Developmental Biology, 2006, 298(2):555-570.
[33]Namiki T, Niwa R, Sakudoh T, et al. Cytochrome P450 CYP307A1/ Spook:a regulator for ecdysone synthesis in insects[J]. Biochemical and Biophysical Research Communications, 2005, 337(1):367-374.
[34]汪春建, 朱冬发, 亓一舟, 等. 三疣梭子蟹蜕皮周期中 MIH基因 mRNA 水平与蜕皮激素浓度变化[J]. 水生生物学报, 2013, 37(1):22-28.
(责任编辑 李楠)
Cloning and Expression Analysis of Spook Gene in Portunus trituberculatus
ZHOU Yanqi ZHU Dong-fa
(The School of Marine Science,Ningbo University,Ningbo 315211)
Ecdysteroids in crustaceans are mainly synthesized and secreted in the Y-organs(YO),and involve in the many essential physiological activities such as molting,reproduction,etc. The cytochrome P450(CYP)307a1 encoded by Spook is the key enzyme in early steps of ecdysteroids biosynthesis. To study the regulatory role of Spook in molting process,the full-length cDNA of gene was cloned and characterized from Portunus trituberculatus(GenBank accession number:KM030021)by reverse transcription PCR(RT-PCR)and RACE,designated as Pt-Spook. The cDNA of Pt-Spook was 2 200 bp in length and contained an opening reading frame(ORF)of 1 563 bp encoding 520 amino acid residues. Multiple alignment revealed that the Pt-Spook contained 5 conserved domains of helix-C,helix-K,helix-I,PERF and heme-binding. The analysis by phylogenetic tree discovered that the Pt-Spook clustered in the same branch with other species,however,Halloween genes were in another branch,indicating that the deduced amino acid sequence was truly the protein sequence of P. trituberculatus Spook. The tissue distribution of Pt-Spook was detected by qPCR,and the results showed that Pt-spook expression was highly specific to YO. During the molt cycle,the expression of Pt-spook gradually increased from post-molt(stage A and B),and reached the maximum in intermolt(stage C),then gradually decreased during pre-molt to the minimum in sub-stage D3and D4. The results suggested that the Pt-spook involved in the regulation of molt cycle in P. trituberculatus.
Portunus trituberculatus;Spook;molt cycle;gene clone;expression level
10.13560/j.cnki.biotech.bull.1985.2016.05.017
2015-12-05
国家自然科学基金项目(41376152,40976098)
周彦琦,女,硕士,研究方向:甲壳动物内分泌学;E-mail:zenlight@foxmail.com
朱冬发,男,教授,研究方向:甲壳动物遗传育种;E-mail:zhudongfa@nbu.edu.cn

