超声组织追踪成像评价右心室不同位点房室顺序起搏左心室心肌力学状态差异性
周 秘,孟庆国,马荣川,王思佳,谭 静,尹立雪,(.西南医科大学,四川 泸州 66000;.四川省医学科学院·四川省人民医院,四川 成都 6007;.遵义医学院,贵州 遵义 56000;.成都市温江区人民医院,四川 成都 6007)
超声组织追踪成像评价右心室不同位点房室顺序起搏左心室心肌力学状态差异性
周 秘1,孟庆国2,马荣川1,王思佳3,谭 静4,尹立雪1,2
(1.西南医科大学,四川 泸州 646000;2.四川省医学科学院·四川省人民医院,四川 成都 610072;3.遵义医学院,贵州 遵义 563000;4.成都市温江区人民医院,四川 成都 610072)
目的 应用二维超声组织追踪成像(two-dimensional ultrasound tissue tracking imaging,2DTT)评价右心室室间隔起搏(right ventricular septal pacing,RVSP)和右心室心尖起搏(right ventricular apical pacing,RVAP)左心室心肌力学状态差异性。 方法 60例有症状缓慢性心律失常并接受永久双腔房室顺序起搏器植入术后患者,根据起搏部位不同分为RVSP组25例及RVAP组35例。均行超声心动图检查,分别获取心尖四腔、心尖三腔及心尖两腔二维图像,测量收缩期左心室节段纵向应变(longitudinal strain,LS)及节段纵向应变率(longitudinal strain rate,LSr)、左心室整体纵向应变(global longitudinal strain,GLS)、整体纵向应变率(global longitudinal strain rate,GLSr)及节段纵向应变达峰时间(peak time of longitudinal strain,Tsl),计算间隔-后壁延迟比率,比较两种右心室起搏位点左心室心肌力学状态差异。结果 两组间临床特征及常规超声心动图测量参数差异无统计学意义(P> 0.05)。 RVAP组LS值以及GLS值低于RVSP组,差异有统计学意义(P<0.05)。RVAP组节段纵向应变达峰时间较RVSP组明显延长(P<0.05),间隔-后壁延迟比率差异无统计学意义(P>0.05)。 结论 与RVSP相比,RVAP造成了明显的左心室收缩不同步和左心室纵向收缩功能减低,RVSP是房室顺序心脏起搏较好的心室位点。
超声心动图;纵向应变;达峰时间;室间隔;心尖;起搏
现有研究表明右心室起搏心室电兴奋过程类似左束支传导阻滞。右心室心尖起搏(right ventricular apical pacing,RVAP)介导右心室除极完全依靠右束支传导,由右室心尖缓慢传导至基底;而左心室除极由于有限的或者不完整的希氏-普肯野传导系统参与,主要依靠心肌细胞与细胞之间的传播,因此整体心室电兴奋从右心室游离壁到室间隔,再由室间隔沿左心室心肌向左后方除极,完全改变了左心室的除极的模式和速度[1~4]。RVAP导致的长期左心室电兴奋过程异常,有可能会造成进行性左心室功能障碍、心房颤动、心力衰竭加重,发病率和死亡率增加[5,6]。上述严重临床问题可能与心脏起搏导致左心室异常电机械兴奋重构及其整体左心室力学和节段性收缩不同步有关。既往研究表明右心室室间隔起搏(right ventricular septal pacing,RVSP)作为缩短起搏QRS波宽度及减低机械不同步的起搏方法之一,有可能避免患者RVAP后的左心室功能不全[7,8]。超声二维组织追踪成像无角度依赖,能多向评估左心室心肌力学和功能,并能检测心室心肌力学状态的细微变化。研究表明,采用GLS预测亚临床左心室功能障碍优于常规的左心室射血分数[9]。因此,系统评价不同右心室起搏位点的GLS及其关联力学参数变化可能有助于深入揭示不同心室起搏位点的心肌力学变化规律,发现心室心肌力学功能障碍的关键节点。本研究拟通过对左心室心肌力学系统性观测,进一步确认不同右心室起搏位点对左心室功能的影响,为临床优化心脏起搏位点提供心肌力学依据。
1 资料与方法
1.1 一般资料 选择2013年12月至2016年4月于四川省医学科学院· 四川省人民医院行永久双腔起搏器植入术后6月至1年的患者60例,均为有症状的病窦综合征患者、高度房室传导阻滞患者,符合美国心脏病协会2008年发布的心脏节律异常的装置治疗指南。排除存在冠状动脉粥样硬化性疾病、心脏瓣膜病、心肌病变、左心室收缩功能减低(LVEF<50%)及慢性心房颤动的患者。根据透视和超声心动图及特征性心电图表现确定的右心室起搏位置分为RVSP组和RVAP组,其中RVSP组男9例,女16例,年龄31~83 岁[(65.84 ±13.01)岁];RVAP组男性12例,女性23例,年龄40~86 岁[(69.52 ±9.73)岁]。两组间一般情况比较,差异无统计学意义(P> 0.05),见表1。

表1 两组一般情况比较
1.2 方法 采用日本ALOKA Prosound F75型彩色多普勒超声诊断仪,相控阵探头,探头频率1.88~5.00 MHz。患者左侧卧位,平静呼吸,同步记录II导联体表心电图,见图1。采集标准心尖四腔、三腔、二腔切面二维动态图,并以50~60帧/秒完整采集3个心动周期。以原始数据储存至移动硬盘以备脱机分析。在心尖五腔切面“PW/PW”模式同时获取二尖瓣血流频谱/主动脉瓣血流频谱,分别在二尖瓣前向血流频谱记录和计算舒张早期峰值速度(E peak flow velocity,E)、舒张晚期峰值速度(A peak flow velocity,A)和E/A比值、二尖瓣减速时间(E wave deceleration time,EDT)、等容舒张时间(isovolumic relaxation time,IVRT);在主动脉瓣前向血流频谱测量射血时间(ejection time,ET),见图2。
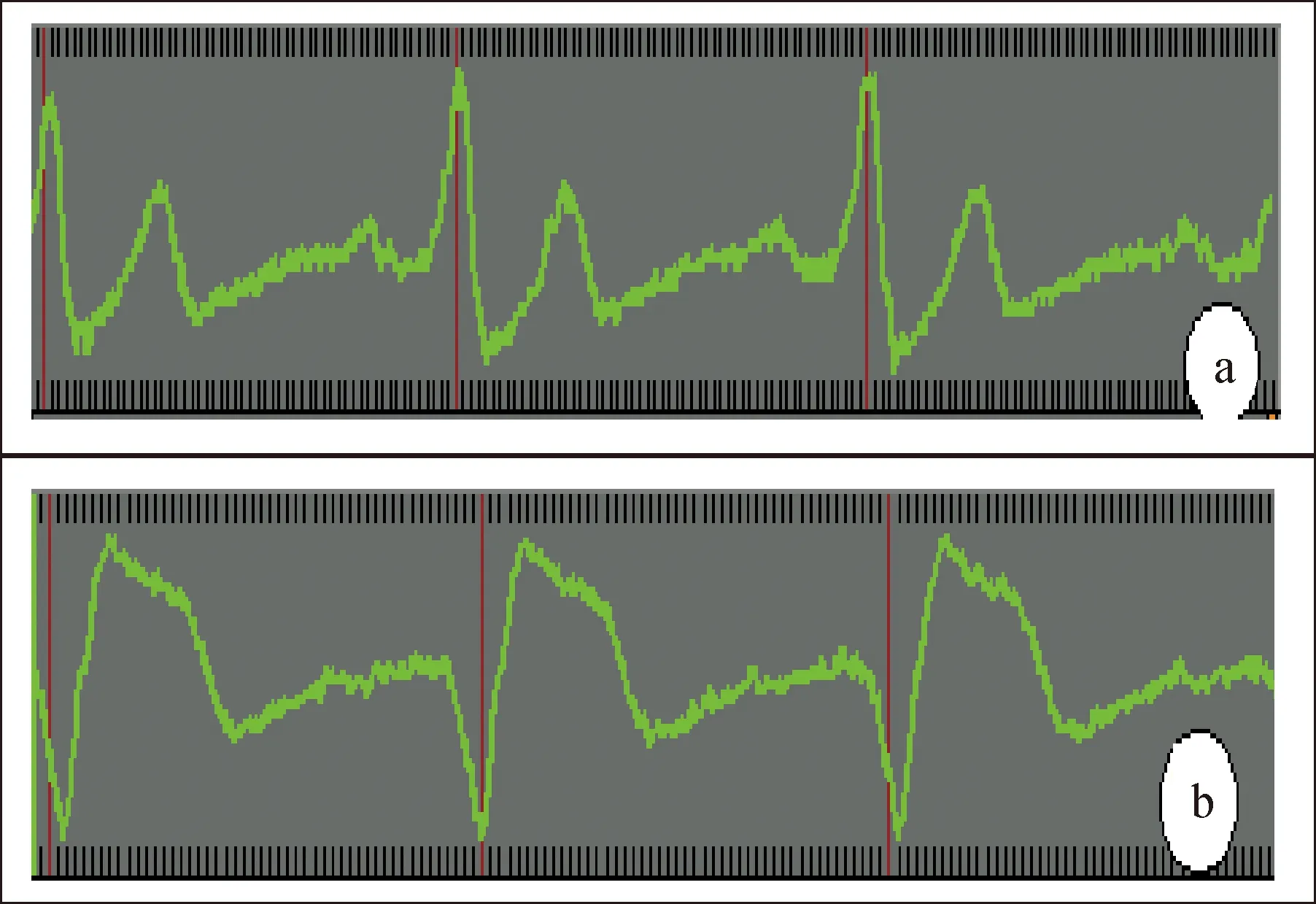
图1 同步II导联体表心电图特征 a:RVSP组呈主波向上的QRS波,时限较短;b:RVAP组呈主波向下的宽QRS波
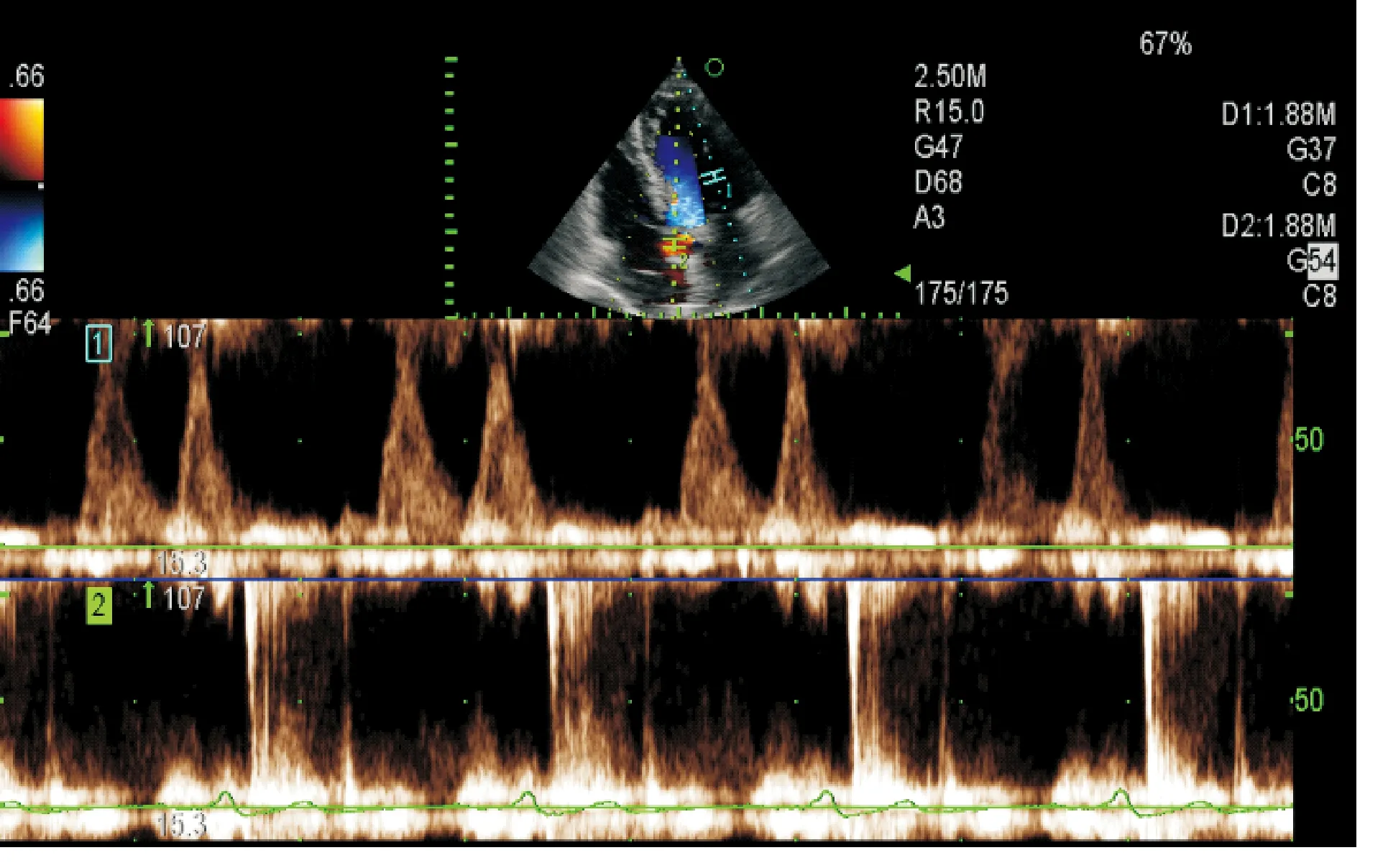
图2 pw/pw模式同时获取二尖瓣前向血流频谱/主动脉瓣前向血流频谱
所有数字图像在工作站上使用自动成像分析软件(DAS-RS1,2DTT,ALOKA)。收缩末期手动描绘心内膜和心外膜,确定后生成一个环状感兴趣区域,软件自动将每一侧室壁分为基底段、中间段及心尖段(见图3),共18节段,并生成随心动周期各时相点变化的应变及应变率曲线。选取收缩末期每个节段的LS、LSr及Tsl。间隔与后壁的Tsl差值大于130 ms为间隔-后壁延迟,计算每一组的间隔-后壁延迟比率。GLS与GLSr分别由所有节段的平均应变及平均应变率计算得到。所有应变峰值均取连续三个心动周期的平均值用于进一步的数据分析。排除追踪失败无法分析的室壁节段最后共918个室壁节段进行了分析。
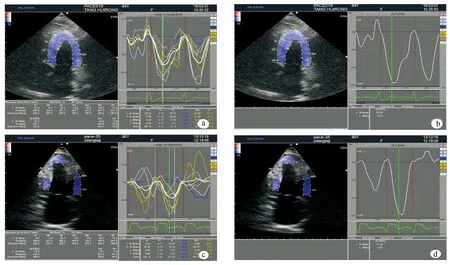
图3 LS、LSr、GLS、GLSr及Tsl自动成像分析 a:RVSP组前壁与后壁分别在基底段、中间段及心尖段的LS,LSr及Tsl;b:RVSP组GLS及GLSr;c:RVAP组前壁与后壁分别在基底段、中间段及心尖段的LS、LSr及Tsl;d:RVAP组GLS及GLSr
1.3 重复性检验 间隔一个月同一检查者随机从入选对象中选择8例重新勾画心内膜及心外膜获取各参数值进行组内重复性检验,计算组内相关系数(intraclass correlation coefficient,ICC)及变异系数(coefficient of variation,COV)。由另外一名经验相当的检查者对随机入选对象再次勾画获取各参数并再次计算,以进行组间重复性检验。
1.4 统计学方法 采用SPSS 17.0 统计软件进行数据分析。计量资料以均数±标准差表示,正态分布资料组间比较采用独立样本t检验,非正态分布资料采用Wilcoxon 秩和检验;计数资料采用率表示,组间比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1 RVSP组及RVAP组常规超声心动图比较 两组间E、A、E/A比值、ET、EDT、IRT比较,差异均无统计学意义(P> 0.05),见表2。

表2 超声心动图测量参数
2.2 RVSP组及RVAP组左心室心肌收缩期纵向力学参数比较 RVSP组室间隔中间段、室间隔心尖段及前壁中间段的LS值高于RVAP组;前室间隔心尖段LSr值高于RVAP组;室间隔基底段、室间隔心尖段、侧壁基底段、侧壁中间段、前室间隔中间段、前室间隔心尖段、前壁基底段、前壁心尖段、下壁基底段及下壁心尖段的Tsl值短于RVAP组,差异均有统计学意义,见表3。
2.3 RVSP组及RVAP组左心室心肌GLS及GLSr测值比较 RVSP组GLS 28.05%,高于RVAP组的12.35%,差异有统计学意义(Z=4.30,P= 0.001)。RVSP组及RVAP组GLSr分别为20.34 S-1和19.68 S-1,差异无统计学意义(Z=0.18,P= 0.86)。
2.4 RVSP组及RVAP组间隔-后壁延迟比较 RVSP组间隔-后壁延迟7例,RVAP组间隔-后壁延迟14例,两组比较差异无统计学意义(χ2=0.923,P= 0.247)。
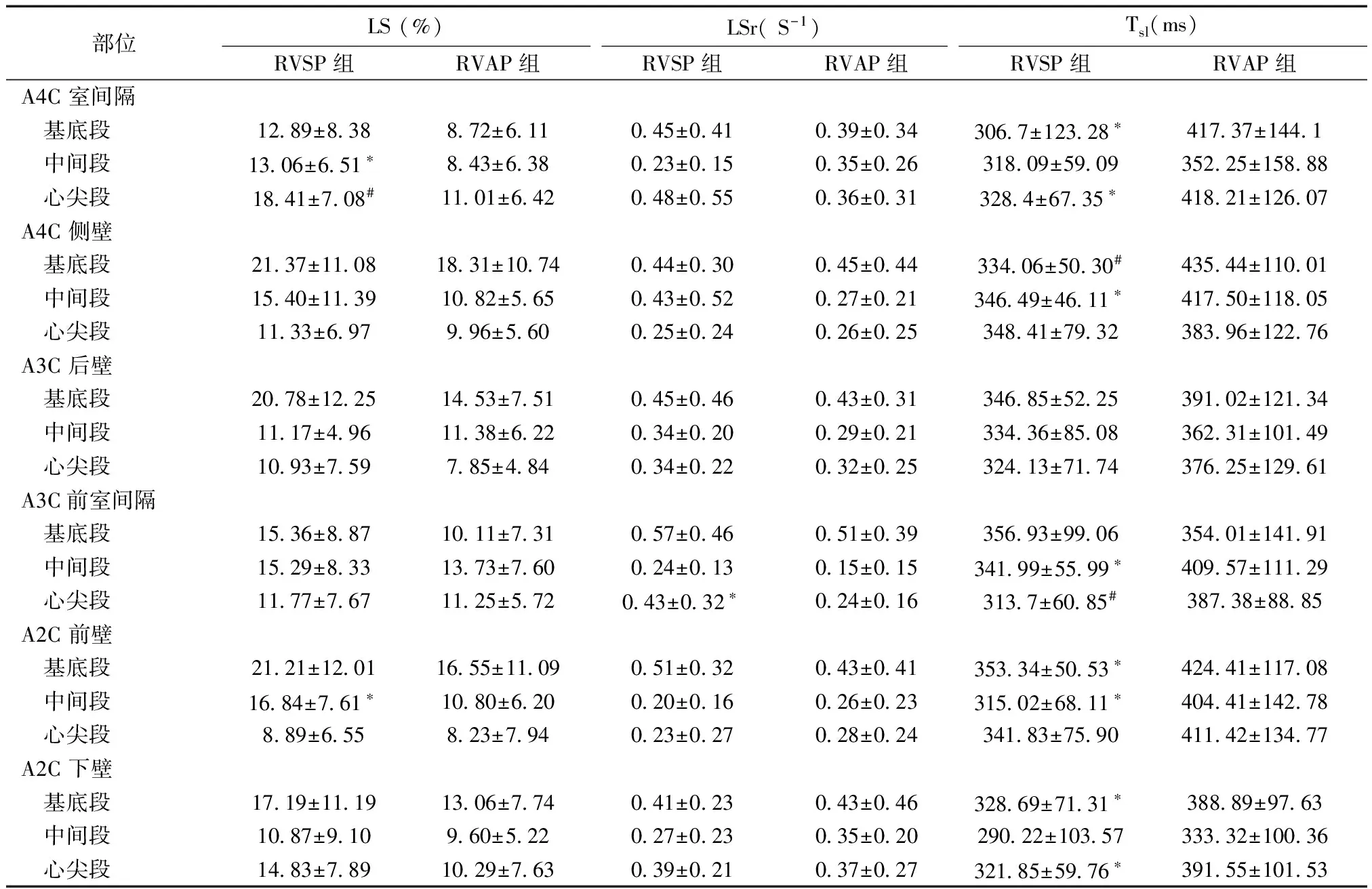
表3 左心室心肌收缩期纵向力学参数比较
与RVAP组比较,*P< 0.05; #P< 0.01
2.5 重复性检验结果 同一检查者组内各参数重复性检验,ICC 0.83~0.97,COV 0.16~0.31;不同检查者组间各参数重复性检验,ICC 0.80~0.98,COV 0.17~0.33。说明LS、GLS和Tsl各参数组内及组间重复性良好,数据离散度较小,见表4。
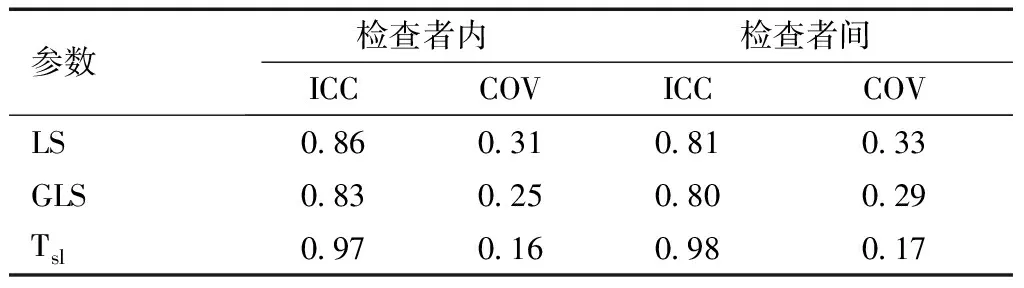
表4 重复性检验结果
3 讨论
RVAP可诱导产生一种心脏非生理性电机械激活顺序,可造成心脏血流灌注、肾上腺素能神经及节段性左心室收缩功能紊乱,从而使其结构以及收缩、舒张功能恶化[1,10]。因此,有必要寻找其他可替代RVAP更为优化的起搏位点。已有研究表明RVSP产生的QRS波时限更窄,左心室收缩异质性更少,导线位置更稳定,被认为是一个较RVAP更好的起搏方式[11,12]。虽然目前对RVSP起搏的研究较多,但是仍然缺乏RVSP左心室心肌力学状态优于RVAP的评价结果支撑。有研究表明基于GLS斑点追踪超声心动图评价左心室整体收缩功能及预测患者结局要优于常规变量如左心室射血分数和室壁运动指数,且具有很好的重现性[13,14]。
间隔-后壁延迟是指最早激活或者最大向后位移的室间隔、前室间隔与最晚激活或者最大向前位移的后壁、侧壁应变达峰时间的绝对差异在130 ms以上,代表心室内传导延迟或左心室不同步[15,16]。Tsl测量从QRS波起始处至室壁应变达峰值处。通过应变分析发现,在本研究中不是所有的患者均会发生间隔-后壁延迟,RVSP组间隔-后壁延迟7例(占28%),RVAP组14例(占40%),且RVAP组左心室心肌各节段的Tsl较RVSP均有不同程度的延长,RVAP更多患者表现出左室收缩不同步可能与RVAP触发模拟宽QRS波左束支传导阻滞电效应模式关联。然而,目前尚不清楚为什么有些患者出现显著的左心室不同步,另外一些患者不出现。Mohamed等[17]计算心尖4腔切面上相邻节段应变峰值的差值再相加并取平均数,得到一个反应基底-心尖机械传播不同步的新指标,并且认为间隔基底-心尖段延迟>50 ms以上预测EF下降的灵敏度为81%,特异度为88%。
RVAP组左心室心肌部分室壁节段的LS及GLS值较RVSP组显著下降,而LSr仅前室间隔心尖段差异显著,GLSr下降不具有统计学意义。这可能与RVAP组拟左束支传导阻滞起搏模式导致大量树枝状分布的肌纤维之间不能同时有效激活及收缩运动造成RVAP组的Tsl较RVSP组明显延迟从而GLS明显降低。而RVSP组LS、GLS及Tsl优于RVAP组,可能与RVSP心室主动电极位于前室间隔而更接近于生理性起搏模式以及相较于RVAP更多普肯野纤维传导的参与。冲动沿浦肯野纤维快速传导使弥漫性树枝状肌纤维更好地去极化,收缩运动也更协调一致[18,19]。通常LSr在基底段、中间段、心尖段大小平衡,不呈现从基底到心尖的递减趋势[20]。观察发现RVAP组仍然保留LSr在心室各节段的均衡分布,这可能是两组间GLSr差异不具有统计学意义的原因。此外,收缩期心肌缩短,纵向应变为负值,当某一节段心肌出现矛盾运动或者不能有效收缩时为正值或零。本研究分析所有应变值的绝对值,可造成组内及组间的差异均减小。
虽然本研究数据显示,RVSP左室力学参数及心室间电机械同步性优于RVAP,QRS波间期也更窄,但有研究报道更多依赖心室起搏的患者采用RVSP方式与RVAP相比并没有减少心脏事件的发生及改善长期起搏后的临床结果[21]。此外对室间隔起搏非常重要的一点是放置心室导线位置要接近传导系统,但是将起搏导线植入在右心室室间隔并捕获右束支仍然是一大难点[22]。
本研究存在一些局限性。首先由于组织追踪对图像要求较高,因此我们只能够采用少量图像质量好的患者,并排除追踪失败的图像,这可能导致抽样误差。第二,这项研究纳入的是起搏器植入术后6月至1年的患者因此不能外推到RVAP和RVSP对左心室功能的长期影响。在以后的研究中还需联合径向应变、周向应变、心室旋转及扭转角度分析并结合起搏器心室起搏、心室感知的数量多少以获得右心室起搏对左心室功能长期影响的额外信息。
总之,RVSP可一定程度减少非生理性起搏导致左心室收缩不同步产生的不利影响及左心室整体纵向功能恶化。因此当严重的心脏病患者需要右心室起搏时,RVSP可能是一种有效的、优选的植入方式。
[1] Bernier M,Josephson ME.Right Ventricular Electrical Activation in Heart Failure During Right,Left and Biventricular Pacing[J].JACC Cardiovascular Imaging,2010,3(6): 567-575.
[2] Varma N.Left ventricular electrical activation during right ventricular pacing in heart failure patients with LBBB: Visualization by electrocardiographic imaging and implications for cardiac resynchronization therapy[J].Journal of Electrocardiology,2015,48(1):53-61.
[3] 尹立雪.现代超声心脏电生理学[M].北京:人民军医出版社,2007:359
[4] Manolis AS,Sakellariou D,Andrikopoulos GK.Alternate site pacing in patients at risk for heart failure.[J].Angiology,2008,59(2 Suppl):97 S-102 S.
[5] Ju-Yi C,Wei-Chuan T,Liu YW,et al.Long-Term Effect of Septal or Apical Pacing on Left and Right Ventricular Function after Permanent Pacemaker Implantation[J].Echocardiography,2013,30(7):812-829.
[6] Barold SS.Adverse effects of ventricular desynchronization induced by long-term right ventricular pacing [J].Journal of the American College of Cardiology,2003,42(4):624-626.
[7] Cano O,Osca J,Sancho MJ.Comparison of Effectiveness of Right Ventricular Septal Pacing Versus Right Ventricular Apical Pacing[J].American Journal of Cardiology,2010,105(10):1426-1432.
[8] Yusu S,Mera H,Hoshida K,et al.Selective site pacing from the right ventricular mid-septum.Follow-up of lead performance and procedure technique[J].International Heart Journal,2012,53(53):113-116.
[9] Nahum J,Bensaid A,Dussault C,et al.Impact of longitudinal myocardial deformation on the prognosis of chronic heart failure patients[J].Circulation Cardiovascular Imaging,2010,3(3):249-256.
[10]Zhou ZW,Zhang BC,Yu Y,et al.Acute impact of pacing at different cardiac sites on left ventricular rotation and twist in dogs[J].Plos One,2014,9(10):e111231.
[11]Rosso R,Teh AW,Medi C,et al.Right Ventricular Septal Pacing: The Success of Stylet-Driven Active-Fixation Leads[J].Pacing & Clinical Electrophysiology,2010,33(1):49-53.
[12]Shimony A,Eisenberg MJ,Filion KB,et al.Beneficial effects of right ventricular non-apical vs.apical pacing: a systematic review and meta-analysis of randomized-controlled trials.[J].Europace,2011,14(1):81-91.
[13]Pedrizzetti G,Mangual J,Tonti G.On the geometrical relationship between global longitudinal strain and ejection fraction in the evaluation of cardiac contraction[J].Journal of Biomechanics,2014,47(3):746-749.
[14]Stanton T,Leano R,Marwick TH.Prediction of Mortality from Global Longitudinal Strain: Comparison with Ejection Fraction and Wall Motion Scoring[J].Information Sciences,2009,275(3):127-144.
[15]Suffoletto MS,Dohi K,Cannesson M,et al.Novel speckle-tracking radial strain from routine black-and-white echocardiographic images to quantify dyssynchrony and predict response to cardiac resynchronization therapy[J].Circulation,2006,113(7):960-968.
[16]Ypenburg C,Westenberg J J,Bleeker GB,et al.Noninvasive Imaging in Cardiac Resynchronization Therapy—Part 1: Selection of Patients[J].Pacing & Clinical Electrophysiology,2008,31(11):1475-1499.
[17]Ahmed M,Rd GJ,Marek J,et al.Right ventricular apical pacing-induced left ventricular dyssynchrony is associated with a subsequent decline in ejection fraction.[J].Heart Rhythm the Official Journal of the Heart Rhythm Society,2014,11(4):602-608.
[18]Siu CW,Wang M,Zhang XH,et al.Analysis of ventricular performance as a function of pacing site and mode.[J].Progress in Cardiovascular Diseases,2008,51(2):171-182.
[19]Alhous MH,Small GR,Hannah A,et al.Impact of temporary right ventricular pacing from different sites on echocardiographic indices of cardiac function[J].Europace : European pacing,arrhythmias,and cardiac electrophysiology,2011,13(12):1738-1746.
[20]王新房.超声心动图学[M].第4版.北京:人民卫生出版社,2014:112.
[21]Sakatani T,Sakamoto A,Kawamura K,et al.Clinical Outcome After Permanent Pacemaker Implantation in Patients With a High Percentage of Ventricular Pacing[J].International Heart Journal,2015,56(6):622-625.
[22]Kaye GC,Linker NJ,Marwick TH,et al.Effect of right ventricular pacing lead site on left ventricular function in patients with high-grade atrioventricular block: results of the Protect-Pace study[J].European Heart Journal,2014,36(14):856-856.
Evaluation of differences in left ventricular myocardial mechanical patterns between right ventricular pacing sites and atrioventricular sequential pacing using ultrasonic tissue tracking imaging
ZHOUMi1,MENGQing-guo2,MARong-chuan1,WANGSi-jia3,TANJing4,YINLi-xue1,2
(1.SouthwestMedicalUniversity,Luzhou646000,China; 2.DepartmentofSichuanAcademyofMedicalScience&SichuanProvincialPeople’sHospital,Chengdu610072,China; 3.ZunyiMedicalCollege,Zunyi, 563000,China; 4.WenjiangDistrictPeople’sHospital,Chengdu610072 ,China)
YINLi-xue
Objective The difference in left ventricular myocardial mechanical patterns between right ventricular septal pacing (RVSP) and right ventricular apical pacing (RVAP) was evaluated by two-dimensional ultrasonic tissue tracking imaging (2-DTT). Methods The studied subjects were 60 patients with symptomatic bradyarrhythmia who had undergone dual-chamber atrioventricular sequential permanent pacemaker implantation. They were divided into RVSP group (n= 25) and RVAP group (n= 35). The 2D tissue Doppler images of apical four, three and two chambers were acquired. The left ventricular systolic segmental longitudinal strain (LS) and longitudinal strain rate (LSr), left ventricular global longitudinal strain (GLS) and global longitudinal strain rate (GLSr) as well as segmental longitudinal strain peak time (Tsl) were measured. The interseptum- posterior wall delay ratio was calculated for the differentiation in left ventricular myocardial mechanical patterns between the two right ventricular pacing sites. Results There was no significant difference in clinical variables and echocardiographic measurements between the two groups. The LS and GLS in the RVAP group were lower than those in the RVSP group (P< 0.05). The peak time of systolic segmental longitudinal strain in the RVAP group was significantly longer than that in the RVSP group (P< 0.05). The interseptum-posterior wall delay ratio was not significantly different between the two groups (P> 0.05). Conclusion RVAP induces a worse left ventricular systolic synchrony, and deteriorates the left ventricular longitudinal systolic function significantly. RVSP is prefered as a ventricular pacing site in the atrioventricular sequential cardiac pacing for better left ventricular mechanical performance.
Echocardiography; Global longitudinal strain; Peak time; Septal pacing; Apical pacing.
四川省科研院所科技成果转化基金资助项目(编号:10010122)
尹立雪,男,主任医师,教授,博士生导师博士后导师。中华医学会超声医学分会副主任委员兼心脏学组组长,中国医师协会超声医师分会前副会长,四川省医学会超声专业委员会候任主任委员,四川省医师协会超声医师专科委员会候任主任委员。研究方向:心血管疾病的超声诊断与治疗。
540.4+5
A
1672-6170(2016)05-0024-05
2016-07-20)

